%EB%B0%95%ED%9D%AC%EC%84%B1
-
 암과 치매 등 맞춤형 신약 발굴 플랫폼 개발
우리 대학 화학과 박희성 교수 연구팀이 질병을 유발하는 다양한 바이오마커들에 맞추어 재단하듯이 디자인이 가능한 고리형 펩타이드*기반 신약 발굴 플랫폼 기술을 개발했다고 21일 밝혔다.
*고리형 펩타이드: 기본 선형으로 이루어진 펩타이드를 약리 효과를 높일수 있도록 고리형태의 구조로 만들어진 아미노산 중합체를 지칭함
고리형 펩타이드는 낮은 독성과 뛰어난 약리 활성으로 인해 많은 주목을 받아왔지만 자유롭게 디자인하고 제조하기가 어려워 실제 신약 개발에 활용되기 어려운 단점이 있었다. 박 교수팀은 암을 포함한 다양한 질병들에 대한 치료제 후보물질 발굴에 매우 유용하게 활용될 수 있도록 이러한 고리형 펩타이드의 맞춤형 디자인을 가능하게 하는 신약 발굴 플랫폼 기술을 개발하는데 성공하였다.
우리 몸의 세포에서 만들어지는 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상되어 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 제어할 수 있는 후보물질의 탐색이 용이하지 않아서 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 지난 2016년 다양한 비정상 변형 단백질을 합성할 수 있는 단백질 변형기술을 개발해 `사이언스(Science)' 지에 논문을 발표한 바 있다.
*논문명: A chemical biology route to site-specific authenic protein modifications
연구팀은 기존 연구를 더 발전시켜 질병의 원인이 되는 비정상적인 단백질 변형을 제어할 수 있는 고리형 펩타이드를 효과적으로 디자인하고 탐색하는 스크리닝 플랫폼 기술을 개발했다.
연구팀은 이 기술을 활용해 비정상적인 단백질에 결합하여 다양한 종류의 암을 유발하는 원인으로 알려진 종양 바이오마커인 HDAC8(histone deaceytylase 8)의 활성을 저해하는 고리형 펩타이드를 효과적으로 발굴할 수 있음을 증명했다.
박희성 교수는 "이 기술이 실용화될 경우 다양한 질병에 대한 혁신신약 후보물질 탐색이 실질적으로 가능해질 것으로 전망된다ˮ며 "향후 맞춤형 표적 항암제 및 뇌 신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다ˮ고 말했다.
이번 연구는 과학기술정보통신부(장관 이종호)가 창의성 기초연구를 촉진하는 개인연구사업 중견연구와 미래 과학기술을 선도하는 연구자를 발굴하는 삼성미래기술육성사업재단(이사장 김성근)의 지원을 받아 수행됐다.
화학과 강덕희 박사와 김도욱 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지인 `앙게반테 케미(Angewandte Chemie International Edition)' 2023년 1월 16일 자 온라인판으로 게재됐다.
*논문명: A Versatile Strategy for Screening Cutson-Designed Warhead-Armed Cyclic Peptide Inhibitors
2023.02.21 조회수 8432
암과 치매 등 맞춤형 신약 발굴 플랫폼 개발
우리 대학 화학과 박희성 교수 연구팀이 질병을 유발하는 다양한 바이오마커들에 맞추어 재단하듯이 디자인이 가능한 고리형 펩타이드*기반 신약 발굴 플랫폼 기술을 개발했다고 21일 밝혔다.
*고리형 펩타이드: 기본 선형으로 이루어진 펩타이드를 약리 효과를 높일수 있도록 고리형태의 구조로 만들어진 아미노산 중합체를 지칭함
고리형 펩타이드는 낮은 독성과 뛰어난 약리 활성으로 인해 많은 주목을 받아왔지만 자유롭게 디자인하고 제조하기가 어려워 실제 신약 개발에 활용되기 어려운 단점이 있었다. 박 교수팀은 암을 포함한 다양한 질병들에 대한 치료제 후보물질 발굴에 매우 유용하게 활용될 수 있도록 이러한 고리형 펩타이드의 맞춤형 디자인을 가능하게 하는 신약 발굴 플랫폼 기술을 개발하는데 성공하였다.
우리 몸의 세포에서 만들어지는 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상되어 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 제어할 수 있는 후보물질의 탐색이 용이하지 않아서 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 지난 2016년 다양한 비정상 변형 단백질을 합성할 수 있는 단백질 변형기술을 개발해 `사이언스(Science)' 지에 논문을 발표한 바 있다.
*논문명: A chemical biology route to site-specific authenic protein modifications
연구팀은 기존 연구를 더 발전시켜 질병의 원인이 되는 비정상적인 단백질 변형을 제어할 수 있는 고리형 펩타이드를 효과적으로 디자인하고 탐색하는 스크리닝 플랫폼 기술을 개발했다.
연구팀은 이 기술을 활용해 비정상적인 단백질에 결합하여 다양한 종류의 암을 유발하는 원인으로 알려진 종양 바이오마커인 HDAC8(histone deaceytylase 8)의 활성을 저해하는 고리형 펩타이드를 효과적으로 발굴할 수 있음을 증명했다.
박희성 교수는 "이 기술이 실용화될 경우 다양한 질병에 대한 혁신신약 후보물질 탐색이 실질적으로 가능해질 것으로 전망된다ˮ며 "향후 맞춤형 표적 항암제 및 뇌 신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다ˮ고 말했다.
이번 연구는 과학기술정보통신부(장관 이종호)가 창의성 기초연구를 촉진하는 개인연구사업 중견연구와 미래 과학기술을 선도하는 연구자를 발굴하는 삼성미래기술육성사업재단(이사장 김성근)의 지원을 받아 수행됐다.
화학과 강덕희 박사와 김도욱 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지인 `앙게반테 케미(Angewandte Chemie International Edition)' 2023년 1월 16일 자 온라인판으로 게재됐다.
*논문명: A Versatile Strategy for Screening Cutson-Designed Warhead-Armed Cyclic Peptide Inhibitors
2023.02.21 조회수 8432 -
 박희성 교수, 이달의 과학기술인상 5월 수상자 선정
〈 박 희 성 교수 〉
우리 대학 화학과 박희성 교수가 ‘이달의 과학기술인상’ 5월 수상자로 선정됐다.
이달의 과학기술인상은 우수한 연구개발 성과로 과학기술 발전에 공헌한 연구 개발자를 매월 1명씩 선정하는 상으로 과학기술정보통신부 장관상과 상금 1천만 원을 수여한다.
과학기술정보통신부와 한국연구재단은 선정 배경에 대해 박희성 교수가 암, 치매 등 각종 질병 유발에 관여하는 단백질 변형을 인위적으로 제어할 수 있는 ‘맞춤형 단백질 변형기술’을 개발해 질병의 원인 규명과 신약 개발 연구의 단초를 마련한 공로가 높이 평가됐다고 밝혔다.
우리 몸의 단백질은 인산화, 당화, 아세틸화, 메틸화 등 200여 종의 다양한 변형(post-translational modification)을 통해 생체 신호를 전달하고 세포의 성장·분열 같은 신진대사를 조절한다. 하지만 유전적·환경적 요인으로 인한 비정상적 단백질 변형은 암, 치매, 당뇨 등 각종 퇴행성 질환과 만성질환의 원인이 된다.
많은 학자들이 단백질 변형에 따른 세포내 기능 연구와 질병의 연관성을 밝히기 위해 맞춤형 단백질 개발 연구를 진행했지만 기존 기술로는 원하는 변형을 갖는 단백질을 제조하는 것이 불가능했다.
박희성 교수는 박테리아의 생합성 경로를 재설계하고 비천연 아미노산을 표적단백질에 위치 특이적으로 첨가하는 방법으로 2011년 단백질 변형 중 가장 광범위한 단백질 인산화 제어에 성공했다.
이후 후속연구를 통해 비천연 아미노산의 특이적인 화학 반응성을 이용해 단백질 표면에서 탄소-탄소 결합을 일으켜 당화, 메틸화 등 200여 종의 맞춤형 단백질을 제조할 수 있는 기술을 최초로 개발했다.
박 교수팀은 퇴행성 신경질환의 원인중 하나로 알려진 비정상적 단백질 아세틸화를 실험용 쥐를 이용한 동물 모델에서 직접 구현했다.
이를 통해 실험용 쥐의 특정 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있었다. 또 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질이 아세틸화 변형 제어가 가능한 것도 확인했다.
박희성 교수는 “이 연구는 단백질 표면에서 선택적으로 탄소 간 결합을 일으켜 맞춤형으로 변형을 유발시키는 획기적인 단백질 변형 방법으로 암, 치매 등 단백질의 비정상적인 변형으로 유발되는 다양한 질병들에 대한 원인 규명과 치료제 개발에 돌파구를 마련하는 연구 결과이다” 고 말했다.
2018.05.03 조회수 16024
박희성 교수, 이달의 과학기술인상 5월 수상자 선정
〈 박 희 성 교수 〉
우리 대학 화학과 박희성 교수가 ‘이달의 과학기술인상’ 5월 수상자로 선정됐다.
이달의 과학기술인상은 우수한 연구개발 성과로 과학기술 발전에 공헌한 연구 개발자를 매월 1명씩 선정하는 상으로 과학기술정보통신부 장관상과 상금 1천만 원을 수여한다.
과학기술정보통신부와 한국연구재단은 선정 배경에 대해 박희성 교수가 암, 치매 등 각종 질병 유발에 관여하는 단백질 변형을 인위적으로 제어할 수 있는 ‘맞춤형 단백질 변형기술’을 개발해 질병의 원인 규명과 신약 개발 연구의 단초를 마련한 공로가 높이 평가됐다고 밝혔다.
우리 몸의 단백질은 인산화, 당화, 아세틸화, 메틸화 등 200여 종의 다양한 변형(post-translational modification)을 통해 생체 신호를 전달하고 세포의 성장·분열 같은 신진대사를 조절한다. 하지만 유전적·환경적 요인으로 인한 비정상적 단백질 변형은 암, 치매, 당뇨 등 각종 퇴행성 질환과 만성질환의 원인이 된다.
많은 학자들이 단백질 변형에 따른 세포내 기능 연구와 질병의 연관성을 밝히기 위해 맞춤형 단백질 개발 연구를 진행했지만 기존 기술로는 원하는 변형을 갖는 단백질을 제조하는 것이 불가능했다.
박희성 교수는 박테리아의 생합성 경로를 재설계하고 비천연 아미노산을 표적단백질에 위치 특이적으로 첨가하는 방법으로 2011년 단백질 변형 중 가장 광범위한 단백질 인산화 제어에 성공했다.
이후 후속연구를 통해 비천연 아미노산의 특이적인 화학 반응성을 이용해 단백질 표면에서 탄소-탄소 결합을 일으켜 당화, 메틸화 등 200여 종의 맞춤형 단백질을 제조할 수 있는 기술을 최초로 개발했다.
박 교수팀은 퇴행성 신경질환의 원인중 하나로 알려진 비정상적 단백질 아세틸화를 실험용 쥐를 이용한 동물 모델에서 직접 구현했다.
이를 통해 실험용 쥐의 특정 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있었다. 또 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질이 아세틸화 변형 제어가 가능한 것도 확인했다.
박희성 교수는 “이 연구는 단백질 표면에서 선택적으로 탄소 간 결합을 일으켜 맞춤형으로 변형을 유발시키는 획기적인 단백질 변형 방법으로 암, 치매 등 단백질의 비정상적인 변형으로 유발되는 다양한 질병들에 대한 원인 규명과 치료제 개발에 돌파구를 마련하는 연구 결과이다” 고 말했다.
2018.05.03 조회수 16024 -
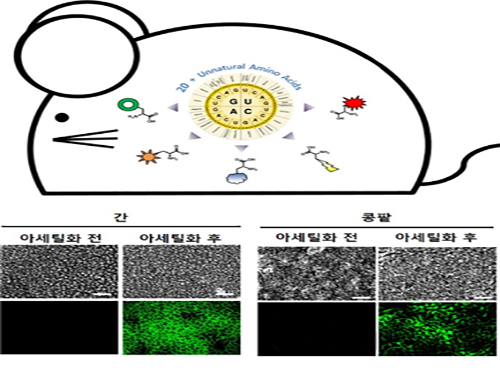 박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22211
박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22211 -
 올해의 KAIST인 상, 화학과 박희성 교수
〈 박 희 성 교수 〉
우리 대학은 2016년 올해의 KAIST인 상에 화학과 박희성(46) 교수를 선정하고 2일 오전 10시 교내 대강당에서 열리는 2017년도 시무식에서 시상했다.
16회째를 맞는 올해의 KAIST인 상은 한 해 동안 국내외에서 KAIST 발전을 위해 노력하고 교육, 연구 실적이 탁월한 인물에게 수여한다.
수상자인 박희성 교수는 암과 치매 등 각종 질병을 유발하는 것으로 알려진 단백질의 비정상적인 변형을 재현할 수 있는 맞춤형 단백질 변형 기술을 개발해 KAIST의 위상을 높인 공을 인정받았다.
박 교수는 지난 2011년 암을 일으키는 원인으로 알려진 비정상적인 단백질 인산화를 조절하는 기술을 개발해 저명 학술지인 ‘사이언스(Science)’지에 논문을 발표했다.
이후 박 교수는 선행 연구를 발전시켜 인산화 이외 200여 종의 다양한 단백질 변형을 구현할 수 있는 기술을 개발하는데 성공해 지난 9월 사이언스(Science)지에 논문을 발표했다.
박 교수의 맞춤형 단백질 변형 기술은 암을 포함한 각종 질병의 직접적인 원인을 밝히는데 유용하게 쓰일 것으로 기대된다. 또한 향후 표적항암제 개발 등 글로벌 신약개발 연구에 새로운 방향을 제시할 것으로 예상된다.
박 교수는 “KAIST를 대표하는 상을 수상하게 돼 커다란 영광이며 동시에 무거운 책임감을 느낀다” 며 “KAIST가 명실상부한 세계 최고의 교육 연구기관이 되는데 보탬이 되도록 최선을 다해 노력하겠다”고 말했다.
2017.01.02 조회수 14223
올해의 KAIST인 상, 화학과 박희성 교수
〈 박 희 성 교수 〉
우리 대학은 2016년 올해의 KAIST인 상에 화학과 박희성(46) 교수를 선정하고 2일 오전 10시 교내 대강당에서 열리는 2017년도 시무식에서 시상했다.
16회째를 맞는 올해의 KAIST인 상은 한 해 동안 국내외에서 KAIST 발전을 위해 노력하고 교육, 연구 실적이 탁월한 인물에게 수여한다.
수상자인 박희성 교수는 암과 치매 등 각종 질병을 유발하는 것으로 알려진 단백질의 비정상적인 변형을 재현할 수 있는 맞춤형 단백질 변형 기술을 개발해 KAIST의 위상을 높인 공을 인정받았다.
박 교수는 지난 2011년 암을 일으키는 원인으로 알려진 비정상적인 단백질 인산화를 조절하는 기술을 개발해 저명 학술지인 ‘사이언스(Science)’지에 논문을 발표했다.
이후 박 교수는 선행 연구를 발전시켜 인산화 이외 200여 종의 다양한 단백질 변형을 구현할 수 있는 기술을 개발하는데 성공해 지난 9월 사이언스(Science)지에 논문을 발표했다.
박 교수의 맞춤형 단백질 변형 기술은 암을 포함한 각종 질병의 직접적인 원인을 밝히는데 유용하게 쓰일 것으로 기대된다. 또한 향후 표적항암제 개발 등 글로벌 신약개발 연구에 새로운 방향을 제시할 것으로 예상된다.
박 교수는 “KAIST를 대표하는 상을 수상하게 돼 커다란 영광이며 동시에 무거운 책임감을 느낀다” 며 “KAIST가 명실상부한 세계 최고의 교육 연구기관이 되는데 보탬이 되도록 최선을 다해 노력하겠다”고 말했다.
2017.01.02 조회수 14223 -
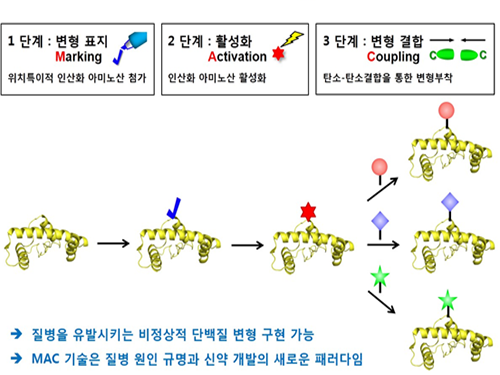 박희성, 이희윤 교수, 암, 치매 유발하는 '변형 단백질' 생산기술 개발
우리 대학 화학과 박희성 교수, 이희윤 교수 공동 연구팀이 암과 치매 등 각종 질병을 유발 원인으로 알려진 단백질의 비정상적인변형을 구현할 수 있는 맞춤형 단백질 변형기술을 개발했다.
양애린 박사가 1저자로 참여한 이번 연구 결과는 ‘사이언스(Science)’ 9월 29일자 온라인 판에 게재됐고 '가장 중요한 논문(First Release)'에 선정됐다.(논문명 : A chemical biology route to site-specific authentic protein modifications)
신체의 기본 단위인 세포는 2만여 종의 유전자를 가지고 있다. 여기서 만들어지는 단백질의 종류는 100만 종 이상으로 추정된다. 이는 단백질이 만들어진 후 다양한 단백질 변형(post-translational modification) 현상이 일어나기 때문이다.
이러한 단백질 변형의 원인으로는 인산화, 당화, 아세틸화, 메틸화 등 200여 종이 알려져 있으며, 정상적으로 변형된 단백질들은 생체 내에서 세포 신호 전달, 성장 등 정상적인 신진대사 활동에 중요한 역할을 한다.
그러나 유전적, 환경적 요인으로 인해 비정상적 단백질 변형이 일어나면 세포의 대사활동과 신호전달이 손상돼 세포의 무한 분열을 초래하기도 한다. 각종 암은 물론 치매를 일으키는 퇴행성신경질환 및 당뇨를 포함한 각종 만성질환을 유발한다.
이전에는 이러한 비정상적인 단백질 변형을 구현한 맞춤형 변형 단백질 개발기술이 존재하지 않아 각종 질병의 원인 규명과 맞춤형 신약 개발 연구에 많은 어려움이 있었다.
연구팀은 2011년 암을 일으키는 직접적인 원인으로 알려진 비정상적인 단백질 번역 후 인산화를 구현하기 위한 맞춤형 인산화 변형 단백질 생산기술을 개발해 사이언스지에 논문을 발표했었다.
이번 연구는 지난 2011년의 선행연구 결과를 더욱 발전시켜 인산화 이외에 당화, 아세틸화 등과 같은 다른 200여종의 단백질 변형을 직접 구현해 원하는 변형 단백질을 합성할 수 있는 기술이다.
박 교수는 “이 기술을 활용하면 원하는 위치에서 원하는 종류의 맞춤형 변형 단백질 생산이 가능해져 암과 치매 등 단백질 변형으로 인해 발생하는 질병의 직접적인 원인을 밝힐 수 있다”며 “신약 및 치료제 개발 속도를 높이고 발생할 수 있는 부작용을 최소화할 수 있는 획기적인 기술이다”고 말했다.
이번 연구는 글로벌프론티어 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 맞춤형 단백질 변형 기술 개발
그림2. 맞춤형 단백질 변형 기술의 활용
2016.10.03 조회수 12307
박희성, 이희윤 교수, 암, 치매 유발하는 '변형 단백질' 생산기술 개발
우리 대학 화학과 박희성 교수, 이희윤 교수 공동 연구팀이 암과 치매 등 각종 질병을 유발 원인으로 알려진 단백질의 비정상적인변형을 구현할 수 있는 맞춤형 단백질 변형기술을 개발했다.
양애린 박사가 1저자로 참여한 이번 연구 결과는 ‘사이언스(Science)’ 9월 29일자 온라인 판에 게재됐고 '가장 중요한 논문(First Release)'에 선정됐다.(논문명 : A chemical biology route to site-specific authentic protein modifications)
신체의 기본 단위인 세포는 2만여 종의 유전자를 가지고 있다. 여기서 만들어지는 단백질의 종류는 100만 종 이상으로 추정된다. 이는 단백질이 만들어진 후 다양한 단백질 변형(post-translational modification) 현상이 일어나기 때문이다.
이러한 단백질 변형의 원인으로는 인산화, 당화, 아세틸화, 메틸화 등 200여 종이 알려져 있으며, 정상적으로 변형된 단백질들은 생체 내에서 세포 신호 전달, 성장 등 정상적인 신진대사 활동에 중요한 역할을 한다.
그러나 유전적, 환경적 요인으로 인해 비정상적 단백질 변형이 일어나면 세포의 대사활동과 신호전달이 손상돼 세포의 무한 분열을 초래하기도 한다. 각종 암은 물론 치매를 일으키는 퇴행성신경질환 및 당뇨를 포함한 각종 만성질환을 유발한다.
이전에는 이러한 비정상적인 단백질 변형을 구현한 맞춤형 변형 단백질 개발기술이 존재하지 않아 각종 질병의 원인 규명과 맞춤형 신약 개발 연구에 많은 어려움이 있었다.
연구팀은 2011년 암을 일으키는 직접적인 원인으로 알려진 비정상적인 단백질 번역 후 인산화를 구현하기 위한 맞춤형 인산화 변형 단백질 생산기술을 개발해 사이언스지에 논문을 발표했었다.
이번 연구는 지난 2011년의 선행연구 결과를 더욱 발전시켜 인산화 이외에 당화, 아세틸화 등과 같은 다른 200여종의 단백질 변형을 직접 구현해 원하는 변형 단백질을 합성할 수 있는 기술이다.
박 교수는 “이 기술을 활용하면 원하는 위치에서 원하는 종류의 맞춤형 변형 단백질 생산이 가능해져 암과 치매 등 단백질 변형으로 인해 발생하는 질병의 직접적인 원인을 밝힐 수 있다”며 “신약 및 치료제 개발 속도를 높이고 발생할 수 있는 부작용을 최소화할 수 있는 획기적인 기술이다”고 말했다.
이번 연구는 글로벌프론티어 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 맞춤형 단백질 변형 기술 개발
그림2. 맞춤형 단백질 변형 기술의 활용
2016.10.03 조회수 12307