%ED%98%95%EA%B4%91%EB%8B%A8%EB%B0%B1%EC%A7%88
-
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6620
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6620 -
 알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 6857
알츠하이머 조기 진단하는 센서단백질 디자인하다
고정된 3차원 구조가 없는 상태로 존재하는 비정형 단백질((Intrinsically disordered protein)은 알츠하이머, 파킨슨병과 같은 신경계 질환부터 암, 심혈관계 질환, 대사질환을 유발하는 것으로 알려져 있다. 따라서, 이들을 신속하게 검출하고 분석할 수 있다면 조기 진단을 통해 질병의 진행을 막고 환자의 예후를 개선할 수 있을 뿐 아니라, 병리기전을 밝히고 나아가 치료제를 개발하는 데 큰 도움이 될 수 있다.
우리 대학 생명과학과 김학성 교수 연구팀이 이러한 비정형 단백질을 간단하게 검출할 수 있는 센서 단백질을 디자인하는 데에 성공했다고 8일 밝혔다.
단백질은 특정한 3차원 구조를 가지며 생체 내 다양한 기능을 수행하는 데 실제 인간 단백질 중 44%는 상황에 따라 구조가 변화는 비정형 단백질로 고정된 구조를 갖는 일반 단백질보다 더욱 다양한 기능을 수행한다. 그러나, 비정형 단백질은 고정된 구조가 없어서 이들 단백질의 분석과 기능 연구가 매우 어려웠다.
연구팀은 비정형 단백질이 단백질 2차 구조인 베타 스트랜드(β-strand)를 형성하는 특정 아미노산 서열을 갖고 있다는 점에 착안하여 이러한 특정 서열과 상보적으로 결합할 경우에만 신호를 방출하는 새로운 형태의 센서 단백질 디자인 방법을 정립하였다.
연구팀은 자연계에 존재하는 녹색 형광 단백질(Green Fluorescent Protein, GFP)의 베타 스트랜드 하나를 제거한 후, 비정형 단백질의 특정 서열이 결합하면 형광 단백질 발색단(chromophore)의 파장 스펙트럼이 변화하는 센서 단백질을 컴퓨터 및 방향적 진화 방법을 이용하여 성공적으로 개발하였다. (그림 1)
연구팀은 대표적 비정형 단백질의 하나로 알츠하이머를 유발하는 세포 내 베타-아밀로이드(β-amyloid)를 검출할 수 있는 센서 단백질을 개발하여 실시간으로 세포막과의 상호작용을 추적하고 영상화할 수 있었다. 기존에는 비정형 단백질을 분석하기 위해 복잡한 여러 단계의 전처리 과정이 필요하였고 이로 인해 비정형 단백질 자체가 크게 변형되어 실제 비정형 단백질의 분석과 기능 연구에 많은 제약이 있었다. 그러나, 이번에 개발된 센서 단백질은 단순히 비정형 단백질과 섞어줌으로써 매우 간편하고 빠르게 비정형 단백질을 검출할 수 있어서 향후 비정형 단백질 분석 및 관련 질병 연구에 크게 기여할 것으로 기대된다.
생명과학과 유태근 박사가 제1 저자로 참여하고 이진수 박사 (허원도 교수 연구실)와 윤정민 박사(송지준 교수 연구실)가 공동으로 진행한 이번 연구는 국제 학술지 '잭스 골드 (JACS Au)'에 지난 10월 26일 자 3권 11호에 출판됐으며, 표지 논문으로 선정됐다. (그림 2) (논문명 : Engineering of a Fluorescent Protein for a Sensing of an Intrinsically Disordered Protein through Transition in the Chromophore State)
제1 저자인 유태근 박사는 “고정된 구조가 없는 비정형 단백질은 일반적 단백질에 비해 센서 단백질의 디자인과 개발이 매우 어려운 표적이었다”라며 “이번 연구가 비정형 단백질의 분석과 관련 병리기전의 연구에 새로운 방법과 전략을 제시할 수 있을 것이다”라고 말했다.
한편 이번 연구는 한국연구재단 기초연구사업과 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.08 조회수 6857 -
 허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17698
허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17698 -
 허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11286
허원도 교수, 빛만 비춰도 유전자 발현 조절하는 효소 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 살아있는 생쥐의 머리에 빛만 비춰도 생쥐 뇌 유전자 발현을 제어할 수 있는 시스템을 개발했다.
매우 약한 빛에도 반응하도록 유전자 재조합 효소를 설계해 원하는 위치와 타이밍에 효소를 활성화할 수 있다. 많은 시간과 재원이 소요되는 유전자 변형 실험 모델을 만들지 않아도 특정 유전자 발현을 유도할 수 있어 활용이 매우 클 것으로 기대된다.
이번 연구결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 19일자 온라인 판에 게재됐다.
연구팀이 개발한 Flp 유전자 재조합 효소는 빛에 민감하게 반응해 활성화된다. 수술이 아닌 LED 빛을 쏘는 비침습성(non-invasive) 방식만으로도 유전자의 발현을 유도할 수 있어 물리적․화학적 손상에 의한 부작용도 최소화할 수 있다.
Flp 유전자 재조합 효소는 말 그대로 유전자를 자르고 재조합하는 기능을 지녀 유전자 형질 전환 실험모델을 만드는 등 다방면으로 활용됐다. 광유전학 기술에 응용하려는 시도가 있었으나 빛 없이도 스스로 조립(auto-assembly)돼버려 제어가 어려웠다. 뇌 속으로 빛을 직접 전달하려면 광섬유를 집어넣는 수술 과정도 필요했다.
연구팀이 개발한 광활성 Flp 유전자 재조합 효소(이하 PA-Flp 단백질)는 비활성화 상태에서도 빛을 받으면 결합되면서 활성화된다. 연구진은 단백질 공학을 통해 기존에는 잘 알려지지 않았던 Flp 재조합 효소를 활성화하는 위치를 찾는 힌트를 얻어 PA-Flp 단백질을 설계했다. PA-Flp 단백질의 발현 정도는 적색 형광단백질을 붙여 쉽게 알아볼 수 있도록 만들었다.
PA-Flp 단백질은 매우 적은 양으로도 반응하는 민감도를 지녔다. 연구진은 기억을 관장하는 쥐의 뇌 해마 부위에 PA-Flp 단백질을 넣은 뒤 약 30초 동안 LED를 머리 부분에 비추는 실험을 진행했다. 그 결과 생쥐 뇌의 깊은 조직 영역에 도달하는 매우 적은 양의 빛으로도 PA-Flp 단백질이 활성화된 것을 확인했다.
생쥐에게 쏜 빛은 1-2mW/mm2로 실생활에서 사용하는 휴대폰의 손전등 혹은 발표 시 이용하는 레이저 포인터 정도의 세기다. 연구진은 물리적 손상을 전혀 일으키지 않는 비침습성 방식으로도 유전자 발현을 조절하는데 성공한 것이다.
또한 연구진은 행동을 재현하고 검증하는 실험에 나섰다. 해마보다 더 깊숙한 곳에 있는 내측 중격(~3.5mm) 뇌 내측 중격(medial septum): 기억의 중추 역할을 담당하는 해마와 연결된 부위에는 칼슘 채널이 존재하는데 이 칼슘 채널의 발현이 억제되면 물체를 탐색하는 능력이 증가한다는 기존의 연구에 착안하여 실험을 설계했다.
연구진은 내측 중격에 PA-Flp 단백질을 도입하고 LED 빛을 쏘자 칼슘 채널의 발현이 억제됨을 확인했다. 실제 PA-Flp 단백질이 활성화된 실험군은 물체를 탐색하는 능력이 대조군에 비해 훨씬 커져 물체 주변으로 더 많은 움직임을 기록했다.
이번 연구는 빛으로 원하는 타이밍에 유전자를 자르고 재조합하는 효소를 개발해 향후 광유전학에 응용가치가 클 것으로 기대된다. 특정 유전자가 변형된 실험모델을 제작하는데 오랜 시일과 연구비가 투입되는데 반해 이 기술을 활용하면 빛만 쏘는 방식으로도 원하는 유전자를 쉽고 빠르게 조절할 수 있기 때문이다. 또한 광섬유를 심는 별도의 수술 없이도 연구자가 사용하기 간편하고 비용도 저렴하다.
허원도 교수는 “실험쥐의 생리학적 현상에 영향을 줄 수 있는 물리적, 화학적 자극이 거의 없이 LED로 원하는 특정 유전자 발현을 조절할 수 있는 것이 큰 장점이다”라며 “향후 다양한 뇌 영역을 탐구하는데 널리 활용될 것으로 기대한다”고 밝혔다.
□ 그림 설명
그림1. PA-Flp 단백질 작동원리 및 발현
그림2. 물체 탐색 능력이 증가함을 실험으로 확인
2019.01.21 조회수 11286 -
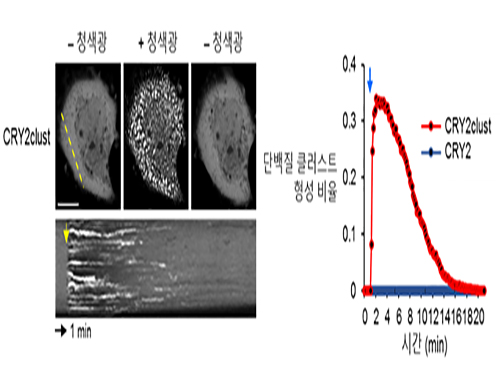 허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
2017.06.26 조회수 16736
허원도 교수, 빛으로 단백질군집형성 속도 10배 높이는 새 광유전학 기술 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 청색광 수용 단백질인 크립토크롬2(Cryptochrome2)를 변형한 크립토크롬2 클러스트(CRY2clust)를 개발했다.
이를 통해 기존에 비해 약 10배 더 빠른 반응속도로 단백질 군집을 형성하는 데 성공했다.
이번 연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 23일자에 게재됐다.
세포막 단백질이나 신호전달 단백질, 효소 등 많은 단백질은 자신들끼리 서로 군집을 이룰 때 제 기능이 활성화된다. 그 동안 화학물질을 이용해 단백질 군집 형성을 유도하려는 노력이 이뤄져왔으나 부작용과 시간적 제약 등 한계가 있었다.
광유전학 분야 연구자들은 화학물질을 사용하지 않는 대신 빛을 이용해 단백질 군집을 형성하고자 식물의 청색광 수용 단백질인 크립토크롬2를 활용했다.
허원도 교수 연구팀은 크립토크롬2의 일부 구조를 변형해 기존 크립토크롬2를 활용한 광유전학 기술보다 단백질 군집을 더 빠르게 만들 수 있는 방법을 찾았다.
크립토크롬2의 단백질 사슬 C말단(C-terminal)에 9개의 아미노산 잔기로 구성된 매우 짧은 펩티드(Peptide)를 부착하자 일반 크립토크롬2보다 빛에 10배 이상 더 빠르게 반응한다는 사실을 관찰한 것이다.
연구진은 이 기술을 CRY2clust라 이름 붙였다.
연구팀은 과거 자체 개발한 광유전학 기술에 CRY2clust를 접목해 CRY2을 이용한 기존 시스템과의 단백질 활성 효율의 차이를 확인했다. CRY2clust를 사용하면 빛으로 세포막의 칼슘이온채널을 훨씬 빠르게 끄고 켜거나(광유도 칼슘이온채널 활성 시스템 ; OptoSTIM1) 신경세포의 분화를 더욱 효율적으로 조절(광유도 신경성장인자 수용체 활성 시스템 ; OptoTrkB)할 수 있었다.
연구진은 더 나아가 실험실에서 단백질 군집 형성에 주로 활용하는 여러 형광단백질(Fluorescent protein)과 크립토크롬2를 짝지어 결합해봄으로써 빛을 이용해 단백질 군집을 더 효율적으로 만들 수 있는 조합의 조건을 찾았다.
형광단백질이 하나보다는 여러 개가 결합한 형태일수록 빛을 비추었을 때 광유도 클러스트를 더욱 높은 비율로 형성했다. 또한 형광단백질을 크립토크롬2의 단백질 사슬 말단 중 N말단이 아닌 C말단에 붙이는 경우 광유도 클러스트 형성 효율이 더 높은 것으로 확인됐다. 단백질 군집이 잘 형성되는 조건을 찾았다는 점에서 연구자의 실험 선택의 폭을 넓혀준 데 의의가 있다.
허원도 교수 연구팀은 CRY2clust를 개발해 빛을 이용한 단백질의 활성을 훨씬 효율적으로 유도하는데 성공했다.
허원도 교수는 “이번 연구에서 개발한 CRY2clust는 향후 광유전학 분야의 실험에 유용한 도구가 될 것이다”며“다양한 형광단백질-CRY2 조합을 통해 찾은 단백질 군집 형성 성공 요인은 광유전학 시스템 개발에 길잡이 역할을 할 것이다”고 말했다.
□ 그림 설명
그림1. 기존 크립토크롬2 대비 CRY2clust의 단백질 군집 형성 속도
그림2. CRY2clust 시스템을 적용한 광유도 단백질 기능 조절
그림3. 형광단백질을 이용한 다양한 단백질 군집 형성
2017.06.26 조회수 16736 -
 인체 세포에서 형광단백질을 이용해 레이저 만들어 내
우리 학교 나노과학기술대학원 윤석현 교수는 세계수준의 연구중심대학 육성사업(WCU)에 참여하는 해외학자로서 미국 하버드의대 맬트 개더(Gather) 박사와 함께 광학 분야 국제학술지인 ‘네이처 포토닉스(Nature Photonics)" 인터넷판 12일 자에 인체 세포에서 형광(螢光)단백질을 이용해 레이저를 만드는 데 성공했다.
네이처 포토닉스는 보도자료와 함께 별도 인터뷰 기사까지 게재했다.
레이저는 빛을 증폭시켜 직선으로 나가게 한 것이다. 50여 년 전 처음 개발되어 레이저 포인터나 바코드 리더처럼 일상생활에도 깊숙이 들어와 있다. 레이저는 대부분 반도체, 기체 등 무기물질을 가공하여 만들어졌다. 그러나 윤 석현 교수는 살아있는 사람 세포에서 레이저를 만드는 데 처음으로 성공하였다.
해파리에는 자외선을 비추면 초록빛을 내는 형광단백질이 있다. 연구진은 사람 세포에 형광단백질 유전자를 넣었다. 이 세포 하나를 용기에 넣고 좌우에 미세 거울을 설치했다. 세포에 빛을 쪼이자 형광단백질에서 푸른 형광이 나왔다. 이 빛은 거울 사이를 왕복하면서 증폭되다가 아주 짧은 순간 레이저가 됐다.
이번 연구는 세포를 관찰하는 현미경에 이용될 수 있다. 레이저는 한 방향으로만 나온다. 형광단백질이 있는 세포에 약한 빛을 쬐고 레이저가 어느 방향으로 나오는지 알면 세포가 어떤 방향으로 있는지 알 수 있다. 또한 형광으로는 세포를 3~4가지 색으로 표현할 수 있지만, 레이저는 1000가지 정도의 색을 나타낼 수 있다.
환자 치료에도 도움을 줄 수 있다. 레이저가 나오는 곳에서만 약효를 발휘하는 약물을 만들면 병든 세포만 골라 치료할 수 있다. 장기에 이식한 초소형 전자기기에서 정보를 보내는 데에도 세포 레이저가 이용될 수 있다고 연구진은 밝혔다.
윤 교수는 KAIST에서 물리학박사 학위를 받고 2005년 하버드 의대에 부임했으며, 현재 KAIST 나노과학기술대학원에 초빙교수로서 한국연구재단 WCU사업의 지원을 받아 이번 연구를 수행했다.
2011.06.14 조회수 20926
인체 세포에서 형광단백질을 이용해 레이저 만들어 내
우리 학교 나노과학기술대학원 윤석현 교수는 세계수준의 연구중심대학 육성사업(WCU)에 참여하는 해외학자로서 미국 하버드의대 맬트 개더(Gather) 박사와 함께 광학 분야 국제학술지인 ‘네이처 포토닉스(Nature Photonics)" 인터넷판 12일 자에 인체 세포에서 형광(螢光)단백질을 이용해 레이저를 만드는 데 성공했다.
네이처 포토닉스는 보도자료와 함께 별도 인터뷰 기사까지 게재했다.
레이저는 빛을 증폭시켜 직선으로 나가게 한 것이다. 50여 년 전 처음 개발되어 레이저 포인터나 바코드 리더처럼 일상생활에도 깊숙이 들어와 있다. 레이저는 대부분 반도체, 기체 등 무기물질을 가공하여 만들어졌다. 그러나 윤 석현 교수는 살아있는 사람 세포에서 레이저를 만드는 데 처음으로 성공하였다.
해파리에는 자외선을 비추면 초록빛을 내는 형광단백질이 있다. 연구진은 사람 세포에 형광단백질 유전자를 넣었다. 이 세포 하나를 용기에 넣고 좌우에 미세 거울을 설치했다. 세포에 빛을 쪼이자 형광단백질에서 푸른 형광이 나왔다. 이 빛은 거울 사이를 왕복하면서 증폭되다가 아주 짧은 순간 레이저가 됐다.
이번 연구는 세포를 관찰하는 현미경에 이용될 수 있다. 레이저는 한 방향으로만 나온다. 형광단백질이 있는 세포에 약한 빛을 쬐고 레이저가 어느 방향으로 나오는지 알면 세포가 어떤 방향으로 있는지 알 수 있다. 또한 형광으로는 세포를 3~4가지 색으로 표현할 수 있지만, 레이저는 1000가지 정도의 색을 나타낼 수 있다.
환자 치료에도 도움을 줄 수 있다. 레이저가 나오는 곳에서만 약효를 발휘하는 약물을 만들면 병든 세포만 골라 치료할 수 있다. 장기에 이식한 초소형 전자기기에서 정보를 보내는 데에도 세포 레이저가 이용될 수 있다고 연구진은 밝혔다.
윤 교수는 KAIST에서 물리학박사 학위를 받고 2005년 하버드 의대에 부임했으며, 현재 KAIST 나노과학기술대학원에 초빙교수로서 한국연구재단 WCU사업의 지원을 받아 이번 연구를 수행했다.
2011.06.14 조회수 20926