%EC%9D%B4%EB%AF%B8%EC%A7%95
-
 예종철 교수 연구팀, 삼성휴먼테크 논문대상 신호처리분야 금상 수상
우리 대학 김재철AI대학원 예종철 교수팀이 `확산모델 (diffusion model)의 사후 샘플링(posterior sampling)을 이용한 일반적인 역문제 해결 기법'으로 제 29회 삼성휴먼테크논문대상에서 신호처리 분야 금상을 수상했다고 밝혔다.
삼성휴먼테크논문대상은 과학기술 저변 확대와 과학 인재 양성을 위해 삼성전자가 1994년 제정한 논문상으로, 매년 2,000편 가량의 논문 중 서면 및 발표 심사를 거쳐 창의성, 논리성, 실용성, 발전성이 뛰어난 논문을 선정하여 수여되는 상이다.
바이오및뇌공학과 박사과정 졍형진, 김정솔 학생이 공동 1저자로 참여한 이 논문은, 확산 모델과 사후 샘플링을 결합하여 일반적인 역문제에 대한 새로운 관점과 해결방법을 제시하였고, 그 실용성과 독창성을 인정받아 대학부 신호처리 분야 수상작 7편 중 1위로 금상을 수상하였다.
역문제는 영상을 획득하는 과정에서 이미징 시스템의 특성과 잡음의 영향으로 망가진 측정값으로부터 실제 신호를 복원하는 문제로 정의된다. 이러한 문제는 영상 화질 개선부터 위상 복원을 통한 세포 구조 시각화와 같은 다양한 과학 분야에서 중요성과 실용성을 가지며, 수십 년간 지속적으로 연구되어 왔다. 과거의 인공지능 및 딥러닝 알고리즘은 이미징 시스템이 선형이며 잡음이 없는 경우를 가정하여 역문제를 효과적으로 해결하였으나, 이러한 가정은 현실 세계에서의 상황과 비교하여 훨씬 단순화된 형태였다.
이 연구에서는 처음으로 확산 모델을 이용해 사후 샘플링을 진행하는 방법으로 역문제를 해결하였는데, 이는 확산 모델이 생성하는 중간 이미지로 측정값을 근사하고, 실제 측정값과의 차이가 줄어들도록 중간 이미지를 보정하는 방식으로 구현된다.
이를 통해 이미징 시스템이 선형 및 비선형인 경우, 그리고 이미징 시스템에서 흔히 발생하는 가우시안 잡음과 푸아송 잡음이 존재하는 경우에 대한 일반적인 역문제 해결이 가능함을 입증하였다. 나아가 개발된 기술은 여러 종류의 역문제에 대한 개별적 학습을 필요로 하지 않는 특성을 가지며, 이는 논문의 실용성을 높이고, 이전의 연구들과 차별성을 지니게 한다.
정형진, 김정솔 바이오및뇌공학과 박사과정 학생은 “큰 규모의 논문대회에서 연구의 내용을 인정받아 기쁘고, 좋은 논문을 작성할 수 있도록 지도해주신 예종철 교수님께 감사하다” 고 소감을 밝혔다. 또한, 알고리즘의 성능과 효율성을 높이는 연구를 이어나가 역문제의 해결이 필요한 다양한 과학 분야들에 기여하고 싶다는 희망을 전했다.
논문명: Diffusion Posterior Sampling for General Noisy Inverse Problems
2023.11.07 조회수 2332
예종철 교수 연구팀, 삼성휴먼테크 논문대상 신호처리분야 금상 수상
우리 대학 김재철AI대학원 예종철 교수팀이 `확산모델 (diffusion model)의 사후 샘플링(posterior sampling)을 이용한 일반적인 역문제 해결 기법'으로 제 29회 삼성휴먼테크논문대상에서 신호처리 분야 금상을 수상했다고 밝혔다.
삼성휴먼테크논문대상은 과학기술 저변 확대와 과학 인재 양성을 위해 삼성전자가 1994년 제정한 논문상으로, 매년 2,000편 가량의 논문 중 서면 및 발표 심사를 거쳐 창의성, 논리성, 실용성, 발전성이 뛰어난 논문을 선정하여 수여되는 상이다.
바이오및뇌공학과 박사과정 졍형진, 김정솔 학생이 공동 1저자로 참여한 이 논문은, 확산 모델과 사후 샘플링을 결합하여 일반적인 역문제에 대한 새로운 관점과 해결방법을 제시하였고, 그 실용성과 독창성을 인정받아 대학부 신호처리 분야 수상작 7편 중 1위로 금상을 수상하였다.
역문제는 영상을 획득하는 과정에서 이미징 시스템의 특성과 잡음의 영향으로 망가진 측정값으로부터 실제 신호를 복원하는 문제로 정의된다. 이러한 문제는 영상 화질 개선부터 위상 복원을 통한 세포 구조 시각화와 같은 다양한 과학 분야에서 중요성과 실용성을 가지며, 수십 년간 지속적으로 연구되어 왔다. 과거의 인공지능 및 딥러닝 알고리즘은 이미징 시스템이 선형이며 잡음이 없는 경우를 가정하여 역문제를 효과적으로 해결하였으나, 이러한 가정은 현실 세계에서의 상황과 비교하여 훨씬 단순화된 형태였다.
이 연구에서는 처음으로 확산 모델을 이용해 사후 샘플링을 진행하는 방법으로 역문제를 해결하였는데, 이는 확산 모델이 생성하는 중간 이미지로 측정값을 근사하고, 실제 측정값과의 차이가 줄어들도록 중간 이미지를 보정하는 방식으로 구현된다.
이를 통해 이미징 시스템이 선형 및 비선형인 경우, 그리고 이미징 시스템에서 흔히 발생하는 가우시안 잡음과 푸아송 잡음이 존재하는 경우에 대한 일반적인 역문제 해결이 가능함을 입증하였다. 나아가 개발된 기술은 여러 종류의 역문제에 대한 개별적 학습을 필요로 하지 않는 특성을 가지며, 이는 논문의 실용성을 높이고, 이전의 연구들과 차별성을 지니게 한다.
정형진, 김정솔 바이오및뇌공학과 박사과정 학생은 “큰 규모의 논문대회에서 연구의 내용을 인정받아 기쁘고, 좋은 논문을 작성할 수 있도록 지도해주신 예종철 교수님께 감사하다” 고 소감을 밝혔다. 또한, 알고리즘의 성능과 효율성을 높이는 연구를 이어나가 역문제의 해결이 필요한 다양한 과학 분야들에 기여하고 싶다는 희망을 전했다.
논문명: Diffusion Posterior Sampling for General Noisy Inverse Problems
2023.11.07 조회수 2332 -
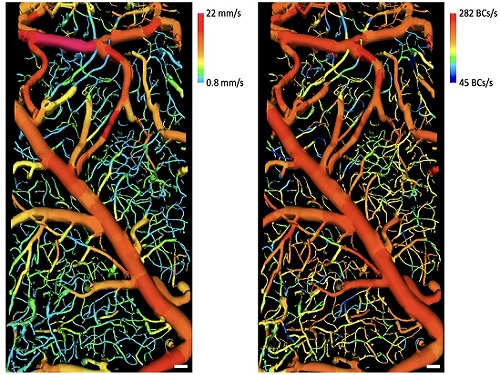 조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 1846
조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 1846 -
 비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 2609
비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 2609 -
 3차원 구강 스캐닝을 휴대용 카메라로?
치과 치료를 위해 치아 및 구상조직 형태의 석고 등으로 모형을 만드는 인상채득(Impression)을 디지털 방식으로 간편하게 수행할 수 있는 3D 구강 스캐너가 최근 주목받고 있다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 3차원 구강 스캐닝에 적합한 휴대형 라이트필드 카메라를 개발하는 데 성공했다고 6일 밝혔다.
기존 구강 스캐너는 큰 크기와 낮은 정확도로 인해 여전히 사용 빈도가 낮아, 적용 범위를 넓히고 실용적인 사용을 위해서는 소형화와 손움직임에 의한 동작 잡음 개선 등이 필요한 상황이다.
이미지 센서의 픽셀에 도달하는 빛의 세기만을 기록하는 일반적인 카메라와 달리 라이트필드 카메라 (light-field camera)는 *마이크로렌즈 어레이를 이미지센서 앞에 배치하여 들어오는 빛의 방향을 구분한다. 따라서, 한 번의 촬영으로 3차원 광학이미지를 획득할 수 있을 뿐만 아니라 간단한 구조를 가지기 때문에 초소형 제작이 가능하다.
☞ 마이크로렌즈 어레이(microlens arrays): 수십에서 수백 마이크로미터 정도 직경의 미세렌즈를 배열하여 만든 광학 소자
연구팀은 3차원 구강 스캐닝을 위해 주 렌즈, 고체 잠입 마이크로렌즈 어레이, 이미지센서 등을 이용한 동작잡음이 없는 초소형 고심도 라이트필드 카메라 (deep focus light-field camera)를 설계·제작했다. 핵심아이디어는 저굴절률의 고분자 코팅을 통해 마이크로렌즈의 초점거리를 향상한 고체 잠입 마이크로렌즈다. 제작된 라이트필드 카메라는 피사계 심도가 높아, 손떨림에도 둔감하고, 한 번 촬영으로 더 많은 3차원 영상정보를 쉽게 획득할 수 있다.
연구팀은 설계한 라이트필드 카메라 기반의 구강 스캐너를 이용한 휴대 촬영을 통해 손동작 잡음 없이 구강 모형의 3차원 재구성 영상 획득에 성공했다. 특히, 큰 피사계 심도를 가져 쉬운 휴대 작동이 가능하고 고대비 이미지를 획득해 높은 3차원 재구성 정확도를 보인다. 이를 통해 기존 구강 스캐너에서 주로 쓰이는 복잡한 광학계가 아닌 소형화에 적합한 간단한 구조의 라이트필드 카메라를 이용해 높은 정확도의 3차원 구강 스캐닝이 가능함을 연구팀은 확인했다.
정기훈 교수는 “연구팀이 개발한 라이트필드 카메라는 구강 스캐닝 뿐만 아니라 생체 내 3차원 이미징을 위한 새로운 플랫폼으로 활용될 수 있을 것으로 기대된다”며 “내시경, 현미경 등의 다양한 바이오·의료분야는 물론 3차원 산업용 검사장비에 활용하게 될 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 권재명 박사과정 학생이 주도한 이번 연구 결과는 국제 학술지 `에이피엘 바이오엔지니어링(APL Bioengineering)'에 최근 게재됐다. (논문명: Deep focus light-field camera for handheld 3D intraoral scanning using crosstalk-free solid immersion microlens arrays).
한편 이번 연구는 과학기술정보통신부 및 ㈜바텍의 지원을 받아 수행되었고, ㈜마이크로픽스 (연구실 창업)을 통해 기술사업화를 진행 중이다.
2023.09.06 조회수 2686
3차원 구강 스캐닝을 휴대용 카메라로?
치과 치료를 위해 치아 및 구상조직 형태의 석고 등으로 모형을 만드는 인상채득(Impression)을 디지털 방식으로 간편하게 수행할 수 있는 3D 구강 스캐너가 최근 주목받고 있다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 3차원 구강 스캐닝에 적합한 휴대형 라이트필드 카메라를 개발하는 데 성공했다고 6일 밝혔다.
기존 구강 스캐너는 큰 크기와 낮은 정확도로 인해 여전히 사용 빈도가 낮아, 적용 범위를 넓히고 실용적인 사용을 위해서는 소형화와 손움직임에 의한 동작 잡음 개선 등이 필요한 상황이다.
이미지 센서의 픽셀에 도달하는 빛의 세기만을 기록하는 일반적인 카메라와 달리 라이트필드 카메라 (light-field camera)는 *마이크로렌즈 어레이를 이미지센서 앞에 배치하여 들어오는 빛의 방향을 구분한다. 따라서, 한 번의 촬영으로 3차원 광학이미지를 획득할 수 있을 뿐만 아니라 간단한 구조를 가지기 때문에 초소형 제작이 가능하다.
☞ 마이크로렌즈 어레이(microlens arrays): 수십에서 수백 마이크로미터 정도 직경의 미세렌즈를 배열하여 만든 광학 소자
연구팀은 3차원 구강 스캐닝을 위해 주 렌즈, 고체 잠입 마이크로렌즈 어레이, 이미지센서 등을 이용한 동작잡음이 없는 초소형 고심도 라이트필드 카메라 (deep focus light-field camera)를 설계·제작했다. 핵심아이디어는 저굴절률의 고분자 코팅을 통해 마이크로렌즈의 초점거리를 향상한 고체 잠입 마이크로렌즈다. 제작된 라이트필드 카메라는 피사계 심도가 높아, 손떨림에도 둔감하고, 한 번 촬영으로 더 많은 3차원 영상정보를 쉽게 획득할 수 있다.
연구팀은 설계한 라이트필드 카메라 기반의 구강 스캐너를 이용한 휴대 촬영을 통해 손동작 잡음 없이 구강 모형의 3차원 재구성 영상 획득에 성공했다. 특히, 큰 피사계 심도를 가져 쉬운 휴대 작동이 가능하고 고대비 이미지를 획득해 높은 3차원 재구성 정확도를 보인다. 이를 통해 기존 구강 스캐너에서 주로 쓰이는 복잡한 광학계가 아닌 소형화에 적합한 간단한 구조의 라이트필드 카메라를 이용해 높은 정확도의 3차원 구강 스캐닝이 가능함을 연구팀은 확인했다.
정기훈 교수는 “연구팀이 개발한 라이트필드 카메라는 구강 스캐닝 뿐만 아니라 생체 내 3차원 이미징을 위한 새로운 플랫폼으로 활용될 수 있을 것으로 기대된다”며 “내시경, 현미경 등의 다양한 바이오·의료분야는 물론 3차원 산업용 검사장비에 활용하게 될 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 권재명 박사과정 학생이 주도한 이번 연구 결과는 국제 학술지 `에이피엘 바이오엔지니어링(APL Bioengineering)'에 최근 게재됐다. (논문명: Deep focus light-field camera for handheld 3D intraoral scanning using crosstalk-free solid immersion microlens arrays).
한편 이번 연구는 과학기술정보통신부 및 ㈜바텍의 지원을 받아 수행되었고, ㈜마이크로픽스 (연구실 창업)을 통해 기술사업화를 진행 중이다.
2023.09.06 조회수 2686 -
 마스크 하나로 선명한 3D 홀로그래픽 센서 구현
일반카메라에 비해 홀로그래픽 카메라는 물체의 3D 정보를 획득하는 능력 덕분에 현실감 있는 영상을 제공한다. 하지만 기존 홀로그래픽 카메라 기술은 광파(光波)의 간섭 현상을 이용하여 빛의 파장·굴절률 등을 측정하는 장치인 간섭계를 사용하여 복잡하고 주변 환경에 민감한 단점이 있다.
우리 대학 물리학과 박용근 교수 연구팀이 3차원 홀로그래피 이미징 센서 기술의 새로운 도약을 이뤘다고 23일 발표했다.
연구팀은 복잡한 간섭계를 사용하지 않는 혁신적인 홀로그래피 카메라 기술을 발표했다. 이 기술은 마스크를 이용해 빛의 위상 정보를 정밀하게 측정하며, 이에 따라 물체의 3D 정보를 더욱 정확하게 재구성할 수 있다.
연구팀은 제시한 혁신적인 방법은 수학적으로 특정 조건을 만족하는 마스크를 일반 카메라에 추가하고, 이를 통해 측정한 레이저 산란광을 컴퓨터 상에서 분석하는 방식이다. 복잡한 간섭계가 필요하지 않고, 더욱 단순화된 광학 시스템을 통해 빛의 위상 정보를 효과적으로 획득한다. 이 기술에서는 물체 뒤 위치한 두 렌즈 사이의 특별한 마스크가 중요한 역할을 한다. 이 마스크는 빛의 특정 부분을 선별적으로 필터링하며, 렌즈를 통과하는 빛의 강도는 일반적인 상업용 카메라로 측정될 수 있다. 이 기술은 카메라로부터 받아온 이미지 데이터와 마스크의 독특한 패턴을 결합해, 알고리즘 처리를 통해 물체의 세밀한 3D 정보를 복원한다.
이러한 방식은 어떤 위치의 물체든 선명하게 3차원으로 촬영하는 능력을 갖추고 있다. 실제 구현을 위해서는, 일반적인 이미지 센서에 단순한 디자인의 마스크를 추가하는 것으로 레이저 홀로그래피 3D 이미지 센서 구현이 가능하다. 이에 따라 광학 시스템의 설계와 제작이 더욱 간편해진다. 특히 이 새로운 기술은 빠른 움직임의 물체에도 선명한 홀로그래픽 이미지 촬영이 가능해 활용 범위가 넓어질 것으로 예상된다.
물리학과 오정훈 박사가 제1 저자로 참여한 이 연구 결과는 국제적인 학술지 '네이처 커뮤니케이션즈 (Nature Communications)' 8월 12일 字에 출판됐다. (논문명: Non-interferometric stand-alone single-shot holographic camera using reciprocal diffractive imaging)
제1 저자인 물리학과 오정훈 박사는 “제안하는 홀로그래픽 카메라의 모듈은 일반 카메라에 필터를 추가하는 방식으로 구현될 수 있으므로, 실용화된다면 일상생활에서 비전문가가 손쉽게 사용할 수 있을 것이다”라며, “특히 기존의 원격 감지 기술들을 대체할 수 있다는 높은 잠재력을 가지고 있다”라고 말했다.
한편 이번 연구는 연구재단의 리더연구사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업의 지원을 받아 수행됐다.
2023.08.23 조회수 2839
마스크 하나로 선명한 3D 홀로그래픽 센서 구현
일반카메라에 비해 홀로그래픽 카메라는 물체의 3D 정보를 획득하는 능력 덕분에 현실감 있는 영상을 제공한다. 하지만 기존 홀로그래픽 카메라 기술은 광파(光波)의 간섭 현상을 이용하여 빛의 파장·굴절률 등을 측정하는 장치인 간섭계를 사용하여 복잡하고 주변 환경에 민감한 단점이 있다.
우리 대학 물리학과 박용근 교수 연구팀이 3차원 홀로그래피 이미징 센서 기술의 새로운 도약을 이뤘다고 23일 발표했다.
연구팀은 복잡한 간섭계를 사용하지 않는 혁신적인 홀로그래피 카메라 기술을 발표했다. 이 기술은 마스크를 이용해 빛의 위상 정보를 정밀하게 측정하며, 이에 따라 물체의 3D 정보를 더욱 정확하게 재구성할 수 있다.
연구팀은 제시한 혁신적인 방법은 수학적으로 특정 조건을 만족하는 마스크를 일반 카메라에 추가하고, 이를 통해 측정한 레이저 산란광을 컴퓨터 상에서 분석하는 방식이다. 복잡한 간섭계가 필요하지 않고, 더욱 단순화된 광학 시스템을 통해 빛의 위상 정보를 효과적으로 획득한다. 이 기술에서는 물체 뒤 위치한 두 렌즈 사이의 특별한 마스크가 중요한 역할을 한다. 이 마스크는 빛의 특정 부분을 선별적으로 필터링하며, 렌즈를 통과하는 빛의 강도는 일반적인 상업용 카메라로 측정될 수 있다. 이 기술은 카메라로부터 받아온 이미지 데이터와 마스크의 독특한 패턴을 결합해, 알고리즘 처리를 통해 물체의 세밀한 3D 정보를 복원한다.
이러한 방식은 어떤 위치의 물체든 선명하게 3차원으로 촬영하는 능력을 갖추고 있다. 실제 구현을 위해서는, 일반적인 이미지 센서에 단순한 디자인의 마스크를 추가하는 것으로 레이저 홀로그래피 3D 이미지 센서 구현이 가능하다. 이에 따라 광학 시스템의 설계와 제작이 더욱 간편해진다. 특히 이 새로운 기술은 빠른 움직임의 물체에도 선명한 홀로그래픽 이미지 촬영이 가능해 활용 범위가 넓어질 것으로 예상된다.
물리학과 오정훈 박사가 제1 저자로 참여한 이 연구 결과는 국제적인 학술지 '네이처 커뮤니케이션즈 (Nature Communications)' 8월 12일 字에 출판됐다. (논문명: Non-interferometric stand-alone single-shot holographic camera using reciprocal diffractive imaging)
제1 저자인 물리학과 오정훈 박사는 “제안하는 홀로그래픽 카메라의 모듈은 일반 카메라에 필터를 추가하는 방식으로 구현될 수 있으므로, 실용화된다면 일상생활에서 비전문가가 손쉽게 사용할 수 있을 것이다”라며, “특히 기존의 원격 감지 기술들을 대체할 수 있다는 높은 잠재력을 가지고 있다”라고 말했다.
한편 이번 연구는 연구재단의 리더연구사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업의 지원을 받아 수행됐다.
2023.08.23 조회수 2839 -
 2.3초만에 고해상도 망막 3차원 이미징 최초 구현
망막의 세포 수준 해상도 이미징 기술은 질병의 조기진단과 망막질환에 대한 이해를 높이기 위해 필수적이다. 하지만, 복잡한 고가의 광학 시스템을 사용하고도 망막의 매우 좁은 영역과 단일 초점면에서 세포 수준 고해상도 이미징이 가능했던 기술을 뛰어넘어 간단한 표준적 광학 시스템을 사용하면서도 2.3초 이내에 한 번의 이미징으로 넓은 망막 영역의 3차원 모든 부분에서 세포 수준 고해상도 이미징을 제공하여 망막질환 임상 및 연구에 새로운 전기를 가져올 기술이 개발되어 화제다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 사람 망막의 넓은 영역에서 초점 위치뿐만이 아니라 초점에서 벗어난 위치에서도 세포 수준 고해상도 이미징이 가능한 기술을 개발했다고 3일 밝혔다.
KI헬스사이언스연구소 이병권 박사가 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small, JIF 15.153) 3월호에 게재됐다. (논문명: Wide-Field Three-Dimensional Depth-Invariant Cellular-Resolution Imaging of the Human Retina.)
망막은 안구의 렌즈를 통해 이미징해야 하기 때문에 안구 렌즈의 수차(예, 난시)로 인해 고해상도 이미징이 어렵다. 기존에는 이를 극복하기 위해 안구 렌즈의 수차를 측정하는 광학 하드웨어와 이를 보정해 이미징 광을 주사하는 광학 하드웨어를 사용하는 적응광학(adaptive optics) 방법이 개발돼왔다. 하지만, 이러한 방법은 복잡하고 가격이 비싼 추가의 광학 하드웨어가 필요할 뿐만 아니라, 단일 초점면에서만 고해상도 영상을 얻을 수 있어, 3차원 고해상도 이미지를 얻기 위해서는 초점 위치를 바꿔가며 여러 깊이에서 반복적으로 이미징을 수행해야만 했다.
오왕열 교수 연구팀은 간단한 일반적인 광학계를 사용해 3차원 망막 영상을 한 번에 얻고, 이 영상 데이터에 존재하는 수차와 초점에서 벗어난 부분에서 영상이 흐려지는 디포커싱(defocusing)을 계산을 통해 제거하는 기술을 개발함으로써 이러한 한계를 극복했다. 또한 연구팀은 초고속 위상안정 3차원 OCT(Optical Coherence Tomography: 광간섭 단층촬영) 시스템을 함께 개발해 전산적 수차 및 디포커싱 제거 기술의 실제 응용 현장에서의 유용성을 확보했다.
오왕열 교수는 “전산적 수차 및 디포커싱 제거 기술이 적용되려면, 망막의 3차원 각 위치에서 산란돼 나온 빛의 세기는 물론 위상 값도 모두 정확히 알아야 한다”며 “넓은 3차원 영역을 고해상도로 이미징하려면 영상 데이터의 양(이미지를 구성하는 픽셀 수)이 매우 커지기 때문에, 초고속으로 3차원 영상 데이터를 획득할 수 있는 기술이 필수적이며, 이에 따라 초고속 위상안정 3차원 이미징 시스템이 반드시 필요하다”고 말했다.
새로 개발된 OCT 이미징 시스템은 기존 OCT 기술들의 위상 불안정 문제를 해결하면서도, 현재 가장 빠른 상용 망막 OCT 시스템보다 20배 이상 빠른 이미징 속도를 제공해, 3mm x 3mm 에 걸친 사람 망막의 3차원 영역을 세포 수준으로 촘촘하게 이미징한 위상안정 영상 데이터(약 100억 개의 3차원 화소(픽셀)로 구성)를 2.3초 만에 획득할 수 있게 했다.
오왕열 교수는 “현재 병원에서 사용되는 망막 OCT 시스템과 동일한 간단한 광학계를 사용하면서도, 피험자 망막의 다양한 깊이 위치에 존재하는 망막 신경섬유층, 광수용세포층 등 여러 층의 미세구조를 모두 세포수준의 해상도로 보여줄 수 있어, 실제 망막질환 임상 및 연구 현장에서 매우 유용하게 사용될 것” 이라고 강한 기대를 보였으며, “전산적 수차 및 디포커싱 제거 기술뿐만 아니라, 이 기술 적용에 필수적인 초고속 위상안정 OCT 기술 개발에 주도적인 역할을 한 이병권 박사의 기여가 절대적이었다”라며 공을 돌렸다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.05.03 조회수 3293
2.3초만에 고해상도 망막 3차원 이미징 최초 구현
망막의 세포 수준 해상도 이미징 기술은 질병의 조기진단과 망막질환에 대한 이해를 높이기 위해 필수적이다. 하지만, 복잡한 고가의 광학 시스템을 사용하고도 망막의 매우 좁은 영역과 단일 초점면에서 세포 수준 고해상도 이미징이 가능했던 기술을 뛰어넘어 간단한 표준적 광학 시스템을 사용하면서도 2.3초 이내에 한 번의 이미징으로 넓은 망막 영역의 3차원 모든 부분에서 세포 수준 고해상도 이미징을 제공하여 망막질환 임상 및 연구에 새로운 전기를 가져올 기술이 개발되어 화제다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 사람 망막의 넓은 영역에서 초점 위치뿐만이 아니라 초점에서 벗어난 위치에서도 세포 수준 고해상도 이미징이 가능한 기술을 개발했다고 3일 밝혔다.
KI헬스사이언스연구소 이병권 박사가 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small, JIF 15.153) 3월호에 게재됐다. (논문명: Wide-Field Three-Dimensional Depth-Invariant Cellular-Resolution Imaging of the Human Retina.)
망막은 안구의 렌즈를 통해 이미징해야 하기 때문에 안구 렌즈의 수차(예, 난시)로 인해 고해상도 이미징이 어렵다. 기존에는 이를 극복하기 위해 안구 렌즈의 수차를 측정하는 광학 하드웨어와 이를 보정해 이미징 광을 주사하는 광학 하드웨어를 사용하는 적응광학(adaptive optics) 방법이 개발돼왔다. 하지만, 이러한 방법은 복잡하고 가격이 비싼 추가의 광학 하드웨어가 필요할 뿐만 아니라, 단일 초점면에서만 고해상도 영상을 얻을 수 있어, 3차원 고해상도 이미지를 얻기 위해서는 초점 위치를 바꿔가며 여러 깊이에서 반복적으로 이미징을 수행해야만 했다.
오왕열 교수 연구팀은 간단한 일반적인 광학계를 사용해 3차원 망막 영상을 한 번에 얻고, 이 영상 데이터에 존재하는 수차와 초점에서 벗어난 부분에서 영상이 흐려지는 디포커싱(defocusing)을 계산을 통해 제거하는 기술을 개발함으로써 이러한 한계를 극복했다. 또한 연구팀은 초고속 위상안정 3차원 OCT(Optical Coherence Tomography: 광간섭 단층촬영) 시스템을 함께 개발해 전산적 수차 및 디포커싱 제거 기술의 실제 응용 현장에서의 유용성을 확보했다.
오왕열 교수는 “전산적 수차 및 디포커싱 제거 기술이 적용되려면, 망막의 3차원 각 위치에서 산란돼 나온 빛의 세기는 물론 위상 값도 모두 정확히 알아야 한다”며 “넓은 3차원 영역을 고해상도로 이미징하려면 영상 데이터의 양(이미지를 구성하는 픽셀 수)이 매우 커지기 때문에, 초고속으로 3차원 영상 데이터를 획득할 수 있는 기술이 필수적이며, 이에 따라 초고속 위상안정 3차원 이미징 시스템이 반드시 필요하다”고 말했다.
새로 개발된 OCT 이미징 시스템은 기존 OCT 기술들의 위상 불안정 문제를 해결하면서도, 현재 가장 빠른 상용 망막 OCT 시스템보다 20배 이상 빠른 이미징 속도를 제공해, 3mm x 3mm 에 걸친 사람 망막의 3차원 영역을 세포 수준으로 촘촘하게 이미징한 위상안정 영상 데이터(약 100억 개의 3차원 화소(픽셀)로 구성)를 2.3초 만에 획득할 수 있게 했다.
오왕열 교수는 “현재 병원에서 사용되는 망막 OCT 시스템과 동일한 간단한 광학계를 사용하면서도, 피험자 망막의 다양한 깊이 위치에 존재하는 망막 신경섬유층, 광수용세포층 등 여러 층의 미세구조를 모두 세포수준의 해상도로 보여줄 수 있어, 실제 망막질환 임상 및 연구 현장에서 매우 유용하게 사용될 것” 이라고 강한 기대를 보였으며, “전산적 수차 및 디포커싱 제거 기술뿐만 아니라, 이 기술 적용에 필수적인 초고속 위상안정 OCT 기술 개발에 주도적인 역할을 한 이병권 박사의 기여가 절대적이었다”라며 공을 돌렸다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.05.03 조회수 3293 -
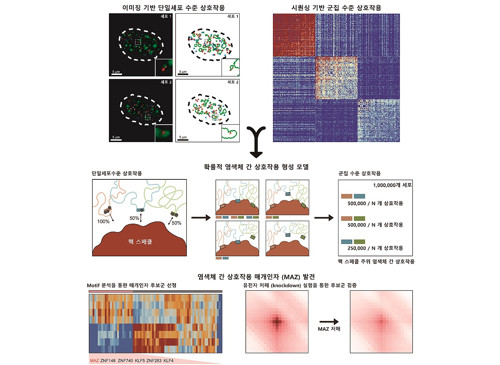 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 3536
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 3536 -
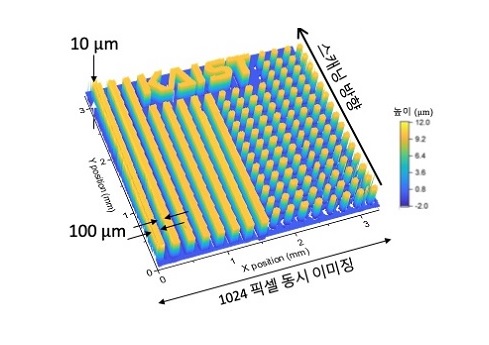 반도체 소자 내의 복잡한 움직임을 관측할 수 있는 초고속 카메라 개발
우리 대학 김정원 교수 연구팀이 반도체 소자 내의 미세 구조와 동적 특성을 고해상도로 측정할 수 있는 초고속 카메라 기술을 개발하였다고 밝혔다.
기존에는 볼 수 없었던 반도체 소자 내에서의 빠르고 불규칙적인 복잡한 움직임을 이제 초고속 카메라로 관측할 수 있게 되었다.
기계공학과 나용진 박사가 제 1저자로 참여하고 기계공학과 유홍기, 이정철 교수팀 및 한국표준과학연구원(KRISS) 서준호, 강주식 박사팀이 참여한 공동연구팀의 이번 논문은 국제학술지 ‘빛: 과학과 응용(Light: Science & Applications)’ [IF=20.257] 2월 15일 字에 게재됐다. (논문명: Massively parallel electro-optic sampling of space-encoded optical pulses for ultrafast multi-dimensional imaging)
최근 마이크로 및 나노 소자들의 복잡도와 기능성이 급격하게 향상됨에 따라 이들 소자 내의 미세 구조와 동적인 움직임을 실시간으로 정확하게 측정해야 할 필요성이 급증하고 있다. 미세 구조 측정 측면에서는 다양한 3차원 집적회로와 소자들의 발전으로 더 큰 웨이퍼 영역에 대해 더 높은 분해능 및 측정속도를 가지는 계측 기술이 반도체 산업에서 중요해지고 있다. 한편 동적 특성의 측정은 마이크로 및 나노 소자 내에서의 물리현상들을 이해하고 다양한 응용 분야들로 발전시키는 데 중요하다. 특히 다양한 역학 현상의 관측을 위해서는 더 높은 해상도, 더 빠른 측정속도 및 더 큰 측정범위를 필요로 하지만 기존의 측정 기술들은 여러가지 한계들을 가지고 있었다.
이번 연구는 기존의 한계를 극복한 새로운 초고속 카메라 기술을 개발하였다. 100펨토초(10조분이 1초) 정도의 매우 짧은 펄스폭을 가지는 빛 펄스를 1000개 이상의 다른 색을 가지는 펄스들로 쪼갠 후, 각기 다른 색을 가진 펄스들을 이용하여 서로 다른 공간적 위치에서의 높낮이를 정밀하게 측정할 수 있는 기술이다. 구현한 기술은 초당 2.6억개의 픽셀들에 대한 높낮이의 차이를 최고 330피코미터(30억분의 1미터) 수준까지 측정할 수 있을 정도로 빠르고 정밀하다. 연구팀은 이를 이용하여 복잡한 3차원 형상을 고속으로 정밀하고 정확하게 측정할 수 있는 초고속 카메라 기능을 선보였고, 기존의 측정 기술로는 관측하기 어렵던 복잡하고 비반복적인 고속의 동역학 현상들을 성공적으로 관측할 수 있었다.
이번에 개발한 초고속 카메라 기술의 고속 형상 이미징 속도와 높은 공간 분해능을 이용하면 반도체 공정이나 3D 프린팅 과정을 실시간으로 모니터링하며 공정을 제어할 수 있어 점점 고도화 및 집적화 되는 공정의 수율을 크게 향상시킬 수 있을 것으로 기대된다. 또한 다양한 진폭이 존재하면서 동시에 매우 빠른 순간 속도를 갖는 미세 구조의 움직임을 포착할 수 있음을 보여, 기존에 관찰하지 못했던 복잡한 비선형(nonlinear) 및 과도(transient)의 물리 현상들을 탐구하는 차세대 계측 기술로 발전할 수 있을 것으로 기대된다.
김정원 교수는 “이번 연구에서는 1차원적인 선 모양의 빛을 스캔해서 움직이는 방식으로 2차원 표면의 높낮이를 측정하였으나, 향후에는 2차원 표면의 높낮이를 스캔 없이 한번에 측정할 수 있는 방식으로 기술을 발전시킬 예정”이라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견후속연구, 선도연구센터, 기초연구실 및 중견연구 사업의 지원을 받아 수행됐다.
2023.03.02 조회수 4257
반도체 소자 내의 복잡한 움직임을 관측할 수 있는 초고속 카메라 개발
우리 대학 김정원 교수 연구팀이 반도체 소자 내의 미세 구조와 동적 특성을 고해상도로 측정할 수 있는 초고속 카메라 기술을 개발하였다고 밝혔다.
기존에는 볼 수 없었던 반도체 소자 내에서의 빠르고 불규칙적인 복잡한 움직임을 이제 초고속 카메라로 관측할 수 있게 되었다.
기계공학과 나용진 박사가 제 1저자로 참여하고 기계공학과 유홍기, 이정철 교수팀 및 한국표준과학연구원(KRISS) 서준호, 강주식 박사팀이 참여한 공동연구팀의 이번 논문은 국제학술지 ‘빛: 과학과 응용(Light: Science & Applications)’ [IF=20.257] 2월 15일 字에 게재됐다. (논문명: Massively parallel electro-optic sampling of space-encoded optical pulses for ultrafast multi-dimensional imaging)
최근 마이크로 및 나노 소자들의 복잡도와 기능성이 급격하게 향상됨에 따라 이들 소자 내의 미세 구조와 동적인 움직임을 실시간으로 정확하게 측정해야 할 필요성이 급증하고 있다. 미세 구조 측정 측면에서는 다양한 3차원 집적회로와 소자들의 발전으로 더 큰 웨이퍼 영역에 대해 더 높은 분해능 및 측정속도를 가지는 계측 기술이 반도체 산업에서 중요해지고 있다. 한편 동적 특성의 측정은 마이크로 및 나노 소자 내에서의 물리현상들을 이해하고 다양한 응용 분야들로 발전시키는 데 중요하다. 특히 다양한 역학 현상의 관측을 위해서는 더 높은 해상도, 더 빠른 측정속도 및 더 큰 측정범위를 필요로 하지만 기존의 측정 기술들은 여러가지 한계들을 가지고 있었다.
이번 연구는 기존의 한계를 극복한 새로운 초고속 카메라 기술을 개발하였다. 100펨토초(10조분이 1초) 정도의 매우 짧은 펄스폭을 가지는 빛 펄스를 1000개 이상의 다른 색을 가지는 펄스들로 쪼갠 후, 각기 다른 색을 가진 펄스들을 이용하여 서로 다른 공간적 위치에서의 높낮이를 정밀하게 측정할 수 있는 기술이다. 구현한 기술은 초당 2.6억개의 픽셀들에 대한 높낮이의 차이를 최고 330피코미터(30억분의 1미터) 수준까지 측정할 수 있을 정도로 빠르고 정밀하다. 연구팀은 이를 이용하여 복잡한 3차원 형상을 고속으로 정밀하고 정확하게 측정할 수 있는 초고속 카메라 기능을 선보였고, 기존의 측정 기술로는 관측하기 어렵던 복잡하고 비반복적인 고속의 동역학 현상들을 성공적으로 관측할 수 있었다.
이번에 개발한 초고속 카메라 기술의 고속 형상 이미징 속도와 높은 공간 분해능을 이용하면 반도체 공정이나 3D 프린팅 과정을 실시간으로 모니터링하며 공정을 제어할 수 있어 점점 고도화 및 집적화 되는 공정의 수율을 크게 향상시킬 수 있을 것으로 기대된다. 또한 다양한 진폭이 존재하면서 동시에 매우 빠른 순간 속도를 갖는 미세 구조의 움직임을 포착할 수 있음을 보여, 기존에 관찰하지 못했던 복잡한 비선형(nonlinear) 및 과도(transient)의 물리 현상들을 탐구하는 차세대 계측 기술로 발전할 수 있을 것으로 기대된다.
김정원 교수는 “이번 연구에서는 1차원적인 선 모양의 빛을 스캔해서 움직이는 방식으로 2차원 표면의 높낮이를 측정하였으나, 향후에는 2차원 표면의 높낮이를 스캔 없이 한번에 측정할 수 있는 방식으로 기술을 발전시킬 예정”이라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견후속연구, 선도연구센터, 기초연구실 및 중견연구 사업의 지원을 받아 수행됐다.
2023.03.02 조회수 4257 -
 생명과학과 조원기 교수, 서경배과학재단 2020년 신진과학자 선정
우리 대학 생명과학과 조원기 교수가 서경배과학재단 2020년 신진 과학자로 선정됐다.
아모레퍼시픽그룹 서경배 회장은 2016년 사재 3000억원을 출연해 서경배과학재단을 설립했다. 재단은 '생명과학 연구자의 혁신적인 발견을 지원해 인류에 공헌한다'는 비전 아래 매년 국내외 생명과학분야에서 새로운 연구 영역을 개척하고 있는 한국인 신진 과학자를 선정하고 있다.
서경배과학재단은 2017년부터 올해까지 17명의 생명과학분야 신진 과학자를 선정했으며, 이들에게는 1인당 매년 최대 5억원을 5년 동안 지급해 총 425억원의 연구비를 지원한다.
서 이사장은 “오랜 기간 많은 분들의 관심과 사랑을 받아왔다”며 “생명과학·바이오 분야를 장기적으로 지원해 인류에 공헌하는 것이 제가 받은 사랑을 사회에 환원할 수 있는 방법”이라고 밝히며 서경배과학재단을 통한 장기적 지원을 다짐했다.
올해는 1월 연구제안서 공모를 시작해 임용 5년 미만의 생명과학분야 신진 과학자에게 총 67건의 연구제안서를 접수받았다. 국내외 석학으로 구성된 심사위원단은 본 심사에 오른 20개 제안서를 7월까지 서면 심사하고 9월에는 12개 제안서의 발표 평가를 통해 최종 3명을 선정했다.
이에 우리 대학 조원기 교수는 살아있는 단일 세포핵 내에서 초고해상도 이미징을 통해 시시각각으로 변화하는 염색질의 단위체들과 핵내 구조체들의 4차원 상호작용을 실시간으로 관찰할 수 있는 연구를 제안했다. 이 연구는 생물학 연구의 오랜 숙제인 전사 조절 과정에 대한 이해를 크게 높일 수 있는 것으로 평가받았다.
조원기 교수와 함께 선정된 서울대학교 노성훈 교수는 현대 구조생물학 연구방법의 한계 극복을 위해 초저온 전자현미경(Cryo-EM) 기반 세포 및 분자 이미징 플랫폼을 개발하고 이를 통해 세포 노화와 질병 발생 기전을 연구하는 선도적인 주제를 제안했다. 또한 함께 선정된 캠브리지대학교 이주현 교수는 폐섬유화증 환자로부터 만들어낸 폐 오가노이드(유사 장기) 모델을 이용해 만성 폐질환으로 손상된 폐 재생 복구 기작을 이해하고자 하는 도전적이고 혁신적인 연구를 보여줬다.
앞서 뽑힌 우리 대학 과학자들의 연구성과도 국내외 학계에서 주목 받고 있다. 특히 코로나19 등 감염병 예방·치료에 기여한 정인경 교수(생명과학과, 2018년 선정)와 주영석 교수(의과학대학원, 2018년 선정)의 연구는 서경배과학재단이 강조하는 공익을 위한 생명과학분야 지원의 중요성을 다시 한 번 확인시켰다.
2020.09.16 조회수 22361
생명과학과 조원기 교수, 서경배과학재단 2020년 신진과학자 선정
우리 대학 생명과학과 조원기 교수가 서경배과학재단 2020년 신진 과학자로 선정됐다.
아모레퍼시픽그룹 서경배 회장은 2016년 사재 3000억원을 출연해 서경배과학재단을 설립했다. 재단은 '생명과학 연구자의 혁신적인 발견을 지원해 인류에 공헌한다'는 비전 아래 매년 국내외 생명과학분야에서 새로운 연구 영역을 개척하고 있는 한국인 신진 과학자를 선정하고 있다.
서경배과학재단은 2017년부터 올해까지 17명의 생명과학분야 신진 과학자를 선정했으며, 이들에게는 1인당 매년 최대 5억원을 5년 동안 지급해 총 425억원의 연구비를 지원한다.
서 이사장은 “오랜 기간 많은 분들의 관심과 사랑을 받아왔다”며 “생명과학·바이오 분야를 장기적으로 지원해 인류에 공헌하는 것이 제가 받은 사랑을 사회에 환원할 수 있는 방법”이라고 밝히며 서경배과학재단을 통한 장기적 지원을 다짐했다.
올해는 1월 연구제안서 공모를 시작해 임용 5년 미만의 생명과학분야 신진 과학자에게 총 67건의 연구제안서를 접수받았다. 국내외 석학으로 구성된 심사위원단은 본 심사에 오른 20개 제안서를 7월까지 서면 심사하고 9월에는 12개 제안서의 발표 평가를 통해 최종 3명을 선정했다.
이에 우리 대학 조원기 교수는 살아있는 단일 세포핵 내에서 초고해상도 이미징을 통해 시시각각으로 변화하는 염색질의 단위체들과 핵내 구조체들의 4차원 상호작용을 실시간으로 관찰할 수 있는 연구를 제안했다. 이 연구는 생물학 연구의 오랜 숙제인 전사 조절 과정에 대한 이해를 크게 높일 수 있는 것으로 평가받았다.
조원기 교수와 함께 선정된 서울대학교 노성훈 교수는 현대 구조생물학 연구방법의 한계 극복을 위해 초저온 전자현미경(Cryo-EM) 기반 세포 및 분자 이미징 플랫폼을 개발하고 이를 통해 세포 노화와 질병 발생 기전을 연구하는 선도적인 주제를 제안했다. 또한 함께 선정된 캠브리지대학교 이주현 교수는 폐섬유화증 환자로부터 만들어낸 폐 오가노이드(유사 장기) 모델을 이용해 만성 폐질환으로 손상된 폐 재생 복구 기작을 이해하고자 하는 도전적이고 혁신적인 연구를 보여줬다.
앞서 뽑힌 우리 대학 과학자들의 연구성과도 국내외 학계에서 주목 받고 있다. 특히 코로나19 등 감염병 예방·치료에 기여한 정인경 교수(생명과학과, 2018년 선정)와 주영석 교수(의과학대학원, 2018년 선정)의 연구는 서경배과학재단이 강조하는 공익을 위한 생명과학분야 지원의 중요성을 다시 한 번 확인시켰다.
2020.09.16 조회수 22361 -
 해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
2020.03.23 조회수 14872
해상도 높인 곤충 눈 구조 초박형 카메라 개발
바이오및뇌공학과 정기훈 교수 연구팀이 고해상도 이미징을 위한 곤충 눈 구조의 초박형 카메라를 개발했다. 이 카메라는 독특한 시각 구조를 가진 제노스 페키(Xenos peckii)라는 곤충의 눈을 모사해 개발돼, 상용 카메라보다 더 얇은 렌즈 두께와 넓은 광시야각을 갖는다. 이러한 특징을 이용해 모바일, 감시 및 정찰 장비, 의료영상 기기 등 다양한 소형 카메라가 필요한 분야에 적용 가능할 것으로 기대된다.
김기수 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용 (Light : Science & Applications)’ 2월 27일 자 온라인판에 게재됐다. (논문명: 고대비 고해상도 이미징을 위한 생체모사 초박형 카메라, Biologically Inspired Ultrathin Arrayed Camera for High Contrast and High Resolution Imaging)
최근 초소형 및 초박형 스마트 기기의 개발로 소형화된 이미징 시스템의 수요가 커지고 있다. 그러나 기존의 카메라는 물체의 상이 일그러지거나 흐려지는 현상인 수차를 줄이기 위해 다층 렌즈 구조를 활용하기 때문에 렌즈 두께를 감소하는 데 한계가 있다. 또한, 기존의 곤충 눈을 모사한 미세렌즈 배열(Microlens arrays)은 렌즈 사이의 광학 크로스토크(Optical crosstalk)로 인해 해상도가 저해되는 단점이 있다.
연구팀은 문제 해결을 위해 제노스 페키 곤충의 시각 구조를 모사한 렌즈를 제작했고 이를 이미지 센서와 결합해 초박형 카메라를 개발했다. 곤충의 눈은 렌즈와 렌즈 사이의 빛을 차단하는 색소 세포(pigment cells)가 존재해 각 렌즈에서 결상(어떤 물체에서 나온 광선 등이 반사 굴절한 다음 다시 모여 그 물체와 닮은꼴의 상을 만드는 현상)되는 영상들 간의 간섭을 막는다. 이러한 구조는 렌즈들 사이의 광학 크로스토크를 막아 고 대비 및 고해상도 영상을 획득하는 데 도움을 준다.
연구팀은 이러한 광 차단 구조를 포토리소그래피(Photolithography) 공정으로 매우 얇게 제작해 렌즈들 사이의 광학 크로스토크를 효율적으로 차단했다. 렌즈의 두께를 최소화하기 위해 렌즈의 방향을 이미지 센서 방향인 역방향으로 배치했으며, 이를 통해 최종 개발된 카메라 렌즈의 두께는 0.74mm로 이는 10원짜리 동전 절반 정도의 두께이다. 연구팀은 카메라의 원거리에 있는 물체를 모든 렌즈에서 같은 시야각을 통해 동일한 영상을 획득하고, 이 배열 영상들은 해상도를 하나의 이미지로 합성했다. 합성된 영상은 합성 전 단일 채널 영상보다 향상된 해상도를 가짐을 확인했다.
정기훈 교수는 “실질적으로 상용화 가능한 초박형 카메라를 제작하는 방법을 개발했다”라며 “이 카메라는 영상획득이 필요한 장치에 통합돼 장치 소형화에 크게 기여할 것으로 확신한다”라고 말했다.
2020.03.23 조회수 14872 -
 허원도 교수, 변화무쌍 스위치 단백질 관찰하는 바이오센서 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 신호전달 스위치단백질의 활성을 모니터링하는 새로운‘바이오센서’를 개발하고 살아있는 생쥐의 신경세포 활성화를 관찰하는데 성공했다.
이번 연구를 통해 암세포의 이동과 신경세포 활성화 등 다양한 세포 기능에 관여하는 신호전달 스위치 단백질의 변화무쌍한 과정을 실시간으로 볼 수 있을 것으로 기대된다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈’(Nature Communications)에 1월 14일자 온라인 판에 게재됐다.
세포의 신호전달 스위치 단백질은 스위치가 켜지면 기계가 작동하듯 활성화 여부로 세포의 기능을 제어한다. 대표적인 신호전달 스위치단백질인 small GTPase은 세포의 이동, 분열, 사멸과 유전자 발현 등에 관여한다. 핵심 단백질인 small GTPase를 제어할 수 있다면 세포의 기능도 조절할 수 있어 많은 연구팀들이 연구주제로 삼고 있다.
허원도 교수 연구팀이 그간 연구 노하우를 바탕으로 개발한 새로운 바이오센서는 small GTPase 활성의 모든 변화 과정을 실시간으로 볼 수 있는 도구다. 광유전학과 결합해 다양한 방식으로 관찰이 가능하고 민감도가 커 생체 내 두꺼운 조직 안에서 벌어지는 수 나노미터(nm) 크기의 변화까지도 정밀하게 볼 수 있다는 게 특징이다. 고감도 성능을 이용하면 살아있는 동물의 암세포 전이 및 뇌 속 신경세포의 구조변화를 관찰할 수 있어 향후 강력한 이미징 기술이 될 것으로 기대된다.
일반적으로 small GTPase의 활성을 관찰하는 데엔 형광 공명 에너지전달(FRET) 방식을 이용했다. 하지만 FRET 방식은 광유전학과 광 파장이 겹쳐 정작 관찰해야 할 세포신호의 변화는 보기가 어려웠다. 또 민감도가 낮아 동물 모델에 적용하는 것도 제한적이었다.
연구팀은 단백질 공학 기술로 5가지 종류의 small GTPase 단백질의 바이오센서를 개발하고 두 가지 파장(488nm, 561nm)에서 관찰이 가능한 바이오센서를 개발, 이를 동시에 분석하는데 성공했다. 연구진이 개발한 바이오센서는 기존 바이오센서가 청색광을 활용하는 광유전학 기법의 파장과 겹치는 문제를 효과적으로 극복해 세포의 이동방향을 살피면서 동시에 공간적 기능도 분석할 수 있는 장점이 있다.
연구팀은 유방암 전이 암세포에 바이오센서를 발현시키고, 광유전학 기술로 암세포 이동 방향을 조절하자 small GTPase 단백질이 활성화됨을 확인했다. 이 과정에서 암세포의 이동 방향이 변할 때, 세포 내 small GTPase가 이리저리 움직이며 활성화하는 모습을 실시간 이미징하는데 성공했다. 연구진은 small GTPase의 활성을 실시간으로 탐지해 추후 암치료물질을 탐색하는 등 다방면의 기술 접목이 가능할 것으로 전망한다.
더 나아가 IBS 연구진은 미국 막스 플랑크 플로리다 연구소(Max Plank Florida Institute)의 권형배 박사 연구팀과 공동연구를 진행했다. 연구진은 공 위를 달리는 실험으로 깨어있는 생쥐인 실험군과 마취된 대조군의 뇌 영역의 운동 피질의 신경세포에서의 small GTPase단백질의 활성을 비교하는데 성공했다. 살아있는 쥐에서 수 나노미터 단위의 신경세포 수상돌기 가시 수상돌기 가시에서 실시간으로 변화하는 small GTPase 단백질의 활성을 관찰한 것은 이번이 처음이다.
이번에 개발된 바이오센서는 시냅스처럼 수 마이크로미터 단위의 미세한 구조에서도 목표한 단백질을 관찰할 수 있을 만큼 민감도가 크다. 실험쥐의 운동행동과 같은 생리학적 현상에 지장을 주지 않는 자연스러운 상태에서 뇌 영역을 바로 실시간으로 관찰할 수 있어 뇌 관련 연구에도 다양하게 적용될 수 있다.
연구를 이끈 허원도 교수는 “이번 연구는 small GTPase 단백질을 생체 내에서 관찰하기 위한 기존의 바이오센서들의 기술적 한계를 극복하는데 성공했다”며 “특히 청색 빛을 활용한 광유전학 기술과 동시에 적용할 수 있어 다양한 세포막 수용체와 관련된 광범위한 세포신호전달연구와 뇌인지과학연구에 접목이 가능할 것으로 기대된다”고 말했다.
□ 그림 설명
그림1. small GTPase 바이오센서 개발
그림2. small GTPase 바이오센서를 이용해 유방암 전이 암세포 관찰
그림3. 운동 행동 중인 생쥐 실시간 관찰
2019.01.15 조회수 9461
허원도 교수, 변화무쌍 스위치 단백질 관찰하는 바이오센서 개발
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀(기초과학연구원 인지 및 사회성 연구단)이 신호전달 스위치단백질의 활성을 모니터링하는 새로운‘바이오센서’를 개발하고 살아있는 생쥐의 신경세포 활성화를 관찰하는데 성공했다.
이번 연구를 통해 암세포의 이동과 신경세포 활성화 등 다양한 세포 기능에 관여하는 신호전달 스위치 단백질의 변화무쌍한 과정을 실시간으로 볼 수 있을 것으로 기대된다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈’(Nature Communications)에 1월 14일자 온라인 판에 게재됐다.
세포의 신호전달 스위치 단백질은 스위치가 켜지면 기계가 작동하듯 활성화 여부로 세포의 기능을 제어한다. 대표적인 신호전달 스위치단백질인 small GTPase은 세포의 이동, 분열, 사멸과 유전자 발현 등에 관여한다. 핵심 단백질인 small GTPase를 제어할 수 있다면 세포의 기능도 조절할 수 있어 많은 연구팀들이 연구주제로 삼고 있다.
허원도 교수 연구팀이 그간 연구 노하우를 바탕으로 개발한 새로운 바이오센서는 small GTPase 활성의 모든 변화 과정을 실시간으로 볼 수 있는 도구다. 광유전학과 결합해 다양한 방식으로 관찰이 가능하고 민감도가 커 생체 내 두꺼운 조직 안에서 벌어지는 수 나노미터(nm) 크기의 변화까지도 정밀하게 볼 수 있다는 게 특징이다. 고감도 성능을 이용하면 살아있는 동물의 암세포 전이 및 뇌 속 신경세포의 구조변화를 관찰할 수 있어 향후 강력한 이미징 기술이 될 것으로 기대된다.
일반적으로 small GTPase의 활성을 관찰하는 데엔 형광 공명 에너지전달(FRET) 방식을 이용했다. 하지만 FRET 방식은 광유전학과 광 파장이 겹쳐 정작 관찰해야 할 세포신호의 변화는 보기가 어려웠다. 또 민감도가 낮아 동물 모델에 적용하는 것도 제한적이었다.
연구팀은 단백질 공학 기술로 5가지 종류의 small GTPase 단백질의 바이오센서를 개발하고 두 가지 파장(488nm, 561nm)에서 관찰이 가능한 바이오센서를 개발, 이를 동시에 분석하는데 성공했다. 연구진이 개발한 바이오센서는 기존 바이오센서가 청색광을 활용하는 광유전학 기법의 파장과 겹치는 문제를 효과적으로 극복해 세포의 이동방향을 살피면서 동시에 공간적 기능도 분석할 수 있는 장점이 있다.
연구팀은 유방암 전이 암세포에 바이오센서를 발현시키고, 광유전학 기술로 암세포 이동 방향을 조절하자 small GTPase 단백질이 활성화됨을 확인했다. 이 과정에서 암세포의 이동 방향이 변할 때, 세포 내 small GTPase가 이리저리 움직이며 활성화하는 모습을 실시간 이미징하는데 성공했다. 연구진은 small GTPase의 활성을 실시간으로 탐지해 추후 암치료물질을 탐색하는 등 다방면의 기술 접목이 가능할 것으로 전망한다.
더 나아가 IBS 연구진은 미국 막스 플랑크 플로리다 연구소(Max Plank Florida Institute)의 권형배 박사 연구팀과 공동연구를 진행했다. 연구진은 공 위를 달리는 실험으로 깨어있는 생쥐인 실험군과 마취된 대조군의 뇌 영역의 운동 피질의 신경세포에서의 small GTPase단백질의 활성을 비교하는데 성공했다. 살아있는 쥐에서 수 나노미터 단위의 신경세포 수상돌기 가시 수상돌기 가시에서 실시간으로 변화하는 small GTPase 단백질의 활성을 관찰한 것은 이번이 처음이다.
이번에 개발된 바이오센서는 시냅스처럼 수 마이크로미터 단위의 미세한 구조에서도 목표한 단백질을 관찰할 수 있을 만큼 민감도가 크다. 실험쥐의 운동행동과 같은 생리학적 현상에 지장을 주지 않는 자연스러운 상태에서 뇌 영역을 바로 실시간으로 관찰할 수 있어 뇌 관련 연구에도 다양하게 적용될 수 있다.
연구를 이끈 허원도 교수는 “이번 연구는 small GTPase 단백질을 생체 내에서 관찰하기 위한 기존의 바이오센서들의 기술적 한계를 극복하는데 성공했다”며 “특히 청색 빛을 활용한 광유전학 기술과 동시에 적용할 수 있어 다양한 세포막 수용체와 관련된 광범위한 세포신호전달연구와 뇌인지과학연구에 접목이 가능할 것으로 기대된다”고 말했다.
□ 그림 설명
그림1. small GTPase 바이오센서 개발
그림2. small GTPase 바이오센서를 이용해 유방암 전이 암세포 관찰
그림3. 운동 행동 중인 생쥐 실시간 관찰
2019.01.15 조회수 9461 -
 이서은 씨, 한국광학회 우수논문상 수상
우리 학교 생명과학과 졸업생 이서은(21, 2월 졸업, 해외 대학원 진학예정) 씨가 지난달 19일~21일 대전 컨벤션센터에서 열린 ‘2014년 한국광학회 동계학술발표회’에서 바이오포토닉스 분과 우수논문상을 수상했다.
9개 분과에서 총 270편의 논문이 발표된 이 학회에서는 분과 당 한 편씩 우수논문을 선정하는데 이 분야 전공이 아닌 학부생이 우수논문상을 받은 것은 매우 이례적인 일이다.
이 씨는 기존에 형광 염색 등을 통해서만 가능했던 지방 소립 촬영을 홀로그래피 기술을 이용해 표지 분자 없이 촬영할 수 있다는 것을 처음으로 발견해 연구의 우수성을 인정받았다.
이 씨는 지난해 6월부터 물리학과 박용근 교수의 지도 아래 학부연구생으로서 개별연구로 홀로그래피를 이용한 세포 이미징을 연구해왔다.
한국광학회는 1989년에 창립돼 올해 25번째 정기총회를 맞이했으며 매년 학술발표회, 단기강좌, 세미나, 강연회 등을 개최하는 국내 광학분야 최대 학회다.
2014.03.04 조회수 13964
이서은 씨, 한국광학회 우수논문상 수상
우리 학교 생명과학과 졸업생 이서은(21, 2월 졸업, 해외 대학원 진학예정) 씨가 지난달 19일~21일 대전 컨벤션센터에서 열린 ‘2014년 한국광학회 동계학술발표회’에서 바이오포토닉스 분과 우수논문상을 수상했다.
9개 분과에서 총 270편의 논문이 발표된 이 학회에서는 분과 당 한 편씩 우수논문을 선정하는데 이 분야 전공이 아닌 학부생이 우수논문상을 받은 것은 매우 이례적인 일이다.
이 씨는 기존에 형광 염색 등을 통해서만 가능했던 지방 소립 촬영을 홀로그래피 기술을 이용해 표지 분자 없이 촬영할 수 있다는 것을 처음으로 발견해 연구의 우수성을 인정받았다.
이 씨는 지난해 6월부터 물리학과 박용근 교수의 지도 아래 학부연구생으로서 개별연구로 홀로그래피를 이용한 세포 이미징을 연구해왔다.
한국광학회는 1989년에 창립돼 올해 25번째 정기총회를 맞이했으며 매년 학술발표회, 단기강좌, 세미나, 강연회 등을 개최하는 국내 광학분야 최대 학회다.
2014.03.04 조회수 13964