-
 맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27
조회수 4900
-
 장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03
조회수 7862
-
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03
조회수 9381
-
 약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
2023.07.18
조회수 8676
-
 인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2023.03.16
조회수 8373
-
 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09
조회수 8898
-
 인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
2022.08.12
조회수 10522
-
 실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17
조회수 14316
-
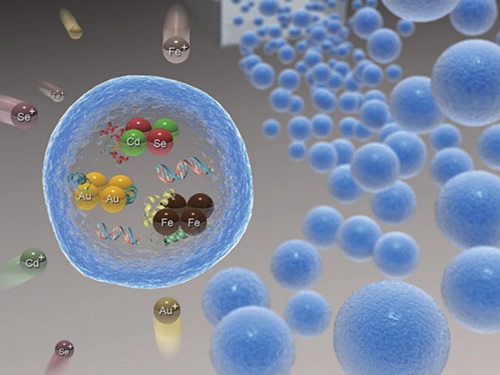 위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07
조회수 15630
-
 약물 가상 스크리닝 기술로 코로나19 치료제 후보 발굴
우리 대학 생명화학공학과 이상엽 특훈교수(연구부총장)와 한국파스퇴르연구소 김승택 박사 공동연구팀이 ‘약물 가상 스크리닝 기술을 이용한 코로나19 치료제 개발’에 성공했다고 8일 밝혔다.
이번 연구 결과는 국제 학술지인 ‘미국국립과학원회보(PNAS)'에 7월 7일 字 온라인 게재됐다.
※ 논문명 : Drugs repurposed for COVID-19 by virtual screening of 6,218 drugs and cell-based assay
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김승택(한국파스퇴르연구소, 교신저자), 장우대(한국과학기술원, 제1저자), 전상은(한국파스퇴르연구소, 제2저자), 포함 총 4명
코로나바이러스감염증-19(이하 코로나19)는 글로벌 팬데믹으로 전개되고 있으며 현재 인류 보건을 심각하게 위협하는 상황이다. 코로나19 치료 목적으로 미국식품의약국(FDA)에서 정식 승인을 받은 렘데시비르(상품명 베클러리)가 현재 임상에서 사용 중이지만, 사망률은 감소시키지 못하고 회복 기간을 5일 정도 단축함으로써 치료 효과가 기대에 미치지 못하는 것으로 알려졌다. 또한 렘데시비르는 정맥 주사제여서 의료기관에서 입원을 통해 수일 동안 투여받아야 하므로 팬데믹 상황에 적합하지 않은 약물이다. 따라서 코로나19로 인한 사망률을 획기적으로 감소시키고, 치료 기간을 단축시키는 경구용 치료제 개발이 시급한 상황이었다.
이에 이상엽 특훈교수와 한국파스퇴르연구소 김승택 박사 공동연구팀은 약물 가상 스크리닝 기술을 이용한 약물 재창출 전략으로 코로나19 치료제 개발 연구를 수행했다.
연구팀은 팬데믹 상황에 대응한 신속한 치료제 개발을 위해 가상 스크리닝 기술을 이용한 약물 재창출 전략을 수립했다. 약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물을 대상으로 새로운 적응증을 찾는 방식이다. 이 전략은 신약 개발 과정에 소요되는 시간을 단축시킬 수 있어 코로나19와 같은 팬데믹 상황에 적합한 신약 개발 전략이다.
우리 대학 생명화학공학과 장우대 박사는 우선 FDA 승인 약물 또는 임상 진행 중인 약물을 데이터베이스에서 수집해 6,218종의 약물 가상 라이브러리를 구축했다. 실험으로 이 약물들을 모두 검증하기에는 시간과 비용이 많이 소요되기 때문에 바이러스 치료제로 가능성이 있는 약물만 신속하게 선별할 수 있는 컴퓨터 기반 가상 스크리닝 기술을 도입했다.
기존의 도킹 시뮬레이션 기반의 가상 스크리닝 기술은 높은 위양성률(false positive rate)로 인해 유효물질 도출 비율(hit rate)이 매우 낮은 것이 문제점인 상황이었다. 연구팀은 구조 유사도 분석 모듈과 상호작용 유사도 분석 모듈을 도킹 전후에 도입하여 가상 스크리닝의 정확도를 높이는 데 성공했다. 이번 연구를 통해 개발된 가상 스크리닝 기술은 단백질-약물 복합체 구조 정보를 이용하여 다양한 후보 약물을 빠르고 정확하게 스크리닝할 수 있는 것이 특징이다.
연구팀은 또한 바이러스 치료제로 주로 사용되는 핵산 유사체(nucleotide analogues) 기반 전구약물(prodrug)의 활성형 구조를 자동으로 생성하는 알고리즘을 개발했다. 전구약물은 그 자체로는 약효가 없고 체내 대사를 통해 활성형 구조로 변환되어야만 약효를 나타낸다. 따라서 전구약물은 활성형으로 구조변환 후, 도킹 시뮬레이션을 수행하는 것이 중요하다. 연구팀은 렘데시비르를 포함한 여러 핵산유사체 기반 전구약물들의 활성형 구조를 자동으로 생성하는 데 성공하였고, 도킹 시뮬레이션의 정확도를 향상시킬 수 있었다.
연구팀은 가상 스크리닝 플랫폼으로 사스-코로나바이러스-2(SARS-CoV-2)의 복제와 증식에 필수적인 역할을 하는 단백질 가수분해 효소(3CL hydrolase, Mpro)와 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 저해할 수 있는 후보 화합물을 15종과 23종으로 각각 선별했다.
그 후, 가상 스크리닝으로 선별된 38종의 약물에 대해 한국파스퇴르연구소의 생물안전 3등급(BSL-3) 실험실에서 세포 이미지 기반 항바이러스 활성 분석 플랫폼을 활용해 약효를 검증했다.
먼저 사스-코로나바이러스-2를 감염시킨 원숭이 신장세포(Vero cell)를 이용한 시험관 내(in vitro) 실험을 수행한 결과, 38종의 약물 중 7종의 약물에서 항바이러스 활성이 확인됐다.
또한, 검증된 7종의 약물에 대해 인간 폐 세포(Calu-3 cell)에서 추가적인 검증 실험을 수행했고, 3종의 약물에서 항바이러스 활성이 확인됐다. 후보 약물에는 암 및 특발성 폐섬유증(idiopathic pulmonary fibrosis)으로 임상이 진행 중인 오미팔리십(omipalisib), 암 및 조로증(progeria)으로 임상이 진행 중인 티피파닙(tipifarnib), 식물 추출물로써 항암제로 임상이 진행 중인 에모딘(emodin)이 있다. 특히 오미팔리십은 현재 코로나19 표준 치료제인 렘데시비르 대비 항바이러스 활성이 약 200배 이상 높은 것으로 확인됐고, 티피파닙은 렘데시비르와 유사한 수준으로 항바이러스 활성이 확인됐다.
세포 수준에서 항바이러스 효과가 확인된 약물은 바이러스 감염 동물모델을 이용한 전임상시험이 필요하다. 이에 연구팀은 과기정통부의 코로나 치료제 전임상 지원사업을 통해 후보 약물 중 하나의 약물에 대해 약효를 평가했다. 그러나 이 과정에서 동물에 대한 약물 독성이 나타났다. 약물의 독성을 최소화하면서 치료 유효 농도에 도달할 수 있는 최적의 약물 농도를 찾기 위해 추가적인 전임상시험을 진행할 예정이다. 또한, 나머지 후보 약물들에 대해서도 전임상시험을 계획 중이다.
연구팀 관계자는 이번 연구를 통해 예측 성능이 우수한 약물 가상 스크리닝 플랫폼을 구축했고, 이를 통해 코로나19 치료제로 유망한 후보물질을 단기간에 발견할 수 있었다고 설명했다.
이상엽 특훈교수는 “이번 연구를 통해 신종 바이러스 출현 시 신속하게 대응할 수 있는 기반 기술을 마련했다는 데에 의의가 있으며, 이를 통해 향후 코로나바이러스 계열의 유사한 바이러스나 신종 바이러스 출현 시에도 적용할 수 있는 기술을 개발하고자 한다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
약물 가상 스크리닝 기술로 코로나19 치료제 후보 발굴
우리 대학 생명화학공학과 이상엽 특훈교수(연구부총장)와 한국파스퇴르연구소 김승택 박사 공동연구팀이 ‘약물 가상 스크리닝 기술을 이용한 코로나19 치료제 개발’에 성공했다고 8일 밝혔다.
이번 연구 결과는 국제 학술지인 ‘미국국립과학원회보(PNAS)'에 7월 7일 字 온라인 게재됐다.
※ 논문명 : Drugs repurposed for COVID-19 by virtual screening of 6,218 drugs and cell-based assay
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김승택(한국파스퇴르연구소, 교신저자), 장우대(한국과학기술원, 제1저자), 전상은(한국파스퇴르연구소, 제2저자), 포함 총 4명
코로나바이러스감염증-19(이하 코로나19)는 글로벌 팬데믹으로 전개되고 있으며 현재 인류 보건을 심각하게 위협하는 상황이다. 코로나19 치료 목적으로 미국식품의약국(FDA)에서 정식 승인을 받은 렘데시비르(상품명 베클러리)가 현재 임상에서 사용 중이지만, 사망률은 감소시키지 못하고 회복 기간을 5일 정도 단축함으로써 치료 효과가 기대에 미치지 못하는 것으로 알려졌다. 또한 렘데시비르는 정맥 주사제여서 의료기관에서 입원을 통해 수일 동안 투여받아야 하므로 팬데믹 상황에 적합하지 않은 약물이다. 따라서 코로나19로 인한 사망률을 획기적으로 감소시키고, 치료 기간을 단축시키는 경구용 치료제 개발이 시급한 상황이었다.
이에 이상엽 특훈교수와 한국파스퇴르연구소 김승택 박사 공동연구팀은 약물 가상 스크리닝 기술을 이용한 약물 재창출 전략으로 코로나19 치료제 개발 연구를 수행했다.
연구팀은 팬데믹 상황에 대응한 신속한 치료제 개발을 위해 가상 스크리닝 기술을 이용한 약물 재창출 전략을 수립했다. 약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물을 대상으로 새로운 적응증을 찾는 방식이다. 이 전략은 신약 개발 과정에 소요되는 시간을 단축시킬 수 있어 코로나19와 같은 팬데믹 상황에 적합한 신약 개발 전략이다.
우리 대학 생명화학공학과 장우대 박사는 우선 FDA 승인 약물 또는 임상 진행 중인 약물을 데이터베이스에서 수집해 6,218종의 약물 가상 라이브러리를 구축했다. 실험으로 이 약물들을 모두 검증하기에는 시간과 비용이 많이 소요되기 때문에 바이러스 치료제로 가능성이 있는 약물만 신속하게 선별할 수 있는 컴퓨터 기반 가상 스크리닝 기술을 도입했다.
기존의 도킹 시뮬레이션 기반의 가상 스크리닝 기술은 높은 위양성률(false positive rate)로 인해 유효물질 도출 비율(hit rate)이 매우 낮은 것이 문제점인 상황이었다. 연구팀은 구조 유사도 분석 모듈과 상호작용 유사도 분석 모듈을 도킹 전후에 도입하여 가상 스크리닝의 정확도를 높이는 데 성공했다. 이번 연구를 통해 개발된 가상 스크리닝 기술은 단백질-약물 복합체 구조 정보를 이용하여 다양한 후보 약물을 빠르고 정확하게 스크리닝할 수 있는 것이 특징이다.
연구팀은 또한 바이러스 치료제로 주로 사용되는 핵산 유사체(nucleotide analogues) 기반 전구약물(prodrug)의 활성형 구조를 자동으로 생성하는 알고리즘을 개발했다. 전구약물은 그 자체로는 약효가 없고 체내 대사를 통해 활성형 구조로 변환되어야만 약효를 나타낸다. 따라서 전구약물은 활성형으로 구조변환 후, 도킹 시뮬레이션을 수행하는 것이 중요하다. 연구팀은 렘데시비르를 포함한 여러 핵산유사체 기반 전구약물들의 활성형 구조를 자동으로 생성하는 데 성공하였고, 도킹 시뮬레이션의 정확도를 향상시킬 수 있었다.
연구팀은 가상 스크리닝 플랫폼으로 사스-코로나바이러스-2(SARS-CoV-2)의 복제와 증식에 필수적인 역할을 하는 단백질 가수분해 효소(3CL hydrolase, Mpro)와 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 저해할 수 있는 후보 화합물을 15종과 23종으로 각각 선별했다.
그 후, 가상 스크리닝으로 선별된 38종의 약물에 대해 한국파스퇴르연구소의 생물안전 3등급(BSL-3) 실험실에서 세포 이미지 기반 항바이러스 활성 분석 플랫폼을 활용해 약효를 검증했다.
먼저 사스-코로나바이러스-2를 감염시킨 원숭이 신장세포(Vero cell)를 이용한 시험관 내(in vitro) 실험을 수행한 결과, 38종의 약물 중 7종의 약물에서 항바이러스 활성이 확인됐다.
또한, 검증된 7종의 약물에 대해 인간 폐 세포(Calu-3 cell)에서 추가적인 검증 실험을 수행했고, 3종의 약물에서 항바이러스 활성이 확인됐다. 후보 약물에는 암 및 특발성 폐섬유증(idiopathic pulmonary fibrosis)으로 임상이 진행 중인 오미팔리십(omipalisib), 암 및 조로증(progeria)으로 임상이 진행 중인 티피파닙(tipifarnib), 식물 추출물로써 항암제로 임상이 진행 중인 에모딘(emodin)이 있다. 특히 오미팔리십은 현재 코로나19 표준 치료제인 렘데시비르 대비 항바이러스 활성이 약 200배 이상 높은 것으로 확인됐고, 티피파닙은 렘데시비르와 유사한 수준으로 항바이러스 활성이 확인됐다.
세포 수준에서 항바이러스 효과가 확인된 약물은 바이러스 감염 동물모델을 이용한 전임상시험이 필요하다. 이에 연구팀은 과기정통부의 코로나 치료제 전임상 지원사업을 통해 후보 약물 중 하나의 약물에 대해 약효를 평가했다. 그러나 이 과정에서 동물에 대한 약물 독성이 나타났다. 약물의 독성을 최소화하면서 치료 유효 농도에 도달할 수 있는 최적의 약물 농도를 찾기 위해 추가적인 전임상시험을 진행할 예정이다. 또한, 나머지 후보 약물들에 대해서도 전임상시험을 계획 중이다.
연구팀 관계자는 이번 연구를 통해 예측 성능이 우수한 약물 가상 스크리닝 플랫폼을 구축했고, 이를 통해 코로나19 치료제로 유망한 후보물질을 단기간에 발견할 수 있었다고 설명했다.
이상엽 특훈교수는 “이번 연구를 통해 신종 바이러스 출현 시 신속하게 대응할 수 있는 기반 기술을 마련했다는 데에 의의가 있으며, 이를 통해 향후 코로나바이러스 계열의 유사한 바이러스나 신종 바이러스 출현 시에도 적용할 수 있는 기술을 개발하고자 한다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2021.07.08
조회수 16320
-
 땀 검사로 건강 상태를 진단할 수 있는 전자소자 개발
우리 대학 전기및전자공학부 권경하 교수 연구팀이 성균관대학교 화학공학과 김종욱 박사과정 연구원(지도교수:김태일 교수, 성균관대학교 화학공학/고분자 공학부)과 땀의 체적 유량 및 총 손실을 실시간으로 측정하는 무선 전자 패치를 개발했다고 6일 밝혔다.
이 기술은 미국 노스웨스턴대 존 로저스 교수, 보스턴 소재 웨어리파이(Wearifi)사와 특허 출원 진행 중이며, 해당 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 지난 3월 말 발표됐다. (논문명 : An on-skin platform for wireless monitoring of flow rate, cumulative loss and temperature of sweat in real time)
땀은 비침습적으로 수집할 수 있는 생체 유체로, 침습적인 혈액 채취와 비교해 채취하기가 쉽다는 분명한 이점을 제공한다. 이에 일상에서 실시간으로 땀 수집 및 성분 분석을 제공할 수 있는 웨어러블 기술에 대한 수요가 증가하고 있다.
땀과 화학 시약의 변색 반응을 이용해 다양한 생체 지표 수집이 가능하지만, 정확한 측정(발색)을 하려면 땀의 유량과 총 손실을 실시간으로 측정하는 것이 핵심적으로 요구된다. 이에 연구팀은 땀의 정량적 속도 및 체적 측정이 가능한 웨어러블 무선 전자 패치를 개발했고, 변색 반응을 이용해 땀 성분 분석이 가능한 미세 유체 시스템과 통합했다.
그 결과, 연구팀은 땀 내 염화물, 포도당 및 크레아틴 농도, 수소이온지수(pH) 및 체적 유량을 동시에 측정하는 데 최초로 성공했다. 측정한 지표는 낭포성 섬유증, 당뇨병, 신장 기능 장애, 대사성 알칼리증 진단 등에 활용할 수 있다.
연구팀은 땀이 수집되는 짧고 정교한 미세 유체 채널 외벽에 저전력 열원을 배치해 채널을 통과하는 땀과 열 교환을 유도했다. 땀의 유속이 증가함에 따라 열원의 하류와 상류의 온도 차이가 증가하는 것에 착안, 상·하류 온도 차이와 땀의 배출 속도 간의 정확한 관계를 규명했다. 그 결과, 생리학적으로 유의미하다고 인정되는 0~5마이크로리터/분(μl/min) 범위의 땀 속도를 정확하게 측정하는 데 성공했다. 웨어러블 패치로 측정한 데이터는 블루투스 통신이 가능한 스마트폰 앱을 통해 실시간 확인이 가능하다.
이 패치는 미세 유체 채널을 통과하는 땀과 전자 회로가 완전히 분리되어, 기존 유속 측정 기기들의 유체와의 접촉으로 인한 부식 및 노후화에 취약하다는 단점을 극복했다. 또한, 얇고 유연한 회로 기판 인쇄 기법과 신축성 있는 실리콘 봉합 기술을 접목해 다양한 굴곡을 가진 피부 위에 편안하게 부착할 수 있도록 제작됐다. 땀 배출로 인한 피부 온도 변화를 실시간으로 감지하는 센서도 부착돼 있어 다양한 응용 분야에서 활용이 기대된다.
권경하 교수는 "개발된 무선 전자 패치는 개인별 수분 보충 전략, 탈수 증세 감지 및 기타 건강 관리에 폭넓게 활용할 수 있다ˮ면서 "피부 표면 근처의 혈관에서 혈류 속도를 측정하거나, 약물의 방출 속도를 실시간으로 측정해 정확한 투여량을 계산하는 등 체계화된 약물 전달 시스템에도 활용할 수 있을 것ˮ이라고 말했다.
한편, 이번 연구는 한국연구재단의 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
땀 검사로 건강 상태를 진단할 수 있는 전자소자 개발
우리 대학 전기및전자공학부 권경하 교수 연구팀이 성균관대학교 화학공학과 김종욱 박사과정 연구원(지도교수:김태일 교수, 성균관대학교 화학공학/고분자 공학부)과 땀의 체적 유량 및 총 손실을 실시간으로 측정하는 무선 전자 패치를 개발했다고 6일 밝혔다.
이 기술은 미국 노스웨스턴대 존 로저스 교수, 보스턴 소재 웨어리파이(Wearifi)사와 특허 출원 진행 중이며, 해당 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 지난 3월 말 발표됐다. (논문명 : An on-skin platform for wireless monitoring of flow rate, cumulative loss and temperature of sweat in real time)
땀은 비침습적으로 수집할 수 있는 생체 유체로, 침습적인 혈액 채취와 비교해 채취하기가 쉽다는 분명한 이점을 제공한다. 이에 일상에서 실시간으로 땀 수집 및 성분 분석을 제공할 수 있는 웨어러블 기술에 대한 수요가 증가하고 있다.
땀과 화학 시약의 변색 반응을 이용해 다양한 생체 지표 수집이 가능하지만, 정확한 측정(발색)을 하려면 땀의 유량과 총 손실을 실시간으로 측정하는 것이 핵심적으로 요구된다. 이에 연구팀은 땀의 정량적 속도 및 체적 측정이 가능한 웨어러블 무선 전자 패치를 개발했고, 변색 반응을 이용해 땀 성분 분석이 가능한 미세 유체 시스템과 통합했다.
그 결과, 연구팀은 땀 내 염화물, 포도당 및 크레아틴 농도, 수소이온지수(pH) 및 체적 유량을 동시에 측정하는 데 최초로 성공했다. 측정한 지표는 낭포성 섬유증, 당뇨병, 신장 기능 장애, 대사성 알칼리증 진단 등에 활용할 수 있다.
연구팀은 땀이 수집되는 짧고 정교한 미세 유체 채널 외벽에 저전력 열원을 배치해 채널을 통과하는 땀과 열 교환을 유도했다. 땀의 유속이 증가함에 따라 열원의 하류와 상류의 온도 차이가 증가하는 것에 착안, 상·하류 온도 차이와 땀의 배출 속도 간의 정확한 관계를 규명했다. 그 결과, 생리학적으로 유의미하다고 인정되는 0~5마이크로리터/분(μl/min) 범위의 땀 속도를 정확하게 측정하는 데 성공했다. 웨어러블 패치로 측정한 데이터는 블루투스 통신이 가능한 스마트폰 앱을 통해 실시간 확인이 가능하다.
이 패치는 미세 유체 채널을 통과하는 땀과 전자 회로가 완전히 분리되어, 기존 유속 측정 기기들의 유체와의 접촉으로 인한 부식 및 노후화에 취약하다는 단점을 극복했다. 또한, 얇고 유연한 회로 기판 인쇄 기법과 신축성 있는 실리콘 봉합 기술을 접목해 다양한 굴곡을 가진 피부 위에 편안하게 부착할 수 있도록 제작됐다. 땀 배출로 인한 피부 온도 변화를 실시간으로 감지하는 센서도 부착돼 있어 다양한 응용 분야에서 활용이 기대된다.
권경하 교수는 "개발된 무선 전자 패치는 개인별 수분 보충 전략, 탈수 증세 감지 및 기타 건강 관리에 폭넓게 활용할 수 있다ˮ면서 "피부 표면 근처의 혈관에서 혈류 속도를 측정하거나, 약물의 방출 속도를 실시간으로 측정해 정확한 투여량을 계산하는 등 체계화된 약물 전달 시스템에도 활용할 수 있을 것ˮ이라고 말했다.
한편, 이번 연구는 한국연구재단의 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
2021.05.06
조회수 29411
-
 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25
조회수 32231
 맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 4900
맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 4900 장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 7862
장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 7862 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 9381
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 9381 약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
2023.07.18 조회수 8676
약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
2023.07.18 조회수 8676 인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2023.03.16 조회수 8373
인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2023.03.16 조회수 8373 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 8898
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 8898 인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
2022.08.12 조회수 10522
인공지능 기반 약물 가상 스크리닝 기술로 신규 항암 치료제 발굴 성공
우리 대학 생명과학과 김세윤 교수 연구팀이 `약물 가상 스크리닝 기술을 이용한 신규 항암 치료제 개발'에 성공했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지인 `세포 사멸과 질병(Cell Death & Disease)'에 지난 7월 12일 字 온라인 게재됐다.
※ 논문명 : Lomitapide, a cholesterol-lowering drug, is an anticancer agent that induces autophagic cell death via inhibiting mTOR
※ 저자 정보 : 이보아 (한국과학기술원, 공동 제1 저자), 박승주 (한국과학기술원, 공동 제1 저자), 이슬기 (한국과학기술원, 제2 저자), 오병철 (가천대학교 의과대학, 공동 저자), 정원석 (한국과학기술원, 공동 저자), 손종우 (한국과학기술원, 공동 저자), 김세윤 (한국과학기술원, 교신저자), 포함 총 10명
`엠토르(mTOR)'라고 알려진 신호전달 단백질은 많은 암세포에서 활성이 비정상적으로 높아져 있으며 또한 암뿐만 아니라 당뇨, 염증 및 노화와 같은 다양한 질병에서 핵심적인 역할을 한다. 특히 암을 유발하는 다양한 신호전달 경로가 엠토르 단백질을 통해 매개되기 때문에 많은 제약사에서 항암 치료제 개발의 목적으로 엠토르 저해제 개발에 많은 투자를 하고 있다.
자가포식(autophagy, 오토파지)으로 알려진 생명 현상은 세포 내 엠토르 단백질에 의해 활성 조절이 정교하게 매개되는 것으로 잘 알려져 있다. 자가포식이란 `세포가 자기 살을 먹는다'는 의미로, 영양분이 과도하게 부족하거나 세포 내외적 스트레스 조건에 처한 경우, 세포가 스스로 내부 구성물질들을 파괴해 활용함으로써 세포 내 항상성을 유지하는 일종의 방어기전이다.
이러한 자가포식 활성의 조절은 양날의 칼과 같이 작용하는 것으로 알려져 있으며, 이는 암, 당뇨와 같은 질환의 발생 및 치료에 이용 가능하다고 주목받고 있다. 암세포에 과도하게 활성화돼있는 엠토르 단백질의 활성을 저해하면 자가포식을 과도하게 증가시킬 수 있으며 이를 통해 암세포의 세포 사멸이 유도될 수 있다는 사실이 알려져 있으며 이를 바탕으로 자가포식 강화에 기반한 항암제 약물의 개발전략이 제시되고 있다.
이에 김세윤 교수 연구팀은 단백질의 3차원적 구조를 활용해 화합물과 표적 단백질 사이의 물리적 상호작용을 모델링하는 유효 결합 판별 기술에 기반한 약물 재창출 전략으로 엠토르 억제성 항암제 개발 연구를 수행했다.
약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물군을 대상으로 새로운 적응증을 찾는 신약 개발 방식이다. 이 전략은 전통적으로 10년 이상 소요되는 신약 개발의 막대한 시간과 투자를 혁신적으로 단축할 수 있는 미래 시대 신약 개발전략이다.
연구팀은 FDA 승인 약물 또는 임상 시험 중인 약물에 기반한 데이터베이스를 통해 3,391종의 약물 라이브러리를 활용했다. 라이브러리의 모든 약물을 실험적으로 검증하기에는 연구비용과 시간이 많이 소요되므로, 3차 구조 모델링을 통한 유효 결합 판별 기술을 적용해 엠토르 활성 저해능력을 보이는 약물만 신속하게 스크리닝했다.
연구팀은 엠토르 단백질의 활성을 담당하는 효소 활성부위의 3차 구조 분석과 인공지능 기반 유효 결합 판별 기술을 도입해 후보 물질 발굴의 정확도와 예측도를 높이는 데 성공했다. 그리고 3차 구조를 타깃으로 약물 결합 분석 모듈을 도입해 가상 스크리닝의 정확도와 예측도를 높이는 데 성공했다. 이번 연구를 통해 개발된 기술의 가장 큰 특징은 타깃 단백질과 약물 간의 3차 구조 정보를 이용해 많은 양의 후보 성분들을 빠르고 정확하게 분석하고 결합 여부를 예측할 수 있는 것이다.
우리 대학 생명과학과 이보아 박사, 박승주 박사는 현재 가족성 고콜레스테롤혈증(familial hypercholesterolemia) 치료제로서 임상에서 판매, 활용되고 있는 로미타피드(lomitapide) 약물의 엠토르 활성 억제 가능성을 예측했다. 연구팀은 생화학적 및 세포 생물학적 분석을 통해 로미타피드에 의한 엠토르 효소활성의 억제효능을 검증하는 데 성공했다. 대장암, 피부암 등의 암세포에 로미타피드를 처리할 경우, 암세포의 엠토르 활성이 효과적으로 억제되고 이후 과도한 자가포식이 유도됨으로써 암세포 사멸효과가 발생함을 다각적으로 확인해 로미타피드의 항암 효능을 확립했다.
또한 대장암 환자로부터 유래한 암 오가노이드(organoid)에 로미타피드를 처리할 경우, 기존의 화학 항암 치료제 대비 우수한 암세포 사멸 능력을 보였다. 나아가 최근 차세대 고형암 치료용 항암 전략으로 주목받고 있는 면역관문억제제(immune checkpoint inhibitor)와 로미티피드를 병행할 경우, 면역관문억제제의 단독 처리 대비 비약적으로 개선된 시너지 항암효과를 나타냄을 동물모델 연구를 통해 검증하는 데 성공했다.
연구팀이 발굴한 로미타피드의 항암 효능 성과는 향후 엠토르 억제 및 자가포식 기반 항암제 개발 및 임상적 활용에 적극 활용될 것으로 기대된다.
이러한 연구성과는 벤처창업으로 연계돼 이보아 박사, 박승주 박사, 이슬기 박사는 인공지능 기반 신약개발 전문기업 `에아스텍'을 공동창업했으며 중소벤처기업부 팁스(TIPS) 창업지원 프로그램에 선정되는 등 활발한 연구개발을 수행하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 선도연구센터, 창의도전연구사업 및 KAIX 포스트닥펠로사업의 지원을 받아 수행됐다.
2022.08.12 조회수 10522 실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 14316
실제 약물로 개발되는 단백질-리간드 상호작용 예측 인공지능 모델 개발
우리 대학 연구진이 물리화학적 아이디어를 인공지능 딥러닝에 접목해 기존의 방법보다 일반화 성능이 높은 단백질-리간드 상호작용 예측 모델을 개발했다. 리간드란 수용체와 같은 큰 생체 분자에 특이적으로 결합하는 물질을 말하며, 생체 내의 중요한 요소이자 의약품의 개발 등에 큰 역할을 한다.
화학과 김우연 교수 연구팀이 교원창업 인공지능 신약 개발 스타트업 HITS 연구진과 함께 물리 기반 삼차원 그래프 심층 신경망을 이용해 일반화 성능을 높인 단백질-리간드 상호작용 예측 모델을 개발했다고 17일 밝혔다.
약물 후보 분자를 발굴하기 위해서 타깃 단백질과 강하게 결합하는 리간드를 찾는 것이 중요하다. 하지만 유효 물질을 찾기 위해 수백만에서 수천만 개의 무작위 리간드 라이브러리를 대상으로 실험 전수 조사를 수행하는 것은 천문학적인 시간과 비용이 필요하다. 이러한 시간과 비용을 절감하기 위해 최근 단백질-리간드 상호작용 예측에 기반한 가상탐색(virtual screening) 기술이 주목받고 있다.
기존의 상호작용 예측 인공지능 모델들은 학습에 사용한 구조에 대해서는 높은 예측 성능을 보여주지만, 새로운 단백질 구조에 대해서는 낮은 성능을 보이는 과적합(over-fitting)이 문제가 됐다. 과적합 문제는 일반적으로 모델의 복잡도에 비해 데이터가 적을 때 발생한다. 이번 연구는 이러한 과적합 문제를 해결함으로써 다양한 단백질에 대해 고른 성능을 보여주는 예측 모델을 개발하는데 주안점을 뒀다.
연구진은 물리화학적 아이디어들을 딥러닝 모델에 적용해 모델의 복잡도를 줄임과 동시에 물리 시뮬레이션을 통해 부족한 데이터를 보강함으로써 과적합 문제를 해결하고자 하였다. 단백질 원자와 리간드 원자 사이의 거리에 따른 반데르발스 힘, 수소 결합력 등을 물리화학적 방정식으로 모델링하고, 매개변수를 딥러닝으로 예측함으로써 물리 법칙을 만족하는 예측을 가능하게 했다.
또한, 학습에 사용한 단백질-리간드 결정 구조가 실험적으로 판명된 가장 안정한 구조임에 착안했다. 부족한 실험 데이터를 보강하기 위해 불안정한 단백질-리간드 구조로 이루어진 수십만 개의 인공 데이터를 생성해 학습에 활용했고, 그 결과 생성된 구조에 비해 실제 구조를 안정하게 예측하도록 모델을 학습할 수 있었다.
연구진은 개발된 모델의 성능을 검증하기 위해 대조군으로 `CASF-2016 벤치마크'를 활용했다. 이 벤치마크는 다양한 단백질-리간드 구조들 사이에서 실험적으로 판명된 결정 구조에 근접한 구조를 찾는 도킹과 상대적으로 결합력이 큰 단백질-리간드 쌍을 찾는 스크리닝 등 실제 약물을 개발하는 과정에 필수적인 과제를 포함하고 있다. 검증 테스트 결과 기존에 보고된 기술에 비해 높은 도킹 및 스크리닝 성공률을 보여줬으며, 특히 스크리닝 성능은 기존에 보고된 최고 성능 대비 약 두 배 높은 수치를 보였다.
연구진이 개발한 물리 기반 딥러닝 방법론의 또 다른 장점은 예측의 결과를 물리적으로 해석 가능하다는 것이다. 이는 딥러닝으로 최적화된 물리화학 식을 통해 최종 상호작용 값을 예측하기 때문이다. 리간드 분자 내 원자별 상호작용 에너지의 기여도를 분석함으로써 어떤 작용기가 단백질-리간드 결합에 있어서 중요한 역할을 했는지 파악할 수 있으며, 이와 같은 정보는 추후 약물 설계를 통해 성능을 높이는 데 직접 활용할 수 있다.
공동 제1 저자로 참여한 화학과 문석현, 정원호, 양수정(현재 MIT 박사과정) 박사과정 학생들은 "데이터가 적은 화학 및 바이오 분야에서 일반화 문제는 항상 중요한 문제로 강조돼왔다ˮ며 "이번 연구에서 사용한 물리 기반 딥러닝 방법론은 단백질-리간드 간 상호작용 예측 뿐 아니라 다양한 물리 문제에 적용될 수 있을 것ˮ이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 `Chemical Science(IF=9.825)' 2022년 4월 13호에 표지 논문 및 `금주의 논문(Pick of the Week)'으로 선정됐다. (논문명 : PIGNet: a physics-informed deep learning model toward generalized drug–target interaction predictions, 논문 링크 : https://doi.org/10.1039/D1SC06946B)
2022.05.17 조회수 14316 위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 15630
위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 15630 약물 가상 스크리닝 기술로 코로나19 치료제 후보 발굴
우리 대학 생명화학공학과 이상엽 특훈교수(연구부총장)와 한국파스퇴르연구소 김승택 박사 공동연구팀이 ‘약물 가상 스크리닝 기술을 이용한 코로나19 치료제 개발’에 성공했다고 8일 밝혔다.
이번 연구 결과는 국제 학술지인 ‘미국국립과학원회보(PNAS)'에 7월 7일 字 온라인 게재됐다.
※ 논문명 : Drugs repurposed for COVID-19 by virtual screening of 6,218 drugs and cell-based assay
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김승택(한국파스퇴르연구소, 교신저자), 장우대(한국과학기술원, 제1저자), 전상은(한국파스퇴르연구소, 제2저자), 포함 총 4명
코로나바이러스감염증-19(이하 코로나19)는 글로벌 팬데믹으로 전개되고 있으며 현재 인류 보건을 심각하게 위협하는 상황이다. 코로나19 치료 목적으로 미국식품의약국(FDA)에서 정식 승인을 받은 렘데시비르(상품명 베클러리)가 현재 임상에서 사용 중이지만, 사망률은 감소시키지 못하고 회복 기간을 5일 정도 단축함으로써 치료 효과가 기대에 미치지 못하는 것으로 알려졌다. 또한 렘데시비르는 정맥 주사제여서 의료기관에서 입원을 통해 수일 동안 투여받아야 하므로 팬데믹 상황에 적합하지 않은 약물이다. 따라서 코로나19로 인한 사망률을 획기적으로 감소시키고, 치료 기간을 단축시키는 경구용 치료제 개발이 시급한 상황이었다.
이에 이상엽 특훈교수와 한국파스퇴르연구소 김승택 박사 공동연구팀은 약물 가상 스크리닝 기술을 이용한 약물 재창출 전략으로 코로나19 치료제 개발 연구를 수행했다.
연구팀은 팬데믹 상황에 대응한 신속한 치료제 개발을 위해 가상 스크리닝 기술을 이용한 약물 재창출 전략을 수립했다. 약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물을 대상으로 새로운 적응증을 찾는 방식이다. 이 전략은 신약 개발 과정에 소요되는 시간을 단축시킬 수 있어 코로나19와 같은 팬데믹 상황에 적합한 신약 개발 전략이다.
우리 대학 생명화학공학과 장우대 박사는 우선 FDA 승인 약물 또는 임상 진행 중인 약물을 데이터베이스에서 수집해 6,218종의 약물 가상 라이브러리를 구축했다. 실험으로 이 약물들을 모두 검증하기에는 시간과 비용이 많이 소요되기 때문에 바이러스 치료제로 가능성이 있는 약물만 신속하게 선별할 수 있는 컴퓨터 기반 가상 스크리닝 기술을 도입했다.
기존의 도킹 시뮬레이션 기반의 가상 스크리닝 기술은 높은 위양성률(false positive rate)로 인해 유효물질 도출 비율(hit rate)이 매우 낮은 것이 문제점인 상황이었다. 연구팀은 구조 유사도 분석 모듈과 상호작용 유사도 분석 모듈을 도킹 전후에 도입하여 가상 스크리닝의 정확도를 높이는 데 성공했다. 이번 연구를 통해 개발된 가상 스크리닝 기술은 단백질-약물 복합체 구조 정보를 이용하여 다양한 후보 약물을 빠르고 정확하게 스크리닝할 수 있는 것이 특징이다.
연구팀은 또한 바이러스 치료제로 주로 사용되는 핵산 유사체(nucleotide analogues) 기반 전구약물(prodrug)의 활성형 구조를 자동으로 생성하는 알고리즘을 개발했다. 전구약물은 그 자체로는 약효가 없고 체내 대사를 통해 활성형 구조로 변환되어야만 약효를 나타낸다. 따라서 전구약물은 활성형으로 구조변환 후, 도킹 시뮬레이션을 수행하는 것이 중요하다. 연구팀은 렘데시비르를 포함한 여러 핵산유사체 기반 전구약물들의 활성형 구조를 자동으로 생성하는 데 성공하였고, 도킹 시뮬레이션의 정확도를 향상시킬 수 있었다.
연구팀은 가상 스크리닝 플랫폼으로 사스-코로나바이러스-2(SARS-CoV-2)의 복제와 증식에 필수적인 역할을 하는 단백질 가수분해 효소(3CL hydrolase, Mpro)와 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 저해할 수 있는 후보 화합물을 15종과 23종으로 각각 선별했다.
그 후, 가상 스크리닝으로 선별된 38종의 약물에 대해 한국파스퇴르연구소의 생물안전 3등급(BSL-3) 실험실에서 세포 이미지 기반 항바이러스 활성 분석 플랫폼을 활용해 약효를 검증했다.
먼저 사스-코로나바이러스-2를 감염시킨 원숭이 신장세포(Vero cell)를 이용한 시험관 내(in vitro) 실험을 수행한 결과, 38종의 약물 중 7종의 약물에서 항바이러스 활성이 확인됐다.
또한, 검증된 7종의 약물에 대해 인간 폐 세포(Calu-3 cell)에서 추가적인 검증 실험을 수행했고, 3종의 약물에서 항바이러스 활성이 확인됐다. 후보 약물에는 암 및 특발성 폐섬유증(idiopathic pulmonary fibrosis)으로 임상이 진행 중인 오미팔리십(omipalisib), 암 및 조로증(progeria)으로 임상이 진행 중인 티피파닙(tipifarnib), 식물 추출물로써 항암제로 임상이 진행 중인 에모딘(emodin)이 있다. 특히 오미팔리십은 현재 코로나19 표준 치료제인 렘데시비르 대비 항바이러스 활성이 약 200배 이상 높은 것으로 확인됐고, 티피파닙은 렘데시비르와 유사한 수준으로 항바이러스 활성이 확인됐다.
세포 수준에서 항바이러스 효과가 확인된 약물은 바이러스 감염 동물모델을 이용한 전임상시험이 필요하다. 이에 연구팀은 과기정통부의 코로나 치료제 전임상 지원사업을 통해 후보 약물 중 하나의 약물에 대해 약효를 평가했다. 그러나 이 과정에서 동물에 대한 약물 독성이 나타났다. 약물의 독성을 최소화하면서 치료 유효 농도에 도달할 수 있는 최적의 약물 농도를 찾기 위해 추가적인 전임상시험을 진행할 예정이다. 또한, 나머지 후보 약물들에 대해서도 전임상시험을 계획 중이다.
연구팀 관계자는 이번 연구를 통해 예측 성능이 우수한 약물 가상 스크리닝 플랫폼을 구축했고, 이를 통해 코로나19 치료제로 유망한 후보물질을 단기간에 발견할 수 있었다고 설명했다.
이상엽 특훈교수는 “이번 연구를 통해 신종 바이러스 출현 시 신속하게 대응할 수 있는 기반 기술을 마련했다는 데에 의의가 있으며, 이를 통해 향후 코로나바이러스 계열의 유사한 바이러스나 신종 바이러스 출현 시에도 적용할 수 있는 기술을 개발하고자 한다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2021.07.08 조회수 16320
약물 가상 스크리닝 기술로 코로나19 치료제 후보 발굴
우리 대학 생명화학공학과 이상엽 특훈교수(연구부총장)와 한국파스퇴르연구소 김승택 박사 공동연구팀이 ‘약물 가상 스크리닝 기술을 이용한 코로나19 치료제 개발’에 성공했다고 8일 밝혔다.
이번 연구 결과는 국제 학술지인 ‘미국국립과학원회보(PNAS)'에 7월 7일 字 온라인 게재됐다.
※ 논문명 : Drugs repurposed for COVID-19 by virtual screening of 6,218 drugs and cell-based assay
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김승택(한국파스퇴르연구소, 교신저자), 장우대(한국과학기술원, 제1저자), 전상은(한국파스퇴르연구소, 제2저자), 포함 총 4명
코로나바이러스감염증-19(이하 코로나19)는 글로벌 팬데믹으로 전개되고 있으며 현재 인류 보건을 심각하게 위협하는 상황이다. 코로나19 치료 목적으로 미국식품의약국(FDA)에서 정식 승인을 받은 렘데시비르(상품명 베클러리)가 현재 임상에서 사용 중이지만, 사망률은 감소시키지 못하고 회복 기간을 5일 정도 단축함으로써 치료 효과가 기대에 미치지 못하는 것으로 알려졌다. 또한 렘데시비르는 정맥 주사제여서 의료기관에서 입원을 통해 수일 동안 투여받아야 하므로 팬데믹 상황에 적합하지 않은 약물이다. 따라서 코로나19로 인한 사망률을 획기적으로 감소시키고, 치료 기간을 단축시키는 경구용 치료제 개발이 시급한 상황이었다.
이에 이상엽 특훈교수와 한국파스퇴르연구소 김승택 박사 공동연구팀은 약물 가상 스크리닝 기술을 이용한 약물 재창출 전략으로 코로나19 치료제 개발 연구를 수행했다.
연구팀은 팬데믹 상황에 대응한 신속한 치료제 개발을 위해 가상 스크리닝 기술을 이용한 약물 재창출 전략을 수립했다. 약물 재창출은 이미 안전성이 검증된 FDA 승인 약물 또는 임상 진행 중인 약물을 대상으로 새로운 적응증을 찾는 방식이다. 이 전략은 신약 개발 과정에 소요되는 시간을 단축시킬 수 있어 코로나19와 같은 팬데믹 상황에 적합한 신약 개발 전략이다.
우리 대학 생명화학공학과 장우대 박사는 우선 FDA 승인 약물 또는 임상 진행 중인 약물을 데이터베이스에서 수집해 6,218종의 약물 가상 라이브러리를 구축했다. 실험으로 이 약물들을 모두 검증하기에는 시간과 비용이 많이 소요되기 때문에 바이러스 치료제로 가능성이 있는 약물만 신속하게 선별할 수 있는 컴퓨터 기반 가상 스크리닝 기술을 도입했다.
기존의 도킹 시뮬레이션 기반의 가상 스크리닝 기술은 높은 위양성률(false positive rate)로 인해 유효물질 도출 비율(hit rate)이 매우 낮은 것이 문제점인 상황이었다. 연구팀은 구조 유사도 분석 모듈과 상호작용 유사도 분석 모듈을 도킹 전후에 도입하여 가상 스크리닝의 정확도를 높이는 데 성공했다. 이번 연구를 통해 개발된 가상 스크리닝 기술은 단백질-약물 복합체 구조 정보를 이용하여 다양한 후보 약물을 빠르고 정확하게 스크리닝할 수 있는 것이 특징이다.
연구팀은 또한 바이러스 치료제로 주로 사용되는 핵산 유사체(nucleotide analogues) 기반 전구약물(prodrug)의 활성형 구조를 자동으로 생성하는 알고리즘을 개발했다. 전구약물은 그 자체로는 약효가 없고 체내 대사를 통해 활성형 구조로 변환되어야만 약효를 나타낸다. 따라서 전구약물은 활성형으로 구조변환 후, 도킹 시뮬레이션을 수행하는 것이 중요하다. 연구팀은 렘데시비르를 포함한 여러 핵산유사체 기반 전구약물들의 활성형 구조를 자동으로 생성하는 데 성공하였고, 도킹 시뮬레이션의 정확도를 향상시킬 수 있었다.
연구팀은 가상 스크리닝 플랫폼으로 사스-코로나바이러스-2(SARS-CoV-2)의 복제와 증식에 필수적인 역할을 하는 단백질 가수분해 효소(3CL hydrolase, Mpro)와 RNA 중합효소(RNA-dependent RNA polymerase, RdRp)를 저해할 수 있는 후보 화합물을 15종과 23종으로 각각 선별했다.
그 후, 가상 스크리닝으로 선별된 38종의 약물에 대해 한국파스퇴르연구소의 생물안전 3등급(BSL-3) 실험실에서 세포 이미지 기반 항바이러스 활성 분석 플랫폼을 활용해 약효를 검증했다.
먼저 사스-코로나바이러스-2를 감염시킨 원숭이 신장세포(Vero cell)를 이용한 시험관 내(in vitro) 실험을 수행한 결과, 38종의 약물 중 7종의 약물에서 항바이러스 활성이 확인됐다.
또한, 검증된 7종의 약물에 대해 인간 폐 세포(Calu-3 cell)에서 추가적인 검증 실험을 수행했고, 3종의 약물에서 항바이러스 활성이 확인됐다. 후보 약물에는 암 및 특발성 폐섬유증(idiopathic pulmonary fibrosis)으로 임상이 진행 중인 오미팔리십(omipalisib), 암 및 조로증(progeria)으로 임상이 진행 중인 티피파닙(tipifarnib), 식물 추출물로써 항암제로 임상이 진행 중인 에모딘(emodin)이 있다. 특히 오미팔리십은 현재 코로나19 표준 치료제인 렘데시비르 대비 항바이러스 활성이 약 200배 이상 높은 것으로 확인됐고, 티피파닙은 렘데시비르와 유사한 수준으로 항바이러스 활성이 확인됐다.
세포 수준에서 항바이러스 효과가 확인된 약물은 바이러스 감염 동물모델을 이용한 전임상시험이 필요하다. 이에 연구팀은 과기정통부의 코로나 치료제 전임상 지원사업을 통해 후보 약물 중 하나의 약물에 대해 약효를 평가했다. 그러나 이 과정에서 동물에 대한 약물 독성이 나타났다. 약물의 독성을 최소화하면서 치료 유효 농도에 도달할 수 있는 최적의 약물 농도를 찾기 위해 추가적인 전임상시험을 진행할 예정이다. 또한, 나머지 후보 약물들에 대해서도 전임상시험을 계획 중이다.
연구팀 관계자는 이번 연구를 통해 예측 성능이 우수한 약물 가상 스크리닝 플랫폼을 구축했고, 이를 통해 코로나19 치료제로 유망한 후보물질을 단기간에 발견할 수 있었다고 설명했다.
이상엽 특훈교수는 “이번 연구를 통해 신종 바이러스 출현 시 신속하게 대응할 수 있는 기반 기술을 마련했다는 데에 의의가 있으며, 이를 통해 향후 코로나바이러스 계열의 유사한 바이러스나 신종 바이러스 출현 시에도 적용할 수 있는 기술을 개발하고자 한다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2021.07.08 조회수 16320 땀 검사로 건강 상태를 진단할 수 있는 전자소자 개발
우리 대학 전기및전자공학부 권경하 교수 연구팀이 성균관대학교 화학공학과 김종욱 박사과정 연구원(지도교수:김태일 교수, 성균관대학교 화학공학/고분자 공학부)과 땀의 체적 유량 및 총 손실을 실시간으로 측정하는 무선 전자 패치를 개발했다고 6일 밝혔다.
이 기술은 미국 노스웨스턴대 존 로저스 교수, 보스턴 소재 웨어리파이(Wearifi)사와 특허 출원 진행 중이며, 해당 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 지난 3월 말 발표됐다. (논문명 : An on-skin platform for wireless monitoring of flow rate, cumulative loss and temperature of sweat in real time)
땀은 비침습적으로 수집할 수 있는 생체 유체로, 침습적인 혈액 채취와 비교해 채취하기가 쉽다는 분명한 이점을 제공한다. 이에 일상에서 실시간으로 땀 수집 및 성분 분석을 제공할 수 있는 웨어러블 기술에 대한 수요가 증가하고 있다.
땀과 화학 시약의 변색 반응을 이용해 다양한 생체 지표 수집이 가능하지만, 정확한 측정(발색)을 하려면 땀의 유량과 총 손실을 실시간으로 측정하는 것이 핵심적으로 요구된다. 이에 연구팀은 땀의 정량적 속도 및 체적 측정이 가능한 웨어러블 무선 전자 패치를 개발했고, 변색 반응을 이용해 땀 성분 분석이 가능한 미세 유체 시스템과 통합했다.
그 결과, 연구팀은 땀 내 염화물, 포도당 및 크레아틴 농도, 수소이온지수(pH) 및 체적 유량을 동시에 측정하는 데 최초로 성공했다. 측정한 지표는 낭포성 섬유증, 당뇨병, 신장 기능 장애, 대사성 알칼리증 진단 등에 활용할 수 있다.
연구팀은 땀이 수집되는 짧고 정교한 미세 유체 채널 외벽에 저전력 열원을 배치해 채널을 통과하는 땀과 열 교환을 유도했다. 땀의 유속이 증가함에 따라 열원의 하류와 상류의 온도 차이가 증가하는 것에 착안, 상·하류 온도 차이와 땀의 배출 속도 간의 정확한 관계를 규명했다. 그 결과, 생리학적으로 유의미하다고 인정되는 0~5마이크로리터/분(μl/min) 범위의 땀 속도를 정확하게 측정하는 데 성공했다. 웨어러블 패치로 측정한 데이터는 블루투스 통신이 가능한 스마트폰 앱을 통해 실시간 확인이 가능하다.
이 패치는 미세 유체 채널을 통과하는 땀과 전자 회로가 완전히 분리되어, 기존 유속 측정 기기들의 유체와의 접촉으로 인한 부식 및 노후화에 취약하다는 단점을 극복했다. 또한, 얇고 유연한 회로 기판 인쇄 기법과 신축성 있는 실리콘 봉합 기술을 접목해 다양한 굴곡을 가진 피부 위에 편안하게 부착할 수 있도록 제작됐다. 땀 배출로 인한 피부 온도 변화를 실시간으로 감지하는 센서도 부착돼 있어 다양한 응용 분야에서 활용이 기대된다.
권경하 교수는 "개발된 무선 전자 패치는 개인별 수분 보충 전략, 탈수 증세 감지 및 기타 건강 관리에 폭넓게 활용할 수 있다ˮ면서 "피부 표면 근처의 혈관에서 혈류 속도를 측정하거나, 약물의 방출 속도를 실시간으로 측정해 정확한 투여량을 계산하는 등 체계화된 약물 전달 시스템에도 활용할 수 있을 것ˮ이라고 말했다.
한편, 이번 연구는 한국연구재단의 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
2021.05.06 조회수 29411
땀 검사로 건강 상태를 진단할 수 있는 전자소자 개발
우리 대학 전기및전자공학부 권경하 교수 연구팀이 성균관대학교 화학공학과 김종욱 박사과정 연구원(지도교수:김태일 교수, 성균관대학교 화학공학/고분자 공학부)과 땀의 체적 유량 및 총 손실을 실시간으로 측정하는 무선 전자 패치를 개발했다고 6일 밝혔다.
이 기술은 미국 노스웨스턴대 존 로저스 교수, 보스턴 소재 웨어리파이(Wearifi)사와 특허 출원 진행 중이며, 해당 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 지난 3월 말 발표됐다. (논문명 : An on-skin platform for wireless monitoring of flow rate, cumulative loss and temperature of sweat in real time)
땀은 비침습적으로 수집할 수 있는 생체 유체로, 침습적인 혈액 채취와 비교해 채취하기가 쉽다는 분명한 이점을 제공한다. 이에 일상에서 실시간으로 땀 수집 및 성분 분석을 제공할 수 있는 웨어러블 기술에 대한 수요가 증가하고 있다.
땀과 화학 시약의 변색 반응을 이용해 다양한 생체 지표 수집이 가능하지만, 정확한 측정(발색)을 하려면 땀의 유량과 총 손실을 실시간으로 측정하는 것이 핵심적으로 요구된다. 이에 연구팀은 땀의 정량적 속도 및 체적 측정이 가능한 웨어러블 무선 전자 패치를 개발했고, 변색 반응을 이용해 땀 성분 분석이 가능한 미세 유체 시스템과 통합했다.
그 결과, 연구팀은 땀 내 염화물, 포도당 및 크레아틴 농도, 수소이온지수(pH) 및 체적 유량을 동시에 측정하는 데 최초로 성공했다. 측정한 지표는 낭포성 섬유증, 당뇨병, 신장 기능 장애, 대사성 알칼리증 진단 등에 활용할 수 있다.
연구팀은 땀이 수집되는 짧고 정교한 미세 유체 채널 외벽에 저전력 열원을 배치해 채널을 통과하는 땀과 열 교환을 유도했다. 땀의 유속이 증가함에 따라 열원의 하류와 상류의 온도 차이가 증가하는 것에 착안, 상·하류 온도 차이와 땀의 배출 속도 간의 정확한 관계를 규명했다. 그 결과, 생리학적으로 유의미하다고 인정되는 0~5마이크로리터/분(μl/min) 범위의 땀 속도를 정확하게 측정하는 데 성공했다. 웨어러블 패치로 측정한 데이터는 블루투스 통신이 가능한 스마트폰 앱을 통해 실시간 확인이 가능하다.
이 패치는 미세 유체 채널을 통과하는 땀과 전자 회로가 완전히 분리되어, 기존 유속 측정 기기들의 유체와의 접촉으로 인한 부식 및 노후화에 취약하다는 단점을 극복했다. 또한, 얇고 유연한 회로 기판 인쇄 기법과 신축성 있는 실리콘 봉합 기술을 접목해 다양한 굴곡을 가진 피부 위에 편안하게 부착할 수 있도록 제작됐다. 땀 배출로 인한 피부 온도 변화를 실시간으로 감지하는 센서도 부착돼 있어 다양한 응용 분야에서 활용이 기대된다.
권경하 교수는 "개발된 무선 전자 패치는 개인별 수분 보충 전략, 탈수 증세 감지 및 기타 건강 관리에 폭넓게 활용할 수 있다ˮ면서 "피부 표면 근처의 혈관에서 혈류 속도를 측정하거나, 약물의 방출 속도를 실시간으로 측정해 정확한 투여량을 계산하는 등 체계화된 약물 전달 시스템에도 활용할 수 있을 것ˮ이라고 말했다.
한편, 이번 연구는 한국연구재단의 뇌과학원천기술개발사업의 지원을 받아 수행됐다.
2021.05.06 조회수 29411 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 32231
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 32231