%EB%B3%91%EC%9B%90%EA%B7%A0
-
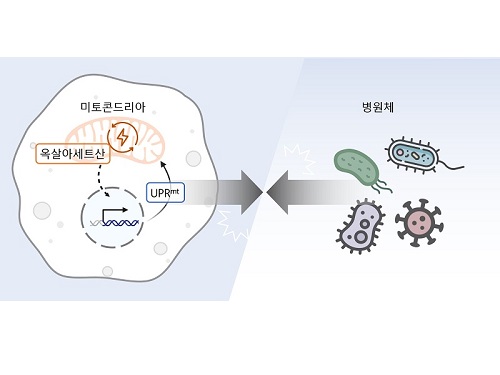 생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 2908
생체 에너지 발전소 부산물로 병원균 감염 제어
코로나 팬데믹 이후 바이러스 등 병원성 물질에 대응하는 면역력 조절의 중요성이 높아지고 있다. 사람을 포함한 동물은 외부 감염원에 대항하는 병원체 저항성이 발달해 있다. 미토콘드리아는 우리 몸 세포가 사용하는 에너지를 생성하는 발전소 역할에 더해 병원체에 저항하는 중요한 역할을 한다. 하지만 미토콘드리아가 에너지를 생성할 때 만들어지는 다양한 대사 부산물이 병원체 저항성에 어떤 역할을 하는지는 잘 알려져 있지 않다.
우리 대학 생명과학과 이승재 교수 연구팀(RNA 매개 건강장수 연구센터)이 세포 속 발전소인 미토콘드리아의 부산물을 활용해 병원체 저항성을 제어하는 방법을 찾았다고 10일 밝혔다.
이승재 교수 연구팀은 사람과 많은 유전자를 공유하여 생물학 연구에 많이 활용되는 작은 동물인 예쁜꼬마선충과 인간 세포를 활용한 연구를 수행했다. 그 결과, 세포 안에서 필요한 에너지를 만들어내는 세포 소기관인 미토콘드리아 안에서 에너지 및 대사 부산물을 형성하는 ‘TCA 회로’를 구성하는 효소인 아코니타제-2를 억제하자 개체 내 옥살아세트산 농도가 감소해 병원균 저항성이 강화된다는 사실을 밝혔다.
미토콘드리아의 TCA 회로는 포도당, 지방산, 아미노산 등 세포의 주요 에너지원을 분해하여 에너지를 만들고, 그 과정에서 각종 부산물을 생성한다. 연구진은 생성된 부산물 중 하나인 아코니타제-2의 억제로 줄어든 옥살아세트산이 미토콘드리아가 손상되었을 때 생기는 스트레스 반응인 미토콘드리아 미접힘 단백질 반응 (Mitochondrial unfolded protein response, UPRmt)을 활성화해 병원균 저항성을 강화함을 발견했다. 이러한 현상은 인간의 세포에서도 마찬가지여서 아코니타제-2 및 옥살아세트산의 저하에 의한 병원균 저항성 향상 효과가 예쁜꼬마선충부터 포유류까지 보존되어 있음을 입증했다.
아코니타제-2는 미토콘드리아 기능에 필수적인 효소로, 이를 억제하는 것은 미토콘드리아 손상과 암을 포함한 심각한 질환을 유발하기도 한다. 그러나 이번 연구에서 연구진들은 아코니타제-2의 기능을 적절히 감소시키면 예쁜꼬마선충의 장수를 유도하고 병원균에 대한 저항성을 증진하는 등 긍정적인 효과가 있음을 보고했다. 이는 미토콘드리아 아코니타제가 병원균 저항성을 조절하는 치료제의 새로운 표적이 될 수 있다는 가능성을 제시한다.
이번 연구는 또한 미토콘드리아가 세포 내 발전소로서 에너지를 형성할 뿐 아니라 그 과정에서 생기는 부산물인 옥살아세트산이 병원균 저항성을 조절함을 밝혀 완전히 새로운 방법으로 세포 면역을 조절할 수 있음을 제시하였기에 의의가 크다.
우리 대학 생명과학과 김은아 박사, 이유진 박사, 박혜은 박사와 함석진 박사가 공동 제1 저자로 참여한 이번 연구는 세계적 석학인 아담 안테비 박사 (Adam Antebi, 독일 막스플랑크 연구소) 연구팀과의 공동연구로 진행됐으며, 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 지난 6월 22일 출판됐다.
한편 이번 연구는 한국연구재단 리더연구과제에서 지원을 받았다.
(논문명: Mitochondrial aconitase suppresses immunity by modulating oxaloacetate and the mitochondrial unfolded protein response)
2023.07.11 조회수 2908 -
 인공지능 이용해 3차원 홀로그래피 현미경의 박테리아 신속 식별 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 홀로그래피 현미경과 인공지능을 이용한 신속 박테리아 병원균 식별 기술을 개발했다고 27일 밝혔다.
병원균의 조기 식별은 감염질환 치료에 필수적이다. 치명적인 상태로 진행되기 전에 감염균에 맞는 효과적인 항생제의 선택과 투여가 가능해지기 때문이다. 하지만 현재의 일상적 병원균 식별은 통상 수일이 소요된다. 이로 인해 감염 초기 식별 결과 없이 실증적인 처방으로 항생제를 투여하는 사례가 빈번하며, 이로 인해 패혈증의 경우 치명률이 50%에 달하며 항생제 남용으로 인한 슈퍼박테리아 문제도 발생한다.
기존 방법으로 병원균 식별이 오래 걸리는 원인은 긴 박테리아 배양 시간이다. 질량 분석기로 대표되는 식별 기술들은 일정량 이상의 박테리아 표본이 확보되어야 균종과 관련된 분자적 신호를 검출할 수 있다. 이로 인해, 환자에서 추출한 시편을 하루 이상 배양해야만 검출이 될 정도의 박테리아 개수가 확보된다.
광학 분야의 저명 학술지인 `빛: 과학과 응용(Light: Science & Applications), (IF = 17.782)'에 게재된 이번 연구(논문명: Rapid species identification of pathogenic bacteria from a minute quantity exploiting three-dimensional quantitative phase imaging and artificial neural network)에서 박용근 교수 연구팀은 3차원 홀로그래피 현미경과 인공지능 알고리즘을 활용해서 단일 세포 수준의 표본으로도 병원균의 균종을 정확히 알아낼 수 있음을 입증했다.
홀로그래피 현미경으로 측정되는 3차원 굴절률 영상 정보에 내재된 균종과 관련된 특성을 인공지능 알고리즘으로 학습해 종을 구분하는 것이 핵심 아이디어다. 연구팀은 종별로 500개 이상의 박테리아의 3차원 굴절률 영상을 측정했고, 이를 인공지능 신경망을 통해 학습시켰다.
연구팀은 개발한 방법을 이용해 주요한 혈액 감염균을 신속하게 식별함으로써 실제 진단에도 응용될 가능성을 검증했다. 구체적으로 그람 음성 및 양성, 구균 및 간균을 모두 포함한 총 19가지 균종으로 혈액 감염 사례의 90% 이상의 원인이 되는 균들이다. 한 개의 병원균 혹은 병원균 덩어리를 측정한 단일 3차원 굴절률 영상에서는 약 82.5%의 정확도로 균종 판별이 가능했다. 연구팀은 또한 여러 영상을 확보할 수 있을 때 정확도가 증가해, 7개의 박테리아 영상이 확보된다면 99.9%의 정확도를 얻을 수 있었다.
연구진의 책임자이자 논문의 교신저자인 박용근 교수는 "홀로그래피 현미경의 세포 감별 능력을 인공지능으로 극대화해 감염 진단 기술로서의 가능성을 확인한 것이 의미ˮ라고 말했다. 제1 저자인 물리학과 김건 박사과정 학생은 "100,000분의 1 수준의 표본량으로도 질량 분석기의 균종 검출률과 비슷한 정확도를 얻었고 환자 시편에서 다양한 병원균을 식별하는 플랫폼 기술이 될 것으로 기대된다ˮ라고 덧붙였다.
이번 연구는 KAIST-삼성서울병원-토모큐브 팀의 수년간의 공동 연구를 통해 진행됐다. 물리학과 박용근 교수 연구팀의 기술에 다양한 기관의 경험과 비전을 반영함으로써 완성할 수 있었다. 삼성서울병원 진단검사의학과 이남용 교수, 진단검사의학과 허희재 교수, 감염내과 정두련 교수 연구팀, 서울성모병원 진단검사의학과 유인영 교수, 분당 차병원 응급의학과 김규석 교수, 우리 대학 나노과학기술대학원 정현정 교수 등 다양한 분야와 기관이 모여, 실험적 검증을 효과적으로 진행할 수 있었다. 또한 KAIST 교원 창업 기업인 ㈜토모큐브의 3차원 홀로그래피 기술 지원도 필수적인 역할을 했다.
한편 이번 연구는 한국연구재단 창의연구사업, 과학기술일자리진흥원의 지원을 받아 수행됐다.
2022.06.27 조회수 5472
인공지능 이용해 3차원 홀로그래피 현미경의 박테리아 신속 식별 기술 개발
우리 대학 물리학과 박용근 교수 연구팀이 홀로그래피 현미경과 인공지능을 이용한 신속 박테리아 병원균 식별 기술을 개발했다고 27일 밝혔다.
병원균의 조기 식별은 감염질환 치료에 필수적이다. 치명적인 상태로 진행되기 전에 감염균에 맞는 효과적인 항생제의 선택과 투여가 가능해지기 때문이다. 하지만 현재의 일상적 병원균 식별은 통상 수일이 소요된다. 이로 인해 감염 초기 식별 결과 없이 실증적인 처방으로 항생제를 투여하는 사례가 빈번하며, 이로 인해 패혈증의 경우 치명률이 50%에 달하며 항생제 남용으로 인한 슈퍼박테리아 문제도 발생한다.
기존 방법으로 병원균 식별이 오래 걸리는 원인은 긴 박테리아 배양 시간이다. 질량 분석기로 대표되는 식별 기술들은 일정량 이상의 박테리아 표본이 확보되어야 균종과 관련된 분자적 신호를 검출할 수 있다. 이로 인해, 환자에서 추출한 시편을 하루 이상 배양해야만 검출이 될 정도의 박테리아 개수가 확보된다.
광학 분야의 저명 학술지인 `빛: 과학과 응용(Light: Science & Applications), (IF = 17.782)'에 게재된 이번 연구(논문명: Rapid species identification of pathogenic bacteria from a minute quantity exploiting three-dimensional quantitative phase imaging and artificial neural network)에서 박용근 교수 연구팀은 3차원 홀로그래피 현미경과 인공지능 알고리즘을 활용해서 단일 세포 수준의 표본으로도 병원균의 균종을 정확히 알아낼 수 있음을 입증했다.
홀로그래피 현미경으로 측정되는 3차원 굴절률 영상 정보에 내재된 균종과 관련된 특성을 인공지능 알고리즘으로 학습해 종을 구분하는 것이 핵심 아이디어다. 연구팀은 종별로 500개 이상의 박테리아의 3차원 굴절률 영상을 측정했고, 이를 인공지능 신경망을 통해 학습시켰다.
연구팀은 개발한 방법을 이용해 주요한 혈액 감염균을 신속하게 식별함으로써 실제 진단에도 응용될 가능성을 검증했다. 구체적으로 그람 음성 및 양성, 구균 및 간균을 모두 포함한 총 19가지 균종으로 혈액 감염 사례의 90% 이상의 원인이 되는 균들이다. 한 개의 병원균 혹은 병원균 덩어리를 측정한 단일 3차원 굴절률 영상에서는 약 82.5%의 정확도로 균종 판별이 가능했다. 연구팀은 또한 여러 영상을 확보할 수 있을 때 정확도가 증가해, 7개의 박테리아 영상이 확보된다면 99.9%의 정확도를 얻을 수 있었다.
연구진의 책임자이자 논문의 교신저자인 박용근 교수는 "홀로그래피 현미경의 세포 감별 능력을 인공지능으로 극대화해 감염 진단 기술로서의 가능성을 확인한 것이 의미ˮ라고 말했다. 제1 저자인 물리학과 김건 박사과정 학생은 "100,000분의 1 수준의 표본량으로도 질량 분석기의 균종 검출률과 비슷한 정확도를 얻었고 환자 시편에서 다양한 병원균을 식별하는 플랫폼 기술이 될 것으로 기대된다ˮ라고 덧붙였다.
이번 연구는 KAIST-삼성서울병원-토모큐브 팀의 수년간의 공동 연구를 통해 진행됐다. 물리학과 박용근 교수 연구팀의 기술에 다양한 기관의 경험과 비전을 반영함으로써 완성할 수 있었다. 삼성서울병원 진단검사의학과 이남용 교수, 진단검사의학과 허희재 교수, 감염내과 정두련 교수 연구팀, 서울성모병원 진단검사의학과 유인영 교수, 분당 차병원 응급의학과 김규석 교수, 우리 대학 나노과학기술대학원 정현정 교수 등 다양한 분야와 기관이 모여, 실험적 검증을 효과적으로 진행할 수 있었다. 또한 KAIST 교원 창업 기업인 ㈜토모큐브의 3차원 홀로그래피 기술 지원도 필수적인 역할을 했다.
한편 이번 연구는 한국연구재단 창의연구사업, 과학기술일자리진흥원의 지원을 받아 수행됐다.
2022.06.27 조회수 5472 -
 도파민의 성질로 박테리아 생장의 실시간 탐지 기술 개발
우리 몸의 신경전달물질인 도파민의 성질을 이용해 박테리아(병원균)를 쉽게 검출할 수 있는 기술이 우리 대학 연구진에 의해 개발됐다.
생명과학과 정현정 교수, 화학과 이해신 교수 공동연구팀이 도파민의 반응을 이용해 병원균의 생장과 항생제 내성을 광학적으로 측정하고 맨눈으로 실시간 검출하는 기술을 개발했다고 7일 밝혔다.
박테리아의 항생제 내성 문제는 현대인의 건강을 위협하는 위험요인으로 꼽히고 있다. 항생제 내성에 대한 적절한 대처가 없다면 30년 이내에 항생제 내성균에 의한 피해가 암보다 더 현대인의 수명을 줄일 수 있다는 보고서가 발표되기도 했다. 항생제 내성균의 종류가 점차 늘어나면서 미국 질병통제예방센터(CDC)는 연간 최소 200만 명 이상의 환자가 항생제 내성 병원균에 의해 발생하고 있다고 보고했다.
도파민은 대다수 생명체에서 신경전달물질로 사용되며, 산소가 존재하는 환경에서 다른 물질의 도움 없이 자체 중합반응(두 개 이상 결합해 큰 화합물이 되는 일)이 일어난다. 이렇게 중합된 도파민 고분자는 짙은 갈색을 나타내고, 다양한 물질 표면에 흡착해 층을 형성한다.
연구팀은 이러한 도파민의 성질을 이용해 병원균이 생장하는지와 항생제 내성을 갖는지를 육안과 형광으로 동시에 탐지 가능한 기술을 개발했다. 이 기술은 현재 사용되는 디스크 확산 검사나 균 배양 분석에 대비해 시간이 짧고 중합효소 연쇄 반응(PCR 검사)과 비교할 때도 전처리 과정이 필요 없는 간편한 기술이라는 점이 큰 장점이다.
우리 대학 나노과학기술대학원 석박사통합과정 이주훈 학생이 제1 저자로, 나노과학기술대학원 석박사통합과정 류제성 학생과 생명과학과 강유경 박사가 공동 저자로 참여한 이번 연구 결과는 재료과학 분야 국제학술지 `어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials, IF 16.836)'에 11월 3일 字 온라인 게재됐다. (논문명 : Polydopamine Sensors of Bacterial Hypoxia via Fluorescence Coupling)
도파민의 자체 중합반응에서는 개시제 역할을 하는 산소가 필수적인 존재다. 연구팀은 박테리아가 생장함에 따라 용액 내의 산소를 소모하는 현상을 이용, 박테리아의 생장 정도를 도파민의 중합반응과 연관 지어 관측하는 방법을 개발했다.
또 박테리아의 생장에 영향을 끼치지 않는 소재인 덱스트란으로 형광나노입자를 제조해 실험에 사용했다. 도파민의 자체 중합반응은 용액 내에 존재하는 형광나노입자 표면에 흡착하고 층을 형성해 입자의 화학적, 물리적 성질에 큰 변화를 일으키고 기존에 발생하던 강한 형광 신호를 약하게 만든다. 또한, 도파민과 나노입자가 첨가된 용액 내에서는 도파민의 산화와 자체 중합반응 때문에 용액의 색이 짙은 갈색으로 변한다.
하지만 박테리아가 용액 내에 존재하는 경우 박테리아 생장 때문에 산소가 소모돼 도파민의 자체 중합반응은 저해되고 용액의 색깔은 투명하게 유지된다. 나노입자의 형광 신호 역시 원래의 신호를 유지하게 된다.
연구팀은 이러한 현상을 박테리아의 생장 및 항생제 내성을 탐지하는데 적용할 수 있다는 점에 착안, 항생제에 내성을 가지는 `뉴 델리 메탈로-베타락타마제 1 (NDM-1)'을 발현하는 대장균(E. coli)을 대상으로 실험을 진행했다.
일반적인 대장균의 경우 카바페넴 계열의 항생제인 암피실린에 의해 생장이 크게 저해되는데, 항생제에 내성을 갖는 대장균은 생장이 잘 이뤄진다. 즉 항생제 내성을 가지는지에 따라 소모하는 산소의 양이 달라지고, 이 차이 때문에 도파민의 중합반응 여부를 육안과 광학적 측정으로 확인할 수 있다.
이렇게 살아있는 세포의 활성에 따라 일어나는 도파민의 자체 중합반응은 실제로 인체에 존재하는 다양한 `카테콜아민' 물질에서 나타나는 반응과 깊은 관련이 있다. 일례로 피부에 존재하는 카테콜아민은 자체 중합반응이 왕성하게 일어나 피부의 색에 큰 영향을 주는 멜라닌 색소를 형성하게 되는데 신경계에 존재하는 카테콜아민은 자체 중합반응이 거의 일어나지 않고 단일분자 형태로 존재하여 작용하는 것으로 알려져 있다. 연구팀은 이번 연구 결과를 향후 생체 내에서 도파민 등 카테콜아민의 역할과 작용을 다양한 생체 모델에서 밝히는 연구로 발전시킨다면 매우 흥미로운 연구 결과를 얻을 것으로 기대하고 있다.
정현정 교수는 “이번 연구는 도파민의 자체 중합반응을 생체 시스템에서 규명한 연구로 큰 의미를 가지며, 이를 박테리아 생장 및 항생제 내성의 실시간 검출에 적용할 수 있어 기존의 미생물 배양법보다 신속하게, 그리고 PCR 검사보다 간편하게 진단이 가능해 감염병 확산 예방에 크게 기여할 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업 및 KAIST 그랜드 챌린지 사업의 지원을 통해 이뤄졌다.
2020.12.07 조회수 41375
도파민의 성질로 박테리아 생장의 실시간 탐지 기술 개발
우리 몸의 신경전달물질인 도파민의 성질을 이용해 박테리아(병원균)를 쉽게 검출할 수 있는 기술이 우리 대학 연구진에 의해 개발됐다.
생명과학과 정현정 교수, 화학과 이해신 교수 공동연구팀이 도파민의 반응을 이용해 병원균의 생장과 항생제 내성을 광학적으로 측정하고 맨눈으로 실시간 검출하는 기술을 개발했다고 7일 밝혔다.
박테리아의 항생제 내성 문제는 현대인의 건강을 위협하는 위험요인으로 꼽히고 있다. 항생제 내성에 대한 적절한 대처가 없다면 30년 이내에 항생제 내성균에 의한 피해가 암보다 더 현대인의 수명을 줄일 수 있다는 보고서가 발표되기도 했다. 항생제 내성균의 종류가 점차 늘어나면서 미국 질병통제예방센터(CDC)는 연간 최소 200만 명 이상의 환자가 항생제 내성 병원균에 의해 발생하고 있다고 보고했다.
도파민은 대다수 생명체에서 신경전달물질로 사용되며, 산소가 존재하는 환경에서 다른 물질의 도움 없이 자체 중합반응(두 개 이상 결합해 큰 화합물이 되는 일)이 일어난다. 이렇게 중합된 도파민 고분자는 짙은 갈색을 나타내고, 다양한 물질 표면에 흡착해 층을 형성한다.
연구팀은 이러한 도파민의 성질을 이용해 병원균이 생장하는지와 항생제 내성을 갖는지를 육안과 형광으로 동시에 탐지 가능한 기술을 개발했다. 이 기술은 현재 사용되는 디스크 확산 검사나 균 배양 분석에 대비해 시간이 짧고 중합효소 연쇄 반응(PCR 검사)과 비교할 때도 전처리 과정이 필요 없는 간편한 기술이라는 점이 큰 장점이다.
우리 대학 나노과학기술대학원 석박사통합과정 이주훈 학생이 제1 저자로, 나노과학기술대학원 석박사통합과정 류제성 학생과 생명과학과 강유경 박사가 공동 저자로 참여한 이번 연구 결과는 재료과학 분야 국제학술지 `어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials, IF 16.836)'에 11월 3일 字 온라인 게재됐다. (논문명 : Polydopamine Sensors of Bacterial Hypoxia via Fluorescence Coupling)
도파민의 자체 중합반응에서는 개시제 역할을 하는 산소가 필수적인 존재다. 연구팀은 박테리아가 생장함에 따라 용액 내의 산소를 소모하는 현상을 이용, 박테리아의 생장 정도를 도파민의 중합반응과 연관 지어 관측하는 방법을 개발했다.
또 박테리아의 생장에 영향을 끼치지 않는 소재인 덱스트란으로 형광나노입자를 제조해 실험에 사용했다. 도파민의 자체 중합반응은 용액 내에 존재하는 형광나노입자 표면에 흡착하고 층을 형성해 입자의 화학적, 물리적 성질에 큰 변화를 일으키고 기존에 발생하던 강한 형광 신호를 약하게 만든다. 또한, 도파민과 나노입자가 첨가된 용액 내에서는 도파민의 산화와 자체 중합반응 때문에 용액의 색이 짙은 갈색으로 변한다.
하지만 박테리아가 용액 내에 존재하는 경우 박테리아 생장 때문에 산소가 소모돼 도파민의 자체 중합반응은 저해되고 용액의 색깔은 투명하게 유지된다. 나노입자의 형광 신호 역시 원래의 신호를 유지하게 된다.
연구팀은 이러한 현상을 박테리아의 생장 및 항생제 내성을 탐지하는데 적용할 수 있다는 점에 착안, 항생제에 내성을 가지는 `뉴 델리 메탈로-베타락타마제 1 (NDM-1)'을 발현하는 대장균(E. coli)을 대상으로 실험을 진행했다.
일반적인 대장균의 경우 카바페넴 계열의 항생제인 암피실린에 의해 생장이 크게 저해되는데, 항생제에 내성을 갖는 대장균은 생장이 잘 이뤄진다. 즉 항생제 내성을 가지는지에 따라 소모하는 산소의 양이 달라지고, 이 차이 때문에 도파민의 중합반응 여부를 육안과 광학적 측정으로 확인할 수 있다.
이렇게 살아있는 세포의 활성에 따라 일어나는 도파민의 자체 중합반응은 실제로 인체에 존재하는 다양한 `카테콜아민' 물질에서 나타나는 반응과 깊은 관련이 있다. 일례로 피부에 존재하는 카테콜아민은 자체 중합반응이 왕성하게 일어나 피부의 색에 큰 영향을 주는 멜라닌 색소를 형성하게 되는데 신경계에 존재하는 카테콜아민은 자체 중합반응이 거의 일어나지 않고 단일분자 형태로 존재하여 작용하는 것으로 알려져 있다. 연구팀은 이번 연구 결과를 향후 생체 내에서 도파민 등 카테콜아민의 역할과 작용을 다양한 생체 모델에서 밝히는 연구로 발전시킨다면 매우 흥미로운 연구 결과를 얻을 것으로 기대하고 있다.
정현정 교수는 “이번 연구는 도파민의 자체 중합반응을 생체 시스템에서 규명한 연구로 큰 의미를 가지며, 이를 박테리아 생장 및 항생제 내성의 실시간 검출에 적용할 수 있어 기존의 미생물 배양법보다 신속하게, 그리고 PCR 검사보다 간편하게 진단이 가능해 감염병 확산 예방에 크게 기여할 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업 및 KAIST 그랜드 챌린지 사업의 지원을 통해 이뤄졌다.
2020.12.07 조회수 41375 -
 커피링 효과로 감염성 병원균 신속 진단키트 개발
감염성 병원균을 현장에서 육안으로 신속하고 정확하게 검출할 수 있는 기술이 우리 연구진에 의해 개발됐다. 의료시설 접근이 어려운 환경에서, 그리고 분자진단(RT-PCR) 장비의 대안으로 빠른 사용과 활용이 기대된다.
우리 대학 생명과학과 정현정 교수 연구팀이 '커피링 등온 유전자 검출법(i-CoRi, isothermal coffee ring assay)' 개발에 성공했다고 16일 밝혔다.
'커피링 효과'란 사물 표면에 떨어진 커피 방울이 증발하면서 특징적인 링(ring) 모양이 생기는 효과다. 연구팀은 이 효과에서 아이디어를 얻어 상온에서 육안으로 병원균 유전자를 선택적으로 감별 및 고감도 검출이 가능한 기술을 개발했다. 이 기술은 RT-PCR 등 기존 분자진단 기술처럼 고가의 정밀한 장비가 필요한 문제점을 해소할 수 있다. 즉, 정 교수팀이 개발한 기술은 쉽고 간단한 POCT(point-of-care testing) 기술로 저가라는 게 큰 장점이다.
우리 대학 생명과학과 강유경 박사가 제1 저자로, 생명과학과 석박사통합과정 임산해, 나노과학기술대학원 석박사통합과정 류제성 학생이 공동저자로 참여한 이번 연구 결과는 바이오센서 분야 국제학술지 '바이오센서 앤 바이오일렉트로닉스(Biosensors & Bioelectronics, IF 10.257)' 9월 6일 字 온라인에 게재됐다. (논문명: Simple visualized readout of suppressed coffee ring patterns for rapid and isothermal genetic testing of antibacterial resistance)
정 교수 연구팀이 개발한 '커피링 등온 유전자 검출법'은 병원균 감염의 빠른 판별을 위해 시료를 표면에 떨어뜨려 커피링 패턴을 유도, 육안으로 관찰함으로써 병원균의 내성 종류를 선택적으로 정확하게 검출이 가능할 뿐 아니라 스마트폰 등을 이용한 모바일 진단이 가능한 기술이다.
콜로이드 용액이 기판 표면에서 증발할 때, 표면장력과 모세관 운동에 따라 미세입자들이 이를 포함하는 용액 방울 주변으로 이동해 특징적인 링 패턴을 형성한다. 연구팀은 표적 유전자 물질이 존재할 경우 미세입자와 유전자 물질의 선택적 인식에 의한 입자-핵산 물질 간 상호 응축을 유도해 링 패턴을 억제함으로써 병원균을 감별했다.
연구팀은 또 커피링 현상에 회전 환 증폭(rolling circle amplification) 기반의 등온 증폭기술을 융합했는데 융합과정에서 생성된 긴 단일 가닥의 표적 DNA 물질이 미세입자(직경 0.1~10 마이크로미터 가량) 크기로 응축되도록 효과를 극대화했다. 연구팀은 이밖에 *젭토 몰 농도 이하의 범위(sub-zeptomolar)에서도 병원균 표적 물질을 육안으로 검출하거나 스마트폰 등 모바일 장치를 통해 기록과 판독이 모두 가능한 기술을 개발했다.
☞ 젭토(zepto): 10^(-21) 을 뜻하는 접두어. 1 젭토 몰 농도는 용액 10 cc에 분자 6개가 존재하는 농도로, 기존의 현장 진단키트의 경우는 1 젭토 몰 농도의 약 1,000배 이상의 표적 물질이 존재해야 검출이 가능하다.
연구팀에서 개발한 '커피링 등온 유전자 검출' 기술은 신속하고 높은 선택성과 민감도를 지니고 있어 유전자상 2개 염기의 차이를 구별하며 별도의 분석 장비 없이 30분 이내에 항생제 내성 유전자 검출과 함께 혈청 등 복잡한 시료에서도 검출이 가능한 게 특징이다.
연구팀은 이와 함께 자동판독을 위한 진단키트로의 활용을 위해 미세입자에 의해 나타나는 공간 패턴의 이미지를 판독할 수 있는 알고리즘을 정립했고, 이를 통해 커피링 형성에 따른 감염 여부를 판별하는 데 성공했다.
정현정 교수는 "연구팀이 개발한 `커피링 등온 유전자 검출법'은 진료소나 클리닉 등에서 병상 분석을 위해서 유용하게 적용될 수 있을 것으로 기대된다ˮ면서 "현재 코로나바이러스감염증(COVID-19)을 진단하는 데 적용하기 위한 연구를 진행 중이다ˮ고 밝혔다.
이번 연구는 한국보건산업진흥원 감염병위기대응기술개발사업 및 한국연구재단의 중견연구자지원사업 지원을 통해 이뤄졌다.
2020.09.16 조회수 25905
커피링 효과로 감염성 병원균 신속 진단키트 개발
감염성 병원균을 현장에서 육안으로 신속하고 정확하게 검출할 수 있는 기술이 우리 연구진에 의해 개발됐다. 의료시설 접근이 어려운 환경에서, 그리고 분자진단(RT-PCR) 장비의 대안으로 빠른 사용과 활용이 기대된다.
우리 대학 생명과학과 정현정 교수 연구팀이 '커피링 등온 유전자 검출법(i-CoRi, isothermal coffee ring assay)' 개발에 성공했다고 16일 밝혔다.
'커피링 효과'란 사물 표면에 떨어진 커피 방울이 증발하면서 특징적인 링(ring) 모양이 생기는 효과다. 연구팀은 이 효과에서 아이디어를 얻어 상온에서 육안으로 병원균 유전자를 선택적으로 감별 및 고감도 검출이 가능한 기술을 개발했다. 이 기술은 RT-PCR 등 기존 분자진단 기술처럼 고가의 정밀한 장비가 필요한 문제점을 해소할 수 있다. 즉, 정 교수팀이 개발한 기술은 쉽고 간단한 POCT(point-of-care testing) 기술로 저가라는 게 큰 장점이다.
우리 대학 생명과학과 강유경 박사가 제1 저자로, 생명과학과 석박사통합과정 임산해, 나노과학기술대학원 석박사통합과정 류제성 학생이 공동저자로 참여한 이번 연구 결과는 바이오센서 분야 국제학술지 '바이오센서 앤 바이오일렉트로닉스(Biosensors & Bioelectronics, IF 10.257)' 9월 6일 字 온라인에 게재됐다. (논문명: Simple visualized readout of suppressed coffee ring patterns for rapid and isothermal genetic testing of antibacterial resistance)
정 교수 연구팀이 개발한 '커피링 등온 유전자 검출법'은 병원균 감염의 빠른 판별을 위해 시료를 표면에 떨어뜨려 커피링 패턴을 유도, 육안으로 관찰함으로써 병원균의 내성 종류를 선택적으로 정확하게 검출이 가능할 뿐 아니라 스마트폰 등을 이용한 모바일 진단이 가능한 기술이다.
콜로이드 용액이 기판 표면에서 증발할 때, 표면장력과 모세관 운동에 따라 미세입자들이 이를 포함하는 용액 방울 주변으로 이동해 특징적인 링 패턴을 형성한다. 연구팀은 표적 유전자 물질이 존재할 경우 미세입자와 유전자 물질의 선택적 인식에 의한 입자-핵산 물질 간 상호 응축을 유도해 링 패턴을 억제함으로써 병원균을 감별했다.
연구팀은 또 커피링 현상에 회전 환 증폭(rolling circle amplification) 기반의 등온 증폭기술을 융합했는데 융합과정에서 생성된 긴 단일 가닥의 표적 DNA 물질이 미세입자(직경 0.1~10 마이크로미터 가량) 크기로 응축되도록 효과를 극대화했다. 연구팀은 이밖에 *젭토 몰 농도 이하의 범위(sub-zeptomolar)에서도 병원균 표적 물질을 육안으로 검출하거나 스마트폰 등 모바일 장치를 통해 기록과 판독이 모두 가능한 기술을 개발했다.
☞ 젭토(zepto): 10^(-21) 을 뜻하는 접두어. 1 젭토 몰 농도는 용액 10 cc에 분자 6개가 존재하는 농도로, 기존의 현장 진단키트의 경우는 1 젭토 몰 농도의 약 1,000배 이상의 표적 물질이 존재해야 검출이 가능하다.
연구팀에서 개발한 '커피링 등온 유전자 검출' 기술은 신속하고 높은 선택성과 민감도를 지니고 있어 유전자상 2개 염기의 차이를 구별하며 별도의 분석 장비 없이 30분 이내에 항생제 내성 유전자 검출과 함께 혈청 등 복잡한 시료에서도 검출이 가능한 게 특징이다.
연구팀은 이와 함께 자동판독을 위한 진단키트로의 활용을 위해 미세입자에 의해 나타나는 공간 패턴의 이미지를 판독할 수 있는 알고리즘을 정립했고, 이를 통해 커피링 형성에 따른 감염 여부를 판별하는 데 성공했다.
정현정 교수는 "연구팀이 개발한 `커피링 등온 유전자 검출법'은 진료소나 클리닉 등에서 병상 분석을 위해서 유용하게 적용될 수 있을 것으로 기대된다ˮ면서 "현재 코로나바이러스감염증(COVID-19)을 진단하는 데 적용하기 위한 연구를 진행 중이다ˮ고 밝혔다.
이번 연구는 한국보건산업진흥원 감염병위기대응기술개발사업 및 한국연구재단의 중견연구자지원사업 지원을 통해 이뤄졌다.
2020.09.16 조회수 25905 -
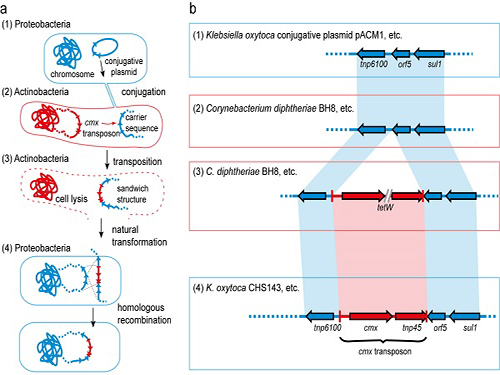 이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
2017.06.19 조회수 16339
이상엽 특훈교수, 병원균이 항생제에 내성을 갖는 원리 규명
〈 이 상 엽 교수 〉
우리 대학 생명화학공학과 이상엽 교수와 덴마크 공대(DTU) 노보 노르디스크 바이오지속가능센터(Novo Nordist Foundation Center for Biosustainability) 공동 연구팀이 박테리아 병원균이 항생제에 대한 내성을 획득하는 작동 원리를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
항생제 남용 등으로 인해 항생제 내성균이 점점 더 늘어나고 있다. 이는 인류의 생존을 위협하는 문제로 그 심각성이 전 세계적으로 점점 커지고 있다.
인체 감염균이 항생제 내성을 갖는 방식에는 항생제를 분해하는 효소를 갖거나 다시 뱉어내는 등 다양한 방식이 있다. 그 중 대표적인 것은 항생제 내성 유전자를 획득해 항생제를 무용지물로 만드는 것이다.
내성 유전자는 보통 항생제를 생산하는 곰팡이나 악티노박테리아에서 발견된다. 이는 해당 항생제를 만드는 곰팡이와 박테리아가 자기 스스로를 항생제로부터 보호하기 위해 갖고 있는 것이다.
이 내성 유전자를 인체 감염균이 획득하면 항생제 내성을 갖게 된다. 이러한 사실은 게놈 정보 등을 통해 이미 알려져 있는 사실이다.
그러나 어떤 방식으로 항생제 내성 유전자들이 인체 감염균에 전달되는지는 밝혀지지 않았다.
이상엽 교수와 덴마크 공대 공동 연구팀은 항생제 내성 유전자가 직접적으로 인체 감염균에 전달되는 것이 아니라 연구팀이 캐리백(carry-back)이라고 이름 지은 복잡한 과정을 통해 이뤄지는 것을 규명했다.
우선 인체 감염균과 방선균이 박테리아간의 성교에 해당하는 접합(conjugation)에 의해 인체 감염균의 DNA 일부가 방선균으로 들어간다.
그 와중에 항생제 내성 유전자 양쪽 주위에도 감염균의 DNA가 들어가는경우가 생긴다. 이 상태에서 방선균이 죽어 세포가 깨지면 항생제 내성 유전자와 감염균의 DNA 조각이 포함된 DNA들도 함께 나오게 된다.
이렇게 배출된 항생제 내성 유전자에는 인체 감염균의 일부 DNA가 양쪽에 공존하고 있다. 이 때문에 인체 감염균은 자신의 게놈에 재삽입이 가능해지고 이를 통해 항생제 내성을 획득한다.
연구팀은 생물정보학적 분석과 실제 실험을 통해 이를 증명했다.
이 교수는 “이번 연구결과는 인체 감염 유해균들이 항생제 내성을 획득하는 방식 중 한 가지를 제시한 것이다”며 “병원 내, 외부의 감염과 예방 관리시스템, 항생제의 올바른 사용에 대해 다시 한 번 생각할 수 있는 기회를 제공할 것이다”고 말했다.
이번 연구는 노보 노르디스크 재단과 미래창조과학부 원천기술과(바이오리파이너리를 위한 시스템대사공학 연구사업)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 항생제 내성 유전자가 전달되는 캐리백 현상의 모식도
2017.06.19 조회수 16339 -
 신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 14070
신속·간편한 유전자 진단 신기술 개발
- 독일‘스몰’지 표지논문 선정,“다양한 병원균 감염 여부 신속히 진단하는 새로운 원천기술”-
표적 DNA를 현장에서 신속, 간편하게 육안으로 진단할 수 있는 발색 진단 기술이 국내 연구자의 주도로 개발되었다.
우리 학교 박현규 교수가 주도한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행되었다.
박현규 교수 연구팀은 자성 나노입자가 과산화효소 활성을 나타낸다는 최근 이론을 활용하여, PCR(중합효소 연쇄반응)에 의해 증폭된 DNA를 육안으로 쉽게 검출하는 발색 유전자 진단 신기술을 개발하였다.
이 기술은 진단하고자 하는 표적 DNA를 PCR 반응으로 증폭시키면, 증폭된 DNA가 자성 나노입자의 과산화효소 활성을 현저히 저해한다는 사실에 기반을 두고 있다.
즉, 표적 유전자가 없으면 자성 나노입자의 과산화효소 활성으로 특정한 발색 반응이 일어나 색 전이현상이 일어나지만, 표적 유전자가 있으면 PCR 반응에 의해 증폭되어 자성 나노입자의 과산화효소 활성을 막아 색 전이현상이 나타나지 않는다.
이러한 발색 반응 유무는 육안으로도 쉽게 식별할 수 있어, 기존의 복잡한 유전자 진단기술을 획기적으로 간편화시킨 새로운 유전자 진단기술로 평가된다.
경제성과 실용성을 갖춘 유전자 진단 기술 분야의 혁신적 원천기술로서, 임상적으로도 유용하게 활용될 수 있다는 것이 특징이다.
박 교수팀의 기술은 기존의 금 나노입자 기반 유전자 진단 기술과는 달리, 금 나노입자 표면에 DNA 분자를 결합하는 과정이나 색 전이 유도를 위해 염을 첨가하는 과정 등의 추가 처리가 불필요하기 때문에 값싸고 편리한 유전자 진단 기술 개발을 위한 새로운 원천기술로 기대하고 있다.
연구팀은 성병을 유발하는 병원균(클라미디아 트라코마티스)에 감염된 샘플을 대상으로 이 기술을 적용하여 원인균 감염 여부를 색 전이현상을 통해 육안으로 정확히 식별해냄으로써 임상 유용성을 훌륭하게 검증하였다.
박현규 교수는 “자성나노입자의 원리를 이용한 이 신기술은 다양한 병원균 감염을 신속히 진단하기 위한 새로운 원천기술로서, 각종 생체물질과 화학물질을 검출하는 기술로 확대되어 다각적으로 활용될 것으로 전망한다”고 연구의의를 밝혔다.
한편, 이번 연구결과는 나노과학 분야의 권위 있는 학술지인 독일의 ‘스몰(Small)’지 6월호(6월 6일자)에 표지논문으로 게재되는 영예를 얻었다.
2011.06.29 조회수 14070 -
 가상세포 이용해 병원균 잡는 항생제 개발
교육과학기술부는 미래기반기술개발사업(시스템생물학 연구)으로 지원한 우리학교 이상엽 교수팀(전남대 이준행교수, 생명(연), 화학(연) 공동연구)이 항생제에 내성을 가진 병원균 퇴치를 위해 시스템생물학을 기반으로 한 신약발굴 방법론을 개발했다고 밝혔다.
이 교수팀은 병원균이 항생제의 오남용으로 인해 치유가 쉽지 않은 점을 감안하여 내성 병원균의 가상세포를 만들어서 이에 대한 특성을 분석하여 제어하는 방법으로 효과를 입증했다.
이번 연구의 대상은 오염된 어패류에 의해 감염되는 패혈증의 병원균인 비브리오 불니피쿠스(Vibrio vulnificus, 이하 비브리오균) 중 내성균 2개이며, 이에 대한 게놈정보와 생물정보를 토대로 가상세포를 구축하였다.
이러한 가상세포가 생존하기 위해 필요한 화학물질은 193개로 분석되었으며, 이중에서 결정적 역할을 수행하는 5개의 화학물질을 추출하였으며, 이에 관여하는 유전자를 제거함으로써 내성 비브리오균의 성장이 억제되는 효과를 증명하였다.
이 교수팀의 연구결과는 올해 1월 18일 세계적 권위의 네이처 자매지인 ‘분자시스템생물학 (Molecular Systems Biology)지’에 논문으로 게재되어 세계적으로도 연구의 우수성이 인정되었다.
이러한 시스템생물학 기법에 근거한 신약발굴 방법론은 다른 내성 병원균은 물론 다양한 인간 질병에도 적용할 수 있는 토대를 마련한 것으로 기대된다.
2011.01.19 조회수 13280
가상세포 이용해 병원균 잡는 항생제 개발
교육과학기술부는 미래기반기술개발사업(시스템생물학 연구)으로 지원한 우리학교 이상엽 교수팀(전남대 이준행교수, 생명(연), 화학(연) 공동연구)이 항생제에 내성을 가진 병원균 퇴치를 위해 시스템생물학을 기반으로 한 신약발굴 방법론을 개발했다고 밝혔다.
이 교수팀은 병원균이 항생제의 오남용으로 인해 치유가 쉽지 않은 점을 감안하여 내성 병원균의 가상세포를 만들어서 이에 대한 특성을 분석하여 제어하는 방법으로 효과를 입증했다.
이번 연구의 대상은 오염된 어패류에 의해 감염되는 패혈증의 병원균인 비브리오 불니피쿠스(Vibrio vulnificus, 이하 비브리오균) 중 내성균 2개이며, 이에 대한 게놈정보와 생물정보를 토대로 가상세포를 구축하였다.
이러한 가상세포가 생존하기 위해 필요한 화학물질은 193개로 분석되었으며, 이중에서 결정적 역할을 수행하는 5개의 화학물질을 추출하였으며, 이에 관여하는 유전자를 제거함으로써 내성 비브리오균의 성장이 억제되는 효과를 증명하였다.
이 교수팀의 연구결과는 올해 1월 18일 세계적 권위의 네이처 자매지인 ‘분자시스템생물학 (Molecular Systems Biology)지’에 논문으로 게재되어 세계적으로도 연구의 우수성이 인정되었다.
이러한 시스템생물학 기법에 근거한 신약발굴 방법론은 다른 내성 병원균은 물론 다양한 인간 질병에도 적용할 수 있는 토대를 마련한 것으로 기대된다.
2011.01.19 조회수 13280