%EB%A7%9E%EC%B6%A4%ED%98%95
-
 軍 전투원, 신소재 입고 개인 맞춤형 훈련시대 연다
기존 군 훈련은 정형화된 방식에 의존하는 경우가 많아 전투원 개인의 특성이나 전투 상황에 맞춘 최적화된 훈련 제공에 한계가 있었다. 이에 우리 연구진이 전자섬유 플랫폼을 개발해 전투원 개개인의 특성과 전투 국면을 반영할 수 있는 원천기술을 확보했다. 이 기술은 전장에서 활용할 수 있을 만큼 튼튼함이 입증됐고, 많은 병력에게 보급할 수 있을 정도의 경제성도 갖췄다.
우리 대학 신소재공학과 스티브 박 교수 연구팀이 섬유 위에 전자회로를 `그려 넣는' 혁신적인 기술을 통해 유연하고 착용 가능한 전자 섬유(E-textile) 플랫폼을 개발했다고 25일 밝혔다.
연구팀이 개발한 웨어러블 전자 섬유 플랫폼은 3D 프린팅 기술과 신소재공학적 설계를 결합해 유연하면서도 내구성이 뛰어난 센서와 전극을 섬유에 직접 인쇄했다. 이를 통해 전투원 개개인의 정밀한 움직임 및 인체 데이터를 수집하고, 이를 기반으로 맞춤형 훈련 모델을 제시할 수 있게 됐다.
기존 전자 섬유 제작 방식은 복잡하거나 개인별 맞춤형 제작에 한계가 있었다. 연구팀은 이를 극복하고자 `직접 잉크 쓰기(Direct Ink Writing, DIW)' 3D 프린팅이라는 적층 방식 기술을 도입했다.
이 기술은 센서와 전극의 기능을 하는 특수 잉크를 섬유 기판 위에 원하는 패턴으로 직접 분사해 인쇄하는 방식이다. 이를 통해 복잡한 마스크 제작 과정 없이도 다양한 디자인을 유연하게 구현할 수 있게 됐다. 이는 수십만 명에 달하는 군 병력에 손쉽게 보급할 수 있는 효과적인 기술로 기대된다.
해당 기술의 핵심은 신소재공학적 설계에 기반한 고성능 기능성 잉크 개발이다. 연구팀은 유연성을 가진 스티렌-부타디엔-스티렌(Styrene-butadiene-styrene, SBS) 고분자와 전도성을 부여하는 다중 벽 탄소나노튜브(Multi-walled carbon nanotube,MWCNT)를 조합해, 최대 102% 늘어나면서도, 10,000번의 반복적인 테스트에서도 안정적인 성능을 유지하는 인장/굽힘 센서 잉크를 개발했다. 이는 전투원의 격렬한 움직임 속에서도 정확한 데이터를 꾸준히 얻을 수 있음을 의미한다.
또한, 섬유의 위아래 층을 전기적으로 연결하는 `상호연결 전극(Interconnect electrode)' 구현에도 신소재 기술이 적용됐다. 은(Ag) 플레이크와 단단한 폴리스티렌(Polystyrene) 고분자를 조합한 전극 잉크를 개발, 섬유 속으로 잉크가 스며드는 정도(Impregnation level)를 정밀하게 제어해 섬유의 양면 또는 다층 구조를 효과적으로 연결하는 기술을 확보했다. 이를 통해 센서와 전극이 집적된 다층 구조의 웨어러블 전자 시스템 제작이 가능하다.
연구팀은 실제 인체 움직임 모니터링 실험을 통해 개발된 플랫폼의 성능을 입증했다. 연구팀은 개발된 전자 섬유를 옷의 주요 관절 부위(어깨, 팔꿈치, 무릎)에 프린팅하여 달리기, 팔 벌려 높이뛰기, 팔굽혀 펴기 등 다양한 운동 시의 움직임과 자세 변화를 실시간으로 측정했다.
또한, 스마트 마스크를 활용해 호흡 패턴을 모니터링하거나, 장갑에 여러 센서 및 전극을 프린팅해 기계학습을 통한 물체 인식 및 복합적인 촉감 정보를 인지하는 응용 가능성도 시연했다. 이러한 결과는 개발된 전자 섬유 플랫폼이 전투원의 움직임 역학을 정밀하게 파악하는 데 효과적임을 보여준다.
이번 연구는 최첨단 신소재 기술이 국방 분야 첨단화에 기여할 수 있음을 보여주는 중요한 사례다. 이번 연구에 참여한 박규순 육군 소령은 군사적 활용이나 실 보급을 위한 경제성 등의 요구되는 목표들을 연구설계 시부터 고려했다.
박 소령은 "현재 우리 군은 인구절벽으로 인한 병력자원의 감소와 과학기술의 발전으로 위기이자 기회를 마주하고 있다. 또한, 전장에서의 생명 존중이 큰 이슈로 떠오르고 있다. 해당 연구는 병과/직책별, 전투의 유형에 따른 맞춤식 훈련을 제공할 수 있는 원천기술을 확보해 우리 장병들의 전투력을 향상하고 생존성을 보장하기 위한 것이다ˮ 라고 전했다.
이어, “이번 연구가 과학적인 기여와 군 활용성의 두 마리 토끼를 모두 잡은 사례로 평가받길 기대한다”라고 밝혔다.
우리 대학 신소재공학과 박규순 박사과정(육군 소령)이 제1 저자로 참여하고 스티브 박 교수가 지도한 이번 연구는 전기·전자/재료공학 분야 국제 학술지인 `npj Flexible Electronics (JCR 분야 상위 1.8%)' 에 2025년 5월 27일 자로 출판됐다.
※논문명 : Fabrication of Multifunctional Wearable Interconnect E-textile Platform Using Direct Ink Writing (DIW) 3D Printing
※DOI: https://doi.org/10.1038/s41528-025-00414-7
한편 이번 연구는 산업통상자원부 및 한국연구재단의 지원을 받아 수행됐다.
2025.06.25 조회수 1535
軍 전투원, 신소재 입고 개인 맞춤형 훈련시대 연다
기존 군 훈련은 정형화된 방식에 의존하는 경우가 많아 전투원 개인의 특성이나 전투 상황에 맞춘 최적화된 훈련 제공에 한계가 있었다. 이에 우리 연구진이 전자섬유 플랫폼을 개발해 전투원 개개인의 특성과 전투 국면을 반영할 수 있는 원천기술을 확보했다. 이 기술은 전장에서 활용할 수 있을 만큼 튼튼함이 입증됐고, 많은 병력에게 보급할 수 있을 정도의 경제성도 갖췄다.
우리 대학 신소재공학과 스티브 박 교수 연구팀이 섬유 위에 전자회로를 `그려 넣는' 혁신적인 기술을 통해 유연하고 착용 가능한 전자 섬유(E-textile) 플랫폼을 개발했다고 25일 밝혔다.
연구팀이 개발한 웨어러블 전자 섬유 플랫폼은 3D 프린팅 기술과 신소재공학적 설계를 결합해 유연하면서도 내구성이 뛰어난 센서와 전극을 섬유에 직접 인쇄했다. 이를 통해 전투원 개개인의 정밀한 움직임 및 인체 데이터를 수집하고, 이를 기반으로 맞춤형 훈련 모델을 제시할 수 있게 됐다.
기존 전자 섬유 제작 방식은 복잡하거나 개인별 맞춤형 제작에 한계가 있었다. 연구팀은 이를 극복하고자 `직접 잉크 쓰기(Direct Ink Writing, DIW)' 3D 프린팅이라는 적층 방식 기술을 도입했다.
이 기술은 센서와 전극의 기능을 하는 특수 잉크를 섬유 기판 위에 원하는 패턴으로 직접 분사해 인쇄하는 방식이다. 이를 통해 복잡한 마스크 제작 과정 없이도 다양한 디자인을 유연하게 구현할 수 있게 됐다. 이는 수십만 명에 달하는 군 병력에 손쉽게 보급할 수 있는 효과적인 기술로 기대된다.
해당 기술의 핵심은 신소재공학적 설계에 기반한 고성능 기능성 잉크 개발이다. 연구팀은 유연성을 가진 스티렌-부타디엔-스티렌(Styrene-butadiene-styrene, SBS) 고분자와 전도성을 부여하는 다중 벽 탄소나노튜브(Multi-walled carbon nanotube,MWCNT)를 조합해, 최대 102% 늘어나면서도, 10,000번의 반복적인 테스트에서도 안정적인 성능을 유지하는 인장/굽힘 센서 잉크를 개발했다. 이는 전투원의 격렬한 움직임 속에서도 정확한 데이터를 꾸준히 얻을 수 있음을 의미한다.
또한, 섬유의 위아래 층을 전기적으로 연결하는 `상호연결 전극(Interconnect electrode)' 구현에도 신소재 기술이 적용됐다. 은(Ag) 플레이크와 단단한 폴리스티렌(Polystyrene) 고분자를 조합한 전극 잉크를 개발, 섬유 속으로 잉크가 스며드는 정도(Impregnation level)를 정밀하게 제어해 섬유의 양면 또는 다층 구조를 효과적으로 연결하는 기술을 확보했다. 이를 통해 센서와 전극이 집적된 다층 구조의 웨어러블 전자 시스템 제작이 가능하다.
연구팀은 실제 인체 움직임 모니터링 실험을 통해 개발된 플랫폼의 성능을 입증했다. 연구팀은 개발된 전자 섬유를 옷의 주요 관절 부위(어깨, 팔꿈치, 무릎)에 프린팅하여 달리기, 팔 벌려 높이뛰기, 팔굽혀 펴기 등 다양한 운동 시의 움직임과 자세 변화를 실시간으로 측정했다.
또한, 스마트 마스크를 활용해 호흡 패턴을 모니터링하거나, 장갑에 여러 센서 및 전극을 프린팅해 기계학습을 통한 물체 인식 및 복합적인 촉감 정보를 인지하는 응용 가능성도 시연했다. 이러한 결과는 개발된 전자 섬유 플랫폼이 전투원의 움직임 역학을 정밀하게 파악하는 데 효과적임을 보여준다.
이번 연구는 최첨단 신소재 기술이 국방 분야 첨단화에 기여할 수 있음을 보여주는 중요한 사례다. 이번 연구에 참여한 박규순 육군 소령은 군사적 활용이나 실 보급을 위한 경제성 등의 요구되는 목표들을 연구설계 시부터 고려했다.
박 소령은 "현재 우리 군은 인구절벽으로 인한 병력자원의 감소와 과학기술의 발전으로 위기이자 기회를 마주하고 있다. 또한, 전장에서의 생명 존중이 큰 이슈로 떠오르고 있다. 해당 연구는 병과/직책별, 전투의 유형에 따른 맞춤식 훈련을 제공할 수 있는 원천기술을 확보해 우리 장병들의 전투력을 향상하고 생존성을 보장하기 위한 것이다ˮ 라고 전했다.
이어, “이번 연구가 과학적인 기여와 군 활용성의 두 마리 토끼를 모두 잡은 사례로 평가받길 기대한다”라고 밝혔다.
우리 대학 신소재공학과 박규순 박사과정(육군 소령)이 제1 저자로 참여하고 스티브 박 교수가 지도한 이번 연구는 전기·전자/재료공학 분야 국제 학술지인 `npj Flexible Electronics (JCR 분야 상위 1.8%)' 에 2025년 5월 27일 자로 출판됐다.
※논문명 : Fabrication of Multifunctional Wearable Interconnect E-textile Platform Using Direct Ink Writing (DIW) 3D Printing
※DOI: https://doi.org/10.1038/s41528-025-00414-7
한편 이번 연구는 산업통상자원부 및 한국연구재단의 지원을 받아 수행됐다.
2025.06.25 조회수 1535 -
 초경량·고강도 동시 갖춘 첨단 신소재 개발
최근 자동차, 항공, 모빌리티 등 첨단 산업에서는 경량화와 동시에 우수한 기계적 성능을 갖춘 소재에 대한 수요가 증가하고 있다. 국제 공동연구진이 나노 구조를 활용한 초경량 고강도 소재를 개발하여 향후 맞춤형 설계를 통해 다양한 산업에 응용 가능성을 제시했다.
우리 대학 기계공학과 유승화 교수 연구팀이 토론토 대학(Univ. of Toronto) 토빈 필레터 교수(Prof. Tobin Filleter) 연구팀과 협력해, 높은 강성과 강도를 유지하면서도 경량성을 극대화한 나노 격자 구조를 개발했다고 18일 밝혔다.
연구팀은 이번 연구에서 격자 구조의 보(beam) 형상을 최적화해 경량성을 유지하면서도 강성과 강도를 극대화하는 방안을 모색했다.
특히, 다목적 베이지안 최적화(Multi-objective Bayesian Optimization) 알고리즘*을 활용해 인장 및 전단 강성 향상과 무게 감소를 동시에 고려하는 최적 설계를 수행했다. 기존 방식보다 훨씬 적은 데이터(약 400개)만으로도 최적의 격자 구조를 예측하고 설계할 수 있음을 입증했다.
*다목적 베이지안 최적화 알고리즘: 여러 목표를 동시에 고려해 최적의 해결책을 찾는 방법으로, 불확실도가 있는 상황에서도 효율적으로 데이터 수집과 결과 예측을 반복하며 최적화를 진행
연구팀은 더 나아가, 나노 스케일에서는 크기가 작아질수록 기계적 특성이 향상되는 효과를 극대화하기 위해 열분해 탄소(pyrolytic carbon) 소재*를 활용해 초경량·고강도·고강성 나노 격자 구조를 구현했다.
*열분해 탄소 소재: 높은 온도에서 유기물을 분해해 얻는 탄소 물질로, 내열성과 강도가 뛰어나 다양한 산업에서 사용 예를 들어, 고온에서도 변형되지 않는 코팅재로 활용되어 반도체 장비나 인공 관절 코팅에 쓰임
이를 위해 이광자 중합(two-photon polymerization, 2PP) 기술*을 적용해 복잡한 나노 격자 구조를 정밀하게 제작했으며, 기계적 성능 평가 결과 해당 구조가 강철에 버금가는 강도와 스티로폼 수준의 경량성을 동시에 갖추고 있음을 확인했다.
*이광자 중합 기술: 레이저 빔을 이용해 특정 파장의 두 개의 광자가 동시에 흡수될 때만 중합 반응이 일어나도록 하는 원리를 기반으로 하는 첨단 광학 제조 기술
또한, 멀티포커스 이광자 중합(multi-focus 2PP) 기술을 이용해 나노스케일의 정밀도를 유지하면서도 밀리미터 스케일의 구조물 제작이 가능함을 연구팀은 입증했다.
유승화 교수는 “이번 기술은 기존 설계 방식의 한계로 지적되던 응력 집중 문제를 3차원 나노 격자 구조를 통해 혁신적으로 해결함으로써, 초경량성과 고강도를 동시에 구현한 신소재 개발에 중요한 진전을 이루었다”라고 말했다.
이어 유 교수는 “데이터 기반 최적화 설계와 정밀 3D 프린팅 기술을 융합한 이 기술은 항공우주 및 자동차 산업의 경량화 수요에 부응할 뿐만 아니라, 맞춤형 설계를 통한 다양한 산업 응용 가능성을 열어갈 것으로 기대된다”라고 강조했다.
이번 연구는 피터 설레스 박사(Dr. Peter Serles)와 KAIST 여진욱 박사가 공동 제1 저자로 연구를 주도했으며, 유승화 교수와 토빈 필레터 교수가 교신 저자로 참여했다.
연구 결과는 세계적인 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에 2025년 1월 23일 게재됐다.(논문 제목: Ultrahigh Specific Strength by Bayesian Optimization of Lightweight Carbon Nanolattices) DOI: https://doi.org/10.1002/adma.202410651
이번 연구는 과학기술정보통신부에서 지원하는 다상소재 혁신생산공정 연구센터 과제(ERC사업)와 식품의약품안전처의 M3DT(의료기기 디지털 개발도구) 과제, KAIST 국제협력사업의 지원을 받아 수행됐다.
2025.02.18 조회수 4270
초경량·고강도 동시 갖춘 첨단 신소재 개발
최근 자동차, 항공, 모빌리티 등 첨단 산업에서는 경량화와 동시에 우수한 기계적 성능을 갖춘 소재에 대한 수요가 증가하고 있다. 국제 공동연구진이 나노 구조를 활용한 초경량 고강도 소재를 개발하여 향후 맞춤형 설계를 통해 다양한 산업에 응용 가능성을 제시했다.
우리 대학 기계공학과 유승화 교수 연구팀이 토론토 대학(Univ. of Toronto) 토빈 필레터 교수(Prof. Tobin Filleter) 연구팀과 협력해, 높은 강성과 강도를 유지하면서도 경량성을 극대화한 나노 격자 구조를 개발했다고 18일 밝혔다.
연구팀은 이번 연구에서 격자 구조의 보(beam) 형상을 최적화해 경량성을 유지하면서도 강성과 강도를 극대화하는 방안을 모색했다.
특히, 다목적 베이지안 최적화(Multi-objective Bayesian Optimization) 알고리즘*을 활용해 인장 및 전단 강성 향상과 무게 감소를 동시에 고려하는 최적 설계를 수행했다. 기존 방식보다 훨씬 적은 데이터(약 400개)만으로도 최적의 격자 구조를 예측하고 설계할 수 있음을 입증했다.
*다목적 베이지안 최적화 알고리즘: 여러 목표를 동시에 고려해 최적의 해결책을 찾는 방법으로, 불확실도가 있는 상황에서도 효율적으로 데이터 수집과 결과 예측을 반복하며 최적화를 진행
연구팀은 더 나아가, 나노 스케일에서는 크기가 작아질수록 기계적 특성이 향상되는 효과를 극대화하기 위해 열분해 탄소(pyrolytic carbon) 소재*를 활용해 초경량·고강도·고강성 나노 격자 구조를 구현했다.
*열분해 탄소 소재: 높은 온도에서 유기물을 분해해 얻는 탄소 물질로, 내열성과 강도가 뛰어나 다양한 산업에서 사용 예를 들어, 고온에서도 변형되지 않는 코팅재로 활용되어 반도체 장비나 인공 관절 코팅에 쓰임
이를 위해 이광자 중합(two-photon polymerization, 2PP) 기술*을 적용해 복잡한 나노 격자 구조를 정밀하게 제작했으며, 기계적 성능 평가 결과 해당 구조가 강철에 버금가는 강도와 스티로폼 수준의 경량성을 동시에 갖추고 있음을 확인했다.
*이광자 중합 기술: 레이저 빔을 이용해 특정 파장의 두 개의 광자가 동시에 흡수될 때만 중합 반응이 일어나도록 하는 원리를 기반으로 하는 첨단 광학 제조 기술
또한, 멀티포커스 이광자 중합(multi-focus 2PP) 기술을 이용해 나노스케일의 정밀도를 유지하면서도 밀리미터 스케일의 구조물 제작이 가능함을 연구팀은 입증했다.
유승화 교수는 “이번 기술은 기존 설계 방식의 한계로 지적되던 응력 집중 문제를 3차원 나노 격자 구조를 통해 혁신적으로 해결함으로써, 초경량성과 고강도를 동시에 구현한 신소재 개발에 중요한 진전을 이루었다”라고 말했다.
이어 유 교수는 “데이터 기반 최적화 설계와 정밀 3D 프린팅 기술을 융합한 이 기술은 항공우주 및 자동차 산업의 경량화 수요에 부응할 뿐만 아니라, 맞춤형 설계를 통한 다양한 산업 응용 가능성을 열어갈 것으로 기대된다”라고 강조했다.
이번 연구는 피터 설레스 박사(Dr. Peter Serles)와 KAIST 여진욱 박사가 공동 제1 저자로 연구를 주도했으며, 유승화 교수와 토빈 필레터 교수가 교신 저자로 참여했다.
연구 결과는 세계적인 국제 학술지인 ‘어드밴스드 머터리얼즈(Advanced Materials)’에 2025년 1월 23일 게재됐다.(논문 제목: Ultrahigh Specific Strength by Bayesian Optimization of Lightweight Carbon Nanolattices) DOI: https://doi.org/10.1002/adma.202410651
이번 연구는 과학기술정보통신부에서 지원하는 다상소재 혁신생산공정 연구센터 과제(ERC사업)와 식품의약품안전처의 M3DT(의료기기 디지털 개발도구) 과제, KAIST 국제협력사업의 지원을 받아 수행됐다.
2025.02.18 조회수 4270 -
 뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 5424
뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 5424 -
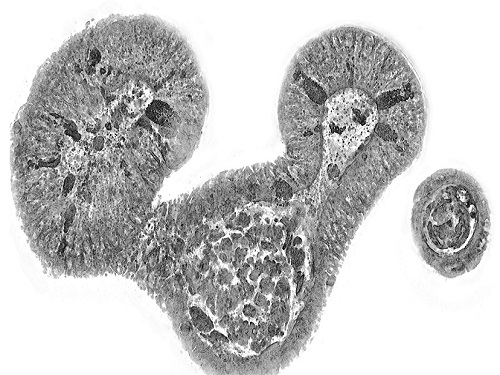 홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 9223
홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 9223 -
 맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 6440
맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 6440 -
 사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6850
사회처럼 건강한 유전자 커뮤니티의 모습을 찾다
구성원들 사이의 활발한 교류로 결속력이 높은 사회적 커뮤니티가 건강한 개인을 만들 듯, 유전자 커뮤니티의 결속력도 개인의 건강 상태에 영향을 미칠 수 있을까? 한국 연구진이 유전자 커뮤니티의 결속력 또한 개인의 건강 상태를 결정하고 환자 맞춤형 의료를 위해 활용될 수 있음을 보여 화제다.
우리 대학 바이오및뇌공학과 이도헌 교수 연구팀이 개인화된 유전자 네트워크에서 환자 특이적으로 결속력이 약화된 유전자 커뮤니티를 찾아내 환자 맞춤형으로 약물 표적을 예측할 수 있는 기술을 개발했다고 23일 밝혔다.
최근 고령화와 생활 습관 변화 등에 따라 암, 심혈관계 질환, 대사 질환 등 많은 복합질병의 발병률이 크게 증가하는 실정이다. 이에 전문가들은 개별 환자의 특성을 고려한 ‘환자 맞춤형 의료’를 제공해 그 치료 효과를 높임으로써 개인적, 사회적 의료비 부담을 경감해야 한다고 지적한다.
이도헌 교수 연구팀은 이러한 요구에 발맞춰 개인화된 유전자 네트워크를 정교하게 구축하고 해당 네트워크에서 각 유전자 커뮤니티의 결속력을 정확하게 측정할 수 있는 코지넷(COSINET, COmmunity COhesion Scores in Individualized gene Network Estimated from single Transcripotmics data) 기술을 개발했다.
연구진들은 수백 개의 정상 조직 유전자 발현 데이터를 근거로 유의미한 상관관계를 보이는 유전자 상호작용을 기반으로 정상 조직의 유전자 네트워크를 구축했다. 그리고 유전자 커뮤니티들의 유전자 상호작용마다 보이는 상관관계를 선형 회귀 분석을 통해 모델링한 뒤, 개별 환자의 유전자 발현량이 해당 예측 모델을 잘 따르는지를 통계적으로 분석했다. 이를 통해 환자 특이적으로 그 상호작용이 소실된 유전자 쌍을 정상 조직 유전자 네트워크에서 제거함으로써 개인화된 유전자 네트워크를 구축했다.
더 나아가 개인화된 유전자 네트워크에서 유전자들 사이의 최단 거리를 기반으로 소실된 유전자 상호작용이 각 유전자 커뮤니티 결속력 약화에 미치는 영향력을 정확하게 측정했다.
연구진들은 환자 특이적으로 그 결속력이 크게 감소한 유전자 커뮤니티를 통해 환자 특이적인 질병 기전을 설명할 수 있음을 보이고, 해당 유전자 커뮤니티에서 환자 특이적으로 결속력 약화에 크게 기여하는 유전자들을 찾아, 보다 효과적인 환자 맞춤형 약물 표적을 제안했다. 연구진들은 이러한 약물 표적 발굴 기술이 기존 기술 대비 약 4배 이상 효과적임을 증명했다.
이도헌 교수는 “여러 유전자가 관여하는 복합질병은 개별 유전자보다는 유전자들 사이의 상호작용을 고려하는 시스템적 관점에서 바라봐야 하며 현재 임상 현장에서 환자 맞춤형 의료를 위해 쓰이는 단일 유전자 기반의 바이오마커들은 복합질병의 이질성과 복잡성을 충분히 담아내기에는 한계가 있다. 따라서 이번 연구에서 개발한 개인화된 유전자 네트워크에서 유전자 커뮤니티의 결속력에 기반한 코지넷(COSINET) 기술이 복합질병의 환자 맞춤형 의료 실현을 위한 새로운 시각을 열어 줄 수 있을 것”이라고 말했다.
바이오및뇌공학과 이도헌 교수와 왕승현 박사과정이 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 생명정보학 분야 최고 학술지인 `생명정보학 브리핑(Briefings in Bioinformatics)’ 2024년 5월호에 게재되고 온라인으로는 4월 15일 발표됐다.
(논문 제목: Community cohesion looseness in gene networks reveals individualized drug targets and resistance, https://academic.oup.com/bib/article/25/3/bbae175/7645997)
한편 이번 연구는 과학기술정보통신부 데이터 기반 디지털 바이오 선도 사업의 지원을 받아 수행됐다.
2024.04.23 조회수 6850 -
 김진국 의과학대학원 교수, 2023 올해의 논문상 수상
우리 대학 의과학대학원 김진국 교수가 지난 25일 스페인 바르셀로나에서 열린 올리고뉴클레오타이드 치료 학회(Oligonucleotide Therapeutics Society)의 2023 연례회의에서 올해의 논문상(Paper of the Year Award)을 수상했다고 26일 밝혔다.
김 교수는 최근 희귀유전질환에 대한 환자맞춤형 치료제를 개발하고 이를 다수의 환자들에게 확대 적용하는데 필요한 가이드라인을 정립한 논문을 지난 7월 국제학술지‘네이처(Nature)’에 출판한 바 있다. 해당 연구는 하버드의과대학의 티모시 유(Timothy Yu) 교수 연구팀과 공동으로 진행하였으며 KAIST 의과학대학원 우시재 박사과정 학생이 주저자로 참여하였고, 과기정통부의 해외우수과학자유치사업Plus(Brain Pool Plus)의 지원을 받았다.
해당 학회는 RNA 기반 치료에서 가장 권위있는 학회로 꼽히며 유럽과 미국을 번갈아가며 연례회의를 개최하고 있다. 올해의 논문상은 지난 한 해 동안 출판된 RNA 기반 치료제 개발 연구 논문 중에 기초 분야에서 1편, 임상연계 분야에서 1편, 총 2편의 가장 임팩트 있는 논문들을 선정해 각 논문의 책임저자 1명에게 수여하며, 김 교수의 논문은 임상연계 분야에 선정됐다.
김 교수는 “이번 수상은 저 뿐만 아니라 이 연구에 기여하신 모든 분들께 앞으로 희귀질환에 대한 연구를 더욱 매진하라고 주는 상이라 생각한다”고 밝혔다. 상금(USD $1,000) 전액은 희귀질환 재단(A-T Children’s Project)에 기부하기로 했다고 밝혔다.
<참고문헌>“A framework for individualized splice-switching oligonucleotide therapy” Nature (2023)
https://www.nature.com/articles/s41586-023-06277-0
2023.10.26 조회수 7278
김진국 의과학대학원 교수, 2023 올해의 논문상 수상
우리 대학 의과학대학원 김진국 교수가 지난 25일 스페인 바르셀로나에서 열린 올리고뉴클레오타이드 치료 학회(Oligonucleotide Therapeutics Society)의 2023 연례회의에서 올해의 논문상(Paper of the Year Award)을 수상했다고 26일 밝혔다.
김 교수는 최근 희귀유전질환에 대한 환자맞춤형 치료제를 개발하고 이를 다수의 환자들에게 확대 적용하는데 필요한 가이드라인을 정립한 논문을 지난 7월 국제학술지‘네이처(Nature)’에 출판한 바 있다. 해당 연구는 하버드의과대학의 티모시 유(Timothy Yu) 교수 연구팀과 공동으로 진행하였으며 KAIST 의과학대학원 우시재 박사과정 학생이 주저자로 참여하였고, 과기정통부의 해외우수과학자유치사업Plus(Brain Pool Plus)의 지원을 받았다.
해당 학회는 RNA 기반 치료에서 가장 권위있는 학회로 꼽히며 유럽과 미국을 번갈아가며 연례회의를 개최하고 있다. 올해의 논문상은 지난 한 해 동안 출판된 RNA 기반 치료제 개발 연구 논문 중에 기초 분야에서 1편, 임상연계 분야에서 1편, 총 2편의 가장 임팩트 있는 논문들을 선정해 각 논문의 책임저자 1명에게 수여하며, 김 교수의 논문은 임상연계 분야에 선정됐다.
김 교수는 “이번 수상은 저 뿐만 아니라 이 연구에 기여하신 모든 분들께 앞으로 희귀질환에 대한 연구를 더욱 매진하라고 주는 상이라 생각한다”고 밝혔다. 상금(USD $1,000) 전액은 희귀질환 재단(A-T Children’s Project)에 기부하기로 했다고 밝혔다.
<참고문헌>“A framework for individualized splice-switching oligonucleotide therapy” Nature (2023)
https://www.nature.com/articles/s41586-023-06277-0
2023.10.26 조회수 7278 -
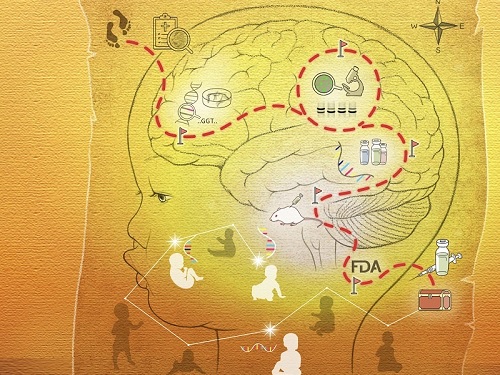 희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7973
희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7973 -
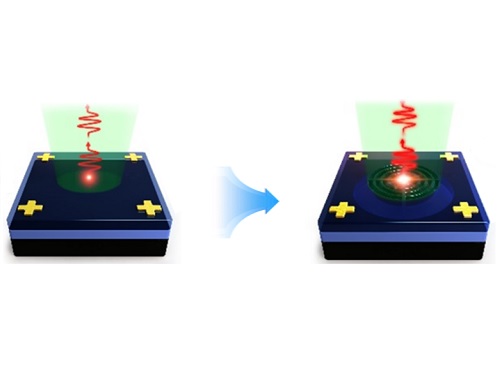 고성능 맞춤형 양자광원 플랫폼 개발
양자정보통신 기술에 필수적인 양자광원을 구현하기 위한 플랫폼으로 반도체 양자점이 주목받고 있는데, 양자점을 이용하면 빛의 최소 알갱이인 광자를 정확히 원하는 시점에 하나씩 발생하는 단일광자 발생기를 만들 수 있기 때문이다. 다만, 양자점과 광학적 특성이 꼭 들어맞는 공진기 구조를 정밀하게 설계하고 결합해야만 발광 성능이 우수한 단일광자 발생기를 만들 수 있다.
우리 대학 물리학과 조용훈 교수 연구팀이 한국전자통신연구원(ETRI) 고영호 박사 연구팀과 한국과학기술연구원(KIST) 송진동 박사 연구팀과의 공동연구를 통해, 고성능의 단일 양자점 양자광원을 고밀도 양자점 기판 위에서 식각과 같은 파괴적인 공정없이 맞춤형으로 다량 만들 수 있는 원천 기술을 개발했다고 18일 밝혔다.
공동 연구팀은 우선 고밀도 양자점 중에서 단 하나의 양자점을 선별해 내는 비파괴적인 선택 방법을 고안하고, 이렇게 선택된 양자점의 광학적 특성을 분석하여 그 특성과 꼭 들어맞는 맞춤형 공진기를 양자점 위치에 맞추어 제작하는 방식으로 접근했다.
조용훈 교수 연구팀은 최근 개발한 집속 이온빔을 이용한 초정밀 나노 소광 기법을 고밀도 양자점에 적용하였는데, 이는 집속 이온빔을 약하게 조사하면 시료가 깎여 나가지 않지만 이온빔을 맞은 부분에는 빛을 내지 못하게 되는 ‘소광(quenching)’이 일어나는 현상을 이용한 것이다.
고밀도 양자점 시료 위에 집속 이온빔을 도넛 패턴으로 조사하면 이온빔을 맞은 도넛 패턴 위의 양자점들은 소광되는 것을 확인하였고, 도넛 패턴의 안쪽 지름을 더욱 줄여가면서 최종적으로 정중앙에 있는 단일 양자점에서만 선명한 빛을 내도록 조절하는 데 성공했다.
이렇게 의도한 위치에 남겨진 단일 양자점의 광학적 특성을 조사한 후에 그 특성에 꼭 맞게 설계한 공진기 구조를 양자점 위치에 정확히 맞추어 제작함으로써 단일 광자의 방출효율을 훨씬 높이고 빛의 방향성을 제어할 수 있었다.
이는 초정밀 나노 소광 기술이 식각을 하지 않는 비파괴적인 방식이기에 시료 전체의 표면 상태를 그대로 유지할 수 있고, 맞춤형으로 설계된 공진기 구조를 표면 위에 직접 형성할 수 있었기에 가능한 일이었다.
연구를 주도한 조용훈 교수는 “기존에 단광자 순도가 낮거나 밀도를 조절하기 어려워 외면받던 고밀도 양자점 시료들에 대해서 고성능 양자광원을 맞춤형으로 구현할 수 있는 방법”이라며, “원하는 위치에 단일 양자점을 반복적으로 구현할 수 있기 때문에 대규모 양자 광학 플랫폼의 개발에 중요한 돌파구가 될 것”이라고 말했다.
우리 대학 물리학과 최민호 박사가 제1 저자로 참여한 이번 연구는 정보통신기획평가원과 한국연구재단 등의 지원을 받아 수행되었으며, 재료 과학 분야의 세계적 학술지인 ‘어드밴스드 머티리얼즈 (Advanced Materials)’에 3월 22일 字에 온라인 게재됐다 (논문명: Single Quantum Dot Selection and Tailor-made Photonic Device Integration Using Nanoscale Focus Pinspot).
2023.04.18 조회수 8584
고성능 맞춤형 양자광원 플랫폼 개발
양자정보통신 기술에 필수적인 양자광원을 구현하기 위한 플랫폼으로 반도체 양자점이 주목받고 있는데, 양자점을 이용하면 빛의 최소 알갱이인 광자를 정확히 원하는 시점에 하나씩 발생하는 단일광자 발생기를 만들 수 있기 때문이다. 다만, 양자점과 광학적 특성이 꼭 들어맞는 공진기 구조를 정밀하게 설계하고 결합해야만 발광 성능이 우수한 단일광자 발생기를 만들 수 있다.
우리 대학 물리학과 조용훈 교수 연구팀이 한국전자통신연구원(ETRI) 고영호 박사 연구팀과 한국과학기술연구원(KIST) 송진동 박사 연구팀과의 공동연구를 통해, 고성능의 단일 양자점 양자광원을 고밀도 양자점 기판 위에서 식각과 같은 파괴적인 공정없이 맞춤형으로 다량 만들 수 있는 원천 기술을 개발했다고 18일 밝혔다.
공동 연구팀은 우선 고밀도 양자점 중에서 단 하나의 양자점을 선별해 내는 비파괴적인 선택 방법을 고안하고, 이렇게 선택된 양자점의 광학적 특성을 분석하여 그 특성과 꼭 들어맞는 맞춤형 공진기를 양자점 위치에 맞추어 제작하는 방식으로 접근했다.
조용훈 교수 연구팀은 최근 개발한 집속 이온빔을 이용한 초정밀 나노 소광 기법을 고밀도 양자점에 적용하였는데, 이는 집속 이온빔을 약하게 조사하면 시료가 깎여 나가지 않지만 이온빔을 맞은 부분에는 빛을 내지 못하게 되는 ‘소광(quenching)’이 일어나는 현상을 이용한 것이다.
고밀도 양자점 시료 위에 집속 이온빔을 도넛 패턴으로 조사하면 이온빔을 맞은 도넛 패턴 위의 양자점들은 소광되는 것을 확인하였고, 도넛 패턴의 안쪽 지름을 더욱 줄여가면서 최종적으로 정중앙에 있는 단일 양자점에서만 선명한 빛을 내도록 조절하는 데 성공했다.
이렇게 의도한 위치에 남겨진 단일 양자점의 광학적 특성을 조사한 후에 그 특성에 꼭 맞게 설계한 공진기 구조를 양자점 위치에 정확히 맞추어 제작함으로써 단일 광자의 방출효율을 훨씬 높이고 빛의 방향성을 제어할 수 있었다.
이는 초정밀 나노 소광 기술이 식각을 하지 않는 비파괴적인 방식이기에 시료 전체의 표면 상태를 그대로 유지할 수 있고, 맞춤형으로 설계된 공진기 구조를 표면 위에 직접 형성할 수 있었기에 가능한 일이었다.
연구를 주도한 조용훈 교수는 “기존에 단광자 순도가 낮거나 밀도를 조절하기 어려워 외면받던 고밀도 양자점 시료들에 대해서 고성능 양자광원을 맞춤형으로 구현할 수 있는 방법”이라며, “원하는 위치에 단일 양자점을 반복적으로 구현할 수 있기 때문에 대규모 양자 광학 플랫폼의 개발에 중요한 돌파구가 될 것”이라고 말했다.
우리 대학 물리학과 최민호 박사가 제1 저자로 참여한 이번 연구는 정보통신기획평가원과 한국연구재단 등의 지원을 받아 수행되었으며, 재료 과학 분야의 세계적 학술지인 ‘어드밴스드 머티리얼즈 (Advanced Materials)’에 3월 22일 字에 온라인 게재됐다 (논문명: Single Quantum Dot Selection and Tailor-made Photonic Device Integration Using Nanoscale Focus Pinspot).
2023.04.18 조회수 8584 -
 암과 치매 등 맞춤형 신약 발굴 플랫폼 개발
우리 대학 화학과 박희성 교수 연구팀이 질병을 유발하는 다양한 바이오마커들에 맞추어 재단하듯이 디자인이 가능한 고리형 펩타이드*기반 신약 발굴 플랫폼 기술을 개발했다고 21일 밝혔다.
*고리형 펩타이드: 기본 선형으로 이루어진 펩타이드를 약리 효과를 높일수 있도록 고리형태의 구조로 만들어진 아미노산 중합체를 지칭함
고리형 펩타이드는 낮은 독성과 뛰어난 약리 활성으로 인해 많은 주목을 받아왔지만 자유롭게 디자인하고 제조하기가 어려워 실제 신약 개발에 활용되기 어려운 단점이 있었다. 박 교수팀은 암을 포함한 다양한 질병들에 대한 치료제 후보물질 발굴에 매우 유용하게 활용될 수 있도록 이러한 고리형 펩타이드의 맞춤형 디자인을 가능하게 하는 신약 발굴 플랫폼 기술을 개발하는데 성공하였다.
우리 몸의 세포에서 만들어지는 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상되어 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 제어할 수 있는 후보물질의 탐색이 용이하지 않아서 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 지난 2016년 다양한 비정상 변형 단백질을 합성할 수 있는 단백질 변형기술을 개발해 `사이언스(Science)' 지에 논문을 발표한 바 있다.
*논문명: A chemical biology route to site-specific authenic protein modifications
연구팀은 기존 연구를 더 발전시켜 질병의 원인이 되는 비정상적인 단백질 변형을 제어할 수 있는 고리형 펩타이드를 효과적으로 디자인하고 탐색하는 스크리닝 플랫폼 기술을 개발했다.
연구팀은 이 기술을 활용해 비정상적인 단백질에 결합하여 다양한 종류의 암을 유발하는 원인으로 알려진 종양 바이오마커인 HDAC8(histone deaceytylase 8)의 활성을 저해하는 고리형 펩타이드를 효과적으로 발굴할 수 있음을 증명했다.
박희성 교수는 "이 기술이 실용화될 경우 다양한 질병에 대한 혁신신약 후보물질 탐색이 실질적으로 가능해질 것으로 전망된다ˮ며 "향후 맞춤형 표적 항암제 및 뇌 신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다ˮ고 말했다.
이번 연구는 과학기술정보통신부(장관 이종호)가 창의성 기초연구를 촉진하는 개인연구사업 중견연구와 미래 과학기술을 선도하는 연구자를 발굴하는 삼성미래기술육성사업재단(이사장 김성근)의 지원을 받아 수행됐다.
화학과 강덕희 박사와 김도욱 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지인 `앙게반테 케미(Angewandte Chemie International Edition)' 2023년 1월 16일 자 온라인판으로 게재됐다.
*논문명: A Versatile Strategy for Screening Cutson-Designed Warhead-Armed Cyclic Peptide Inhibitors
2023.02.21 조회수 8873
암과 치매 등 맞춤형 신약 발굴 플랫폼 개발
우리 대학 화학과 박희성 교수 연구팀이 질병을 유발하는 다양한 바이오마커들에 맞추어 재단하듯이 디자인이 가능한 고리형 펩타이드*기반 신약 발굴 플랫폼 기술을 개발했다고 21일 밝혔다.
*고리형 펩타이드: 기본 선형으로 이루어진 펩타이드를 약리 효과를 높일수 있도록 고리형태의 구조로 만들어진 아미노산 중합체를 지칭함
고리형 펩타이드는 낮은 독성과 뛰어난 약리 활성으로 인해 많은 주목을 받아왔지만 자유롭게 디자인하고 제조하기가 어려워 실제 신약 개발에 활용되기 어려운 단점이 있었다. 박 교수팀은 암을 포함한 다양한 질병들에 대한 치료제 후보물질 발굴에 매우 유용하게 활용될 수 있도록 이러한 고리형 펩타이드의 맞춤형 디자인을 가능하게 하는 신약 발굴 플랫폼 기술을 개발하는데 성공하였다.
우리 몸의 세포에서 만들어지는 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상되어 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 제어할 수 있는 후보물질의 탐색이 용이하지 않아서 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 지난 2016년 다양한 비정상 변형 단백질을 합성할 수 있는 단백질 변형기술을 개발해 `사이언스(Science)' 지에 논문을 발표한 바 있다.
*논문명: A chemical biology route to site-specific authenic protein modifications
연구팀은 기존 연구를 더 발전시켜 질병의 원인이 되는 비정상적인 단백질 변형을 제어할 수 있는 고리형 펩타이드를 효과적으로 디자인하고 탐색하는 스크리닝 플랫폼 기술을 개발했다.
연구팀은 이 기술을 활용해 비정상적인 단백질에 결합하여 다양한 종류의 암을 유발하는 원인으로 알려진 종양 바이오마커인 HDAC8(histone deaceytylase 8)의 활성을 저해하는 고리형 펩타이드를 효과적으로 발굴할 수 있음을 증명했다.
박희성 교수는 "이 기술이 실용화될 경우 다양한 질병에 대한 혁신신약 후보물질 탐색이 실질적으로 가능해질 것으로 전망된다ˮ며 "향후 맞춤형 표적 항암제 및 뇌 신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다ˮ고 말했다.
이번 연구는 과학기술정보통신부(장관 이종호)가 창의성 기초연구를 촉진하는 개인연구사업 중견연구와 미래 과학기술을 선도하는 연구자를 발굴하는 삼성미래기술육성사업재단(이사장 김성근)의 지원을 받아 수행됐다.
화학과 강덕희 박사와 김도욱 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지인 `앙게반테 케미(Angewandte Chemie International Edition)' 2023년 1월 16일 자 온라인판으로 게재됐다.
*논문명: A Versatile Strategy for Screening Cutson-Designed Warhead-Armed Cyclic Peptide Inhibitors
2023.02.21 조회수 8873 -
 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75941
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75941 -
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24975
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24975