연구

〈 이 주 호 박사 〉
악성 뇌종양인 교모세포종은 미디어에서 주요 소재로 나올 만큼 인간에게 치명적인 질병으로 일반 대중에게 낯설지 않은 질병이다. 실제로 악성 뇌종양으로 인한 미국 암 관련 사망률은 4위에 달하며 미국의 에드워드 케네디, 존 매케인 상원의원 등이 이 질병으로 사망했거나 투병 중이다.
우리 대학 의과학대학원 이정호 교수 연구팀이 세브란스병원 신경외과 강석구 교수와의 공동 연구를 통해 악성 뇌종양인 교모세포종 돌연변이 발생이 암 부위가 아닌 암에서 멀리 떨어진 뇌실하영역에서 발생한다는 사실을 규명했다.
이는 교모세포종 발병의 원인이 암 발생 부위일 것이라는 기존의 학설을 뒤집는 연구 결과로, 악성도가 가장 높은 종양인 교모세포종의 치료법 개발에 새로운 방향을 제시할 것으로 기대된다.
또한 그동안 암 조직만을 대상으로 이뤄진 암 연구가 암의 기원이 되는 조직에 대한 연구로 발전하면서 교모세포종 뿐 아니라 다른 암에 대해서도 치료의 실마리를 찾을 수 있는 기반이 될 것으로 보인다.
의과학대학원 졸업생 이주호 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처(Nature)’ 8월 1일자 온라인 판에 게재됐다.
교모세포종은 가장 예후가 좋지 않은 종양이다. 암 발생의 근본적인 원인에 대한 이해가 부족해 수술을 하더라도 재발 가능성이 매우 높기 때문이다. 수술만으로 치료가 불가능해 항암치료, 방사선치료, 표적항암제 등을 병행하지만 아직도 그 치료법이 명확하지 않다.
이정호 교수 연구팀은 암 발생 부위가 아닌 종양과 떨어져 있는 뇌실하영역이라는 곳에 주목했다. 교모세포종이 수술 이후에도 재발률이 높다는 점에서 원인이 다른 곳에 있을 것이라고 판단한 것이다.
이 교수는“교모세포종은 종양을 떼어내도 1~2년 후에 재발률이 높다. 암은 돌연변이인데 돌연변이가 발생하는 곳이 종양이 아닌 다른 부위라고 생각했고 그곳이 바로 뇌실하영역(subventricular zone : SVZ)이라는 사실을 밝혀냈다”고 말했다.
연구팀은 2013년부터 2017년 사이에 수술을 한 뇌종양 환자 28명을 대상으로 종양조직 외에 수술 중 제거되는 종양조직, 정상조직, 뇌실주변의 조직 3가지를 조합해 분석했다. 딥 시퀀싱, 단일세포시퀀싱 등을 통해 교모세포종의 시작이 뇌실하영역에서 발생한 낮은 빈도의 종양을 유발하는 돌연변이에 의한 것임을 밝혔다.
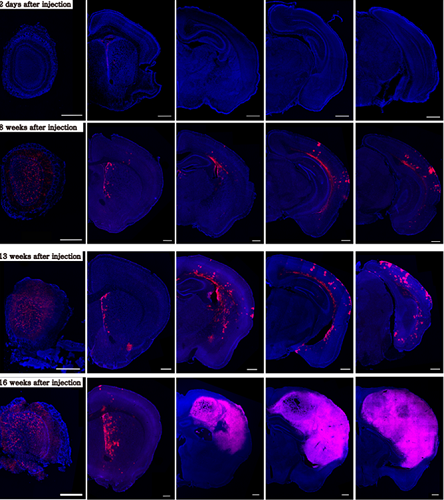
특히 유전자 편집 동물 모델을 통해 뇌실하영역에서 돌연변이가 생기면 이 돌연변이를 가진 세포가 뇌실하영역을 떠나 뇌의 다른 부위로 이동해 교모세포종이 되는 사실 또한 확인했다. 돌연변이 세포가 마치 불꽃놀이처럼 곳곳으로 퍼진 뒤 시간이 지나자 다른 부위에서 종양으로 진화한 것이다.
연구팀은 KAIST 교원창업(소바젠, 대표 김병태)을 통해 이번 연구결과를 바탕으로 뇌실하영역의 세포가 교모세포종으로 진화되는 과정을 막기 위한 치료약 개발에 나설 예정이다.
1저자인 이주호 박사는 “암 중 예후가 가장 좋지 않은 교모세포종에 대한 발암의 비밀을 국내 연구진이 풀어냈다는 것에 큰 의미가 있다”며 “악성 뇌종양의 연구와 치료의 획기적 전환점을 최초로 증명하고 제시한 것이다”고 말했다.
이정호 교수는 “암 중 가장 예후가 좋지 않은 교모세포종의 원인을 파악하고 동물 모델 제작까지 성공했다는 점에서 큰 의미가 있다. 환자에게서 찾은 것을 동물에 그대로 반영했기 때문에 여기서 치료를 할 수 있다면 임상까지 가능할 것이다.”고 말했다.
이정호 교수 연구팀은 후천성 뇌 돌연변이에 의한 난치성 뇌전증의 원리와 치료법을 최초로 규명한 바 있다. 이를 토대로 글로벌 제약회사와 함께 임상 2상이 진행될 정도로 난치성 뇌질환의 진단 및 치료법 개발을 세계적으로 리드하고 있다.
이 교수는 한국인으로서는 처음으로 난치성 뇌전증의 유전 병리학적 진단 기준을 세우는 세계 뇌전증학회 핵심 위원으로 참여해 국제 기준을 제정 중이다.
이번 연구는 서경배과학재단, 보건복지부 세계선도의과학자육성사업, 한국연구재단, 보건산업진흥원 사업을 통해 수행됐다.
□ 그림 설명
그림1. 교모세포종의 발암의 시작을 불꽃놀이에 비유한 그림
그림2. 동물 실험을 통해 뇌실하영역이 발암의 시발점임을 증명
-
행사 KAIST-Nature, ‘2025 네이처 컨퍼런스' 공동 개최
인공지능 차세대 반도체, 자율 실행 실험실 (Self-Driving Lab), 소재 개발 자율 로봇(Robotics for Autonomous Materials Development) 등 최신 연구 동향과 네이처 편집위원들을 만나 토론을 할 수 있는 국제행사가 KAIST에서 열린다. 우리 대학이 2025년 2월 5일부터 7일까지 3일간 대전 KAIST 본원 학술문화관에서 ‘2025 네이처 컨퍼런스’를 개최한다고 4일(월) 밝혔다. 국제학술지 네이처와 공동으로 개최하는 이번 행사에서는 5일 네이처 인텍스(Nature Index)와 정책포럼으로 시작하여 6~7일은 ‘인공지능을 위한 신소재, 신소재를 위한 인공지능(Materials for AI, AI for Materials)’을 주제로 인공지능과 신소재 분야의 최신 연구 동향을 공유한다. 네이처 인덱스는 올해 특집호에서 한국의 과학기술 분야 연구개발(R&D) 성과가 인력과 예산
2024-11-04 -
연구 미래 식량인 미생물 식품 생산 전략 밝혀
가파른 인구 증가와 기후 변화로 인한 식량 생산성 저하로 인해 전 세계 식량 위기가 고조되고 있다. 더욱이 오늘날의 식량 생산 및 공급 시스템은 인류가 배출하는 총량의 30%에 달할 정도로 막대한 양의 이산화탄소를 배출하며 기후 변화를 가중시키고 있다. 이러한 난국을 타개할 열쇠로서 지속 가능하면서도 영양이 풍부한 미생물 식품이 주목받고 있다. 우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘지속 가능한 원료로부터의 미생물 식품 생산’연구의 방향을 제시하는 논문을 게재했다고 12일 밝혔다. 미생물 식품은 미생물을 이용해 생산되는 각종 식품과 식품 원료를 가리킨다. 미생물의 바이오매스에는 단위 건조 질량당 단백질 함량이 육류에 비견될 정도로 많은 양의 단백질을 함유하고 있으며, 각종 가축이나 어패류, 농작물과 비교해 단위 질량을 생산하는 데 가장 적은 양의 이산화탄소를 배출하고, 필요로 하는 물의 양과 토지 면적 또한 적기
2024-04-12 -
연구 단결정 내 역동적인 분자 구조 변화 포착
눈에 보이지 않는 작은 분자 세계의 비밀이 밝혀졌다. 우리 대학 화학과 이효철 교수(기초과학연구원(IBS) 첨단 반응동역학 연구단장) 연구팀이 화학적 단결정 분자 내 구조 변화와 원자의 움직임을 실시간으로 관찰하는 데 성공했다. 물질을 이루는 기본 단위인 원자들은 화학결합을 통해 분자를 구성한다. 하지만 원자는 수 펨토초(1/1,000조 초)에 옹스트롬(1/1억 cm) 수준으로 미세하게 움직여 시간과 공간에 따른 변화를 관측하기 어려웠다. 분자에 엑스선을 쏴 회절 신호를 분석하는 엑스선 결정학(X-ray Crystallography)의 등장으로 원자의 배열과 움직임을 관찰하는 도구가 상당한 발전을 이뤘지만, 주로 단백질과 같은 고분자 물질에 대한 연구에 집중됐다. 비(非)단백질의 작은 분자 결정은 엑스선을 흡수하는 단면적이 넓고 생성되는 신호가 약해 분석이 어렵기 때문이다. 연구진은 선행 연구에서 단백질 내 화학반응의 전이상태와 그 반응경로를 3차원 구조로 실시간 규명한 바
2024-03-26 -
연구 미생물로 자스민 향도 만든다
우리 대학 생물공정연구센터 최경록 연구교수와 생명화학공학과 이상엽 특훈교수가 ‘벤질아세테이트 생산을 위한 미생물 공정’논문을 발표했다고 26일 밝혔다. 이번 논문은 네이처(Nature) 誌가 발행하는 ‘네이처 화학공학(Nature Chemical Engineering)’의 표지논문으로 선정됐다. ※ 논문명 : A microbial process for the production of benzyl acetate ※ 저자 정보 : 최경록(한국과학기술원, 제1 저자), Luo Zi Wei(한국과학기술원, 제2 저자), 김기배(한국과학기술원, 제3 저자), Xu Hanwen(한국과학기술원, 제4 저자) 및 이상엽(한국과학기술원, 교신저자) 포함 총 5명 향은 화장품 및 식품 산업에서 중요한 요소다. 그중에서도 자스민 향과 일랑일랑 향은 각종 향수와 화장품, 개인 위생용품뿐만 아니라 식품 및 음료 제조에까지 널리 애용되고
2024-02-26 -
행사 우리 대학, 국내 최초 스프링거 네이처와 오픈액세스 계약 체결
우리 대학은 스프링거 네이처(Springer Nature)와 오픈액세스(OA) 전환계약(Transformative Agreement, TA)을 체결함으로써 스프링거 하이브리드 저널에 대해 KAIST 연구자들이 출판비용을 지불하지 않고, 자유롭게 오픈액세스 논문을 출판하는 것이 가능해졌다고 20일 밝혔다. 출판사 스프링거 네이처는 과학기술을 비롯하여 전 학술 분야를 망라하는 글로벌 학술 출판사이며, 오픈액세스란 인터넷상에서 무료로 논문을 볼 수 있게 공개하여 자유롭게 학술정보에 접근할 수 있는 것을 말한다. 구독 액세스와 OA 출판을 하나로 통합하는 전환계약은 읽기 및 출판 권한을 동시에 갖게 되어 KAIST 연구자들이 자유로운 논문 접근과 함께 자신의 연구 논문을 공개하여 모든 사람이 즉시 사용할 수 있게 된다. 연구자들은 2024년부터 2026년까지 3년 동안 약 2,350개의 스프링거 네이처 저널에 접근할 수 있으며 논문 출판비에 대한 부담도 함께 덜게 되었다. 학
2023-10-20