연구

< 사진 1. 화학과 강진영 교수 >
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
< 그림 1. 바이러스 유래 RNA, HK022 putRNA와 대장균 RNA중합효소가 결합한 복합체의 초저온 전자현미경 구조. 왼쪽부터 putEC, put-없는 EC, 시그마-결합 putEC >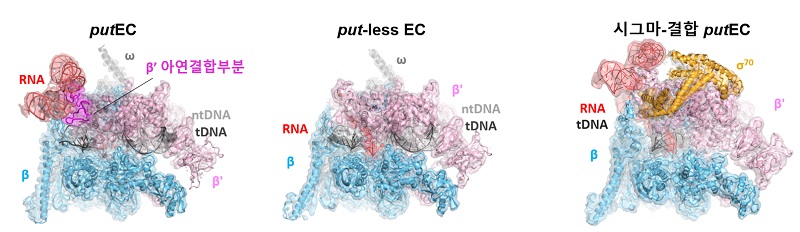
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
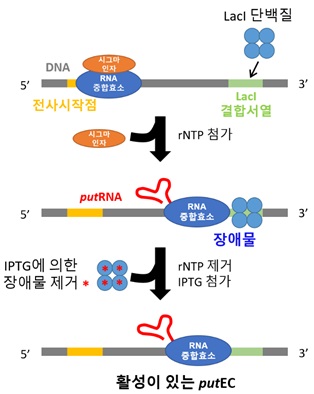
< 그림 2. putEC의 제작 과정. RNA합 성에 필요한 프로모터와 putRNA 서열, LacI 단백질이 결합하는 lacO 서열을 포함하는 DNA 스캐폴드에 RNA중합효소와 시그마 인자, LacI를 첨가한 후 rNTP를 넣어 putRNA- RNA중합효소 복합체(putEC)를 제작한다. 이후 남은 rNTP를 제거하고 IPTG를 첨가하여 LacI를 DNA에서 제거한 후 이를 초저온 전자현미경 분석에 사용하였다. >
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
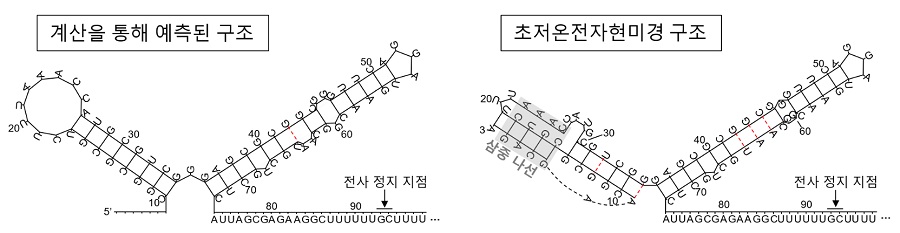
< 그림 3. putRNA의 구조 비교. (왼쪽) 이전에 계산을 통해 예측된 구조 (King et al., 1996), (오른쪽) 초저온전자현미경으로 규명된 구조. >
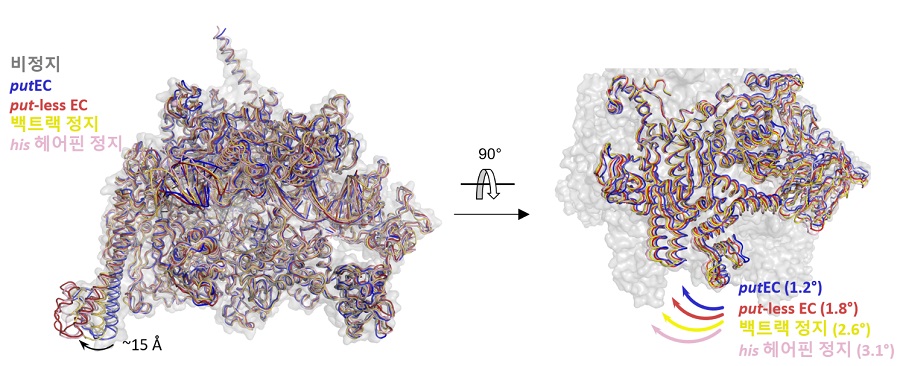
< 그림 4. 여러 대장균 RNA중합효소 연장복합체의 ‘회전’ 비교. 비정지 (회색), putEC (파란색), put-less EC (빨간색), 백트랙 정지 (노란색), his 헤어핀 정지 (분홍색) 상태의 RNA중합효소 구조들을 효소 중심 부분을 기준으로 겹친 후 회전하는 모듈의 회전 각도를 측정하였다. (왼쪽) 중첩된 RNA중합효소 구조들의 정면 모습. (오른쪽) 중첩된 RNA중합효소 중 회전 모듈만 표시한 그림. 위에서 본 모습. 측정한 회전 각도가 화살표 옆에 적혀 있다. >
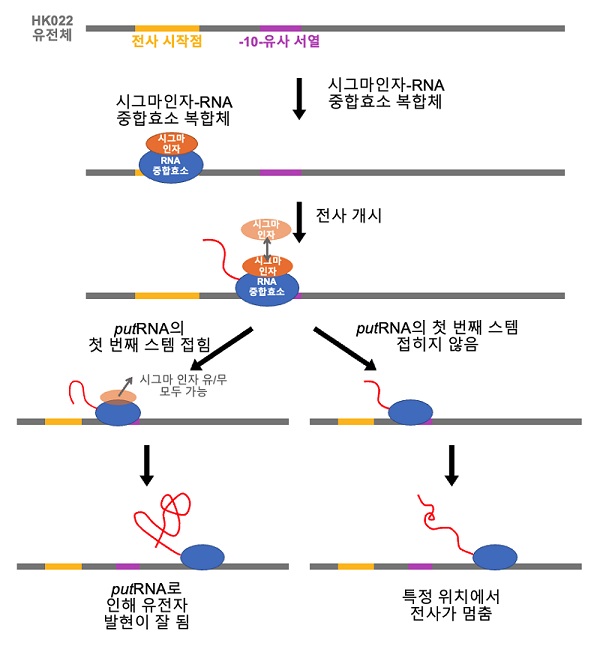
< 그림 5. HK022 putRNA의 작동 원리. 숙주의 RNA중합효소는 HK022 유전체의 프로모터 부분을 인식하여 putRNA를 합성하기 시작한다. 이때 putRNA가 만들어 지면 RNA중합효소와 결합하여 전사의 중지와 종결을 방해하여 HK022 파지의 유전자를 효율적으로 합성하게 된다. 이 때, putRNA 서열 내부에 있는 –10-유사서열에 시그마 인자가 결합하면 putRNA가 더 잘 접히게 된다. 반면, putRNA가 잘 만들어지지 않으면 이후 전사 종결서열에서 RNA합성이 멈추고 HK022 유전체의 발현이 저해된다. >
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
-
연구 AI로 방사성 오염 '아이오딘' 제거용 최적 신소재 발굴
원자력 에너지 활용에 있어 방사성 폐기물 관리는 핵심적인 과제 중 하나다. 특히 방사성 ‘아이오딘(요오드)’는 반감기가 길고(I-129의 경우 1,570만 년), 이동성 및 생체 유독성이 높아 환경 및 인체에 심각한 위험을 초래할 수 있다. 한국 연구진이 인공지능을 활용해 아이오딘을 제거할 원자력 환경 정화용 신소재 발굴에 성공했다. 연구팀은 향후 방사성 오염 흡착용 분말부터 오염수 처리 필터까지 다양한 산학협력을 통해 상용화를 추진할 예정이다. 우리 대학 원자력및양자공학과 류호진 교수 연구팀이 한국화학연구원 디지털화학연구센터 노주환 박사가 협력하여, 인공지능을 활용해 방사성 오염 물질이 될 수 있는 아이오딘을 효과적으로 제거하는 신소재를 발굴하는 기술을 개발했다고 2일 밝혔다. 최근 보고에 따르면 방사능 오염 물질인 아이오딘이 수용액 환경에서 아이오딘산염(IO3-) 형태로 존재하는 것으로 밝혀졌으나, 기존의 은 기반 흡착제는 이에 대해 낮은 화학적
2025-07-02 -
연구 21개 화학반응 동시 분석..AI 신약 개발 판 바꾼다
임산부의 입덧 완화 목적으로 사용됐던 약물인 탈리도마이드(Thalidomide)는 생체 내에서는 광학 이성질체*의 특성으로 한쪽 이성질체는 진정 효과를 나타내지만, 다른 쪽은 기형 유발이라는 심각한 부작용을 일으킨다. 이런 예처럼, 신약 개발에서는 원하는 광학 이성질체만을 선택적으로 합성하는 정밀 유기합성 기술이 중요하다. 하지만, 여러 반응물을 동시에 분석하는 것 자체가 어려웠던 기존 방식을 극복하고, 우리 연구진이 세계 최초로 21종의 반응물을 동시에 정밀 분석하는 기술을 개발해, AI와 로봇을 활용하는 신약 개발에 획기적인 기여가 기대된다. *광학 이성질체: 동일한 화학식을 가지며 거울상 관계에 있으면서 서로 겹칠 수 없는 비대칭 구조로 존재하는 분자 쌍을 말한다. 이는 왼손과 오른손처럼 형태는 유사하지만 포개어지지 않는 관계와 유사하다. 우리 대학 화학과 김현우 교수 연구팀이 인공지능 기반 자율합성* 시대에 적합한 혁신적인 광학이성질체 분석 기술을 개발했다고 16일
2025-06-16 -
연구 세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다. 우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다. RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있
2025-06-10 -
연구 바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다. 우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다. 자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아
2025-05-14 -
연구 "파킨슨병을 편집하다” 염증 RNA 편집 효소 세계 최초 발견
파킨슨병(PD)은 알파시누클린(α-synuclein) 단백질이 뇌세포 내에서 비정상적으로 응집되어 신경세포를 손상시키는 퇴행성 신경질환이다. KAIST 연구진은 파킨슨병의 핵심 병리 중 하나인 신경염증 조절에 있어 RNA 편집(RNA editing)이 중요한 역할을 한다는 사실을 세계 최초로 밝혀냈다. 우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 UCL 국립신경전문병원 연구소 및 프랜시스 크릭 연구소와의 공동 연구를 통해, 뇌를 보호하고자 염증 반응을 일으키는 교세포(astrocyte)에 대해 RNA 편집 효소인 에이다원(ADAR1)이 면역 반응을 조절하는 중요한 역할을 한다는 것을 밝혀내고 파킨슨병의 병리 진행에 핵심적인 역할을 한다는 사실을 입증했다. 최민이 교수 연구팀은 뇌 면역세포의 염증반응을 알아보고자 파킨슨 환자에게서 유래한 줄기세포를 이용해 뇌의 신경세포를 돕는 교세포와 신경세포로 구성된 세포 모델을 만들고, 파킨슨병의 원인이 된다고 알려진 알파
2025-04-28