연구

< (왼쪽부터) 생명과학과 김학성 교수, 배진호 박사 >
우리 대학 생명과학과 김학성 교수와 배진호 박사팀이 거대 (초분자) 단백질을 레고 블록 쌓듯 조립할 수 있는 새로운 기술을 개발했다고 19일 밝혔다. 이 방법으로 단백질 구조체의 크기 및 작용기 수를 원하는 대로 조절할 수 있고 메가 달톤(dalton) 크기의 대칭형 거대 단백질 구조체를 조립할 수 있다. 거대 단백질 구조체는 효율적인 약물 전달, 다양한 백신 개발, 그리고 질병 진단에 활용될 것으로 기대된다.
이번 연구 성과는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science)' (IF: 16.806)에 2021년 11월 1일 字 온라인 발표됐다. (논문명: Dendrimer-like supramolecular assembly of proteins with a tunable size and valency through stepwise iterative growth)
자연계에는 매우 다양한 특성과 기능을 갖는 단백질이 존재하며 생명현상을 유지하는데 핵심 역할을 한다. 이러한 단백질 중에는 단량체가 큰 구조체 형태로 조립됐을 때만 정상적 기능을 수행하거나, 어떤 경우에는 조립된 경우가 단량체와 완전히 다른 특성을 나타내며, 심지어는 심각한 질병을 유발하는 경우도 많다.
예를 들어 바이러스의 껍질인 켑시드는 단백질 단량체가 조립(assembly)된 것이고, 치매는 아밀로이드 펩타이드나 타우(tau) 단백질이 파이브릴(fibril) 형태로 조립되면서 발생한다. 따라서, 거대(초분자) 단백질 구조체들의 조립 기작 이해는 단백질의 기능과 질병의 원인 규명 및 치료제 개발에 중요하다. 또한, 단백질 구조체는 뛰어난 생체 적합도 때문에 생명공학 및 의학 분야에서도 응용 가능성이 크다.
현재 많은 연구 그룹에서 자연계에 존재하는 단백질 구조체들의 조립 과정을 모방해 새로운 기능의 단백질 구조체 개발에 많은 연구를 진행하고 있다. 그러나 단백질의 구조적 다양성, 상이한 특성 및 큰 분자량 때문에 원하는 구조체를 자유자재로 조립하는 것은 아직도 어려운 과제로 남아 있다.
김학성 교수 연구팀은 두 종류의 빌딩(building) 블록 단백질을 코어(core) 단백질에 순차적으로 교대로 결합시킴으로써 간편하게 3차원 구조의 대칭형 거대 단백질 구조체를 조립하는 방법을 개발했다(그림 1). 즉, 서로 특이적으로 반응하는 두 쌍의 단백질과 리건드(P1/L1 과 P2/L2)를 이용해 코어(core) 단백질에 두 종류의 빌딩(building) 블록을 순차적, 반복적으로 결합함으로써 크기와 작용 기작 수를 조절하면서 메가 달톤 (Mega Dalton) 크기를 갖는 단백질 구조체를 쉽게 조립하였다.
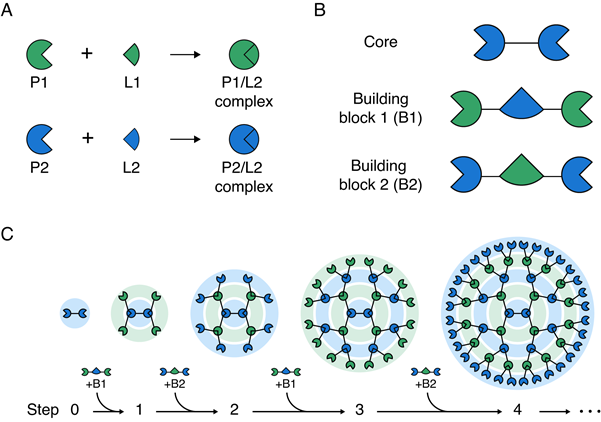
< 그림 1. 거대 단백질을 조립하기 위한 순차적, 교대 결합 방식의 모식도 >
개발된 구조체는 다양한 분야에 응용 가능하며 하나의 예로서, 이번 연구에서는 단백질 구조체에 박테리아 독소를 결합해 암세포 내로 고효율로 전달할 수 있었고, 결과적으로 암세포를 효과적으로 사멸했다(그림 2). 구조체 단백질의 특징인 다가 효과(avidity effect)로 인해 암 표적에 대한 결합력이 약 1,000배 이상 증가돼 암세포 사멸 효과가 획기적으로 증대됐고 이러한 특성은 백신 개발 및 질병 진단에도 응용될 수 있다.
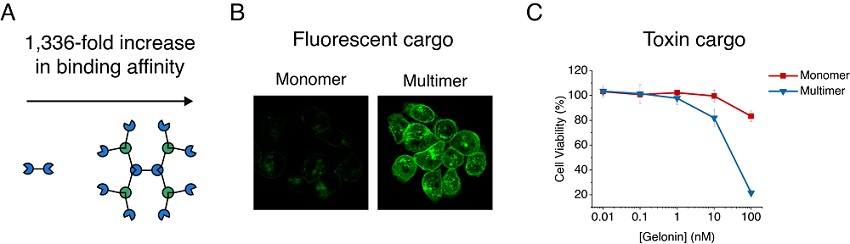
< 그림 2. 구조체의 효율적인 세포 내 단백질 전달 효과 >
제1 저자인 배진호 박사는 "이번 연구에서 개발된 거대(초분자) 단백질 구조체 조립 기술은 향후, 약물 전달, 백신 개발, 질병 진단 및 바이오센서 등을 포함한 광범위한 분야에서 새로운 플랫폼 기술로 활용될 수 있을 것ˮ이라고 말했다.
이번 연구는 한국 연구 재단의 중견 연구과제 (NRF-2021R1A2C201421811) 지원을 받아 수행됐다.
-
연구 이산화탄소만 잡아내는 유망 소재를 AI로 쉽게 찾는다
기후 위기를 막기 위해 이미 배출된 이산화탄소를 적극적으로 줄이는 것이 필수적이며, 이를 위해 공기 중 이산화탄소만 직접 포집하는 기술(Direct Air Capture, 이하 DAC)이 주목받고 있다. 하지만 공기 중에 존재하는 수증기(H₂O)로 인해 이산화탄소만 효과적으로 포집하는 것이 쉽지 않다. 이 기술의 핵심 소재로 연구되는 금속–유기 구조체(Metal-Organic Frameworks, 이하 MOF)를 활용해 우리 연구진이 AI 기반 기계학습 기술을 적용, MOF 중에서 가장 유망한 탄소 포집 후보 소재들을 찾아내는 데 성공했다. 우리 대학 생명화학공학과 김지한 교수 연구팀이 임페리얼 칼리지 런던(Imperial College London) 연구팀과 공동 연구를 통해 대기 중 이산화탄소 포집에 적합한 MOF를 빠르고 정확하게 선별할 수 있는 기계학습 기반 시뮬레이션 기법을 개발했다고 29일 밝혔다. 복잡한 구조와 분자 간 상호작용의 예측 한계로 인해
2025-06-30 -
연구 바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다. 우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다. 자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아
2025-05-14 -
연구 6밀리초에 단백질 반응 순간 포착 성공
생명현상을 이해하고 나아가 신약 개발을 위해 단백질 상호 작용 및 효소-기질 반응 등 마이크로초(micro-second)~밀리초(milli-second) 수준의 짧은 시간 동안 일어난 현상을 이해하는 것이 핵심이다. KAIST 연구진이 생명 현상을 이해하는데 필수적인 생화학 반응의 변화를 수 밀리초 수준에서 정지시키고 분석하는 방법을 개발했다. 우리 대학 화학과 강진영 교수와 물리학과 이원희 교수의 공동 연구팀이 초고속 생화학 반응 연구를 위한 ‘패릴렌(parylene)’* 기반 박막 미세유체 혼합-분사 장치’를 개발했다고 24일 밝혔다. *패릴렌: 단백질 반응을 초고속으로 관찰하기 위한 미세유체(microfluidics) 장치를 만드는 핵심 재료로 수 마이크로미터의 얇은 박막형태로 스프레이 제작이 가능하게 만든 소재임 이번 연구는 기존에 제시됐던 시간 분해 초저온 전자현미경(이하 TRCEM, Time-resolved cryo-elect
2025-03-24 -
연구 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다. 우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다. *nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로
2025-02-17 -
연구 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다. 김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다. 생명과학과 김호민 교수가 교신저자로 참
2025-02-10