연구

< 사진 1. 생명화학공학과 김유식 교수(뒤), 구용석 박사과정(앞) >
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
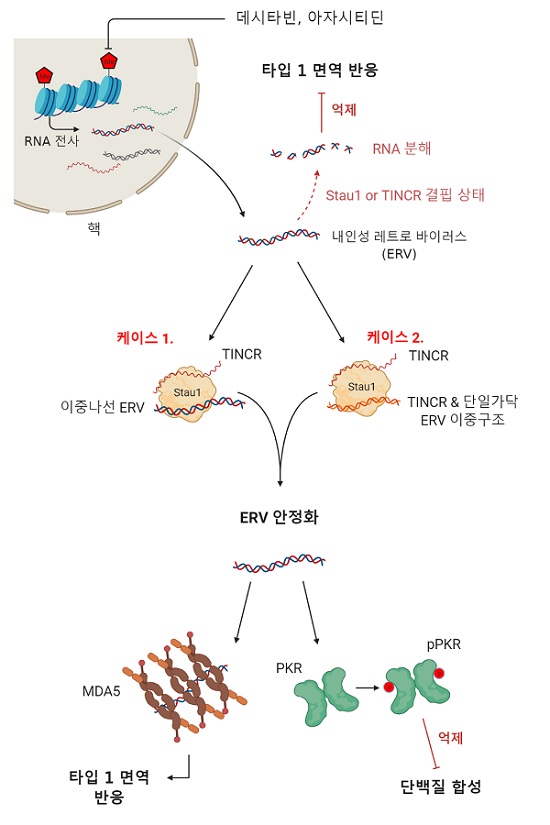
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
< 그림 1. DNA 탈메틸화제를 이용한 화학 항암요법 메커니즘 모식도 >
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
-
연구 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다. 우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다. 기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가
2023-06-22 -
연구 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다. 우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다. 조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것
2023-06-08 -
연구 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다. 최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다. 바이오및뇌공학과
2023-03-02 -
연구 여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다. 세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다. 김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이
2022-12-15 -
연구 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다. 이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다. 연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer) 암 환자는 암세포에 대항해 이를 제거하는 역할
2022-09-14