연구

KAIST 최철희 교수팀, 신경약물전달 신기술 세계 최초 개발
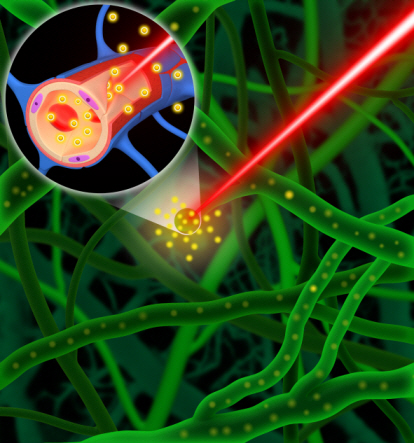
뇌혈관은 혈뇌장벽이라는 특수한 구조로 이루어져 있는데, 레이저로 혈뇌장벽의 투과성을 조절하여 투여된 약물을 뇌로 안전하게 전달하는 기술이 국내 연구진에 의해 세계 최초로 개발됐다.
이번 연구는 교육과학기술부의 ‘21세기 프론티어 뇌기능활용 및 뇌질환 치료기술개발사업단’(단장 김경진)의 지원을 받아 우리학교 최철희(바이오 및 뇌공학과․43) 교수팀 주도로 수행되었다.
혈뇌장벽은 대사와 관련된 물질은 통과시키고 그 밖의 물질은 통과시키지 않는 기능을 함으로써 약물이 뇌로 전달되는 것이 어려웠다.
이런 기능 때문에 우수한 효능을 가진 약물조차 대부분 차단되어 실제로 환자에게 적용할 수 없는 경우가 많아, 약물의 효능을 최대한 유지하면서 혈뇌장벽을 어떻게 통과시키느냐가 이 분야 연구의 핵심과제였다.
원활한 약물 전달을 위해 약물의 구조를 변경하거나 머리에 작은 구멍을 내고 약물을 주사하는 방법도 시도되었지만 고비용과 위험성으로 널리 응용되지 못하고 있었다.
최 교수팀은 기존 기술의 한계를 극복하기 위해 극초단파 레이저빔을 1000분의 1초 동안 뇌혈관벽에 쬐어주는 방법으로 혈뇌장벽의 기능을 일시적으로 차단함으로써 약물을 원하는 부위에 안전하게 도달할 수 있게 하는 신개념 약물전달기술을 개발했다.
레이저 빔을 약물이 들어있는 혈관에 쬐이면 혈뇌장벽이 일시적으로 자극을 받아 수도관이 새는 것 같은 현상을 일으켜 약물이 혈관 밖으로 흘러나와 뇌신경계 등으로 전달된다. 정지된 기능은 몇 분 뒤 다시 제 기능을 되찾는다.
최 교수는 “이번 연구는 새로운 신경약물전달의 원천기술을 확립하였다는 점과, 레이저를 이용한 안정적인 생체 기능 조절 기반기술을 구축하였다는 점에서 커다란 의미가 있다”며, “앞으로 이 기술을 세포 수준으로 영역을 확대하는 한편 후속 임상 연구를 통해 실용화할 계획”이라고 밝혔다.
연구 결과는 신경약물전달 원천기술로서 특허 출원 중이며 세계적 저명 학술지인 미국 국립과학원 회보(2011.05.16자)에 게재됐다.
레이저를 이용하여 뇌혈관의 기능을 조절함으로써 원하는 뇌 부위에 안정적으로 약물을 전달할 수 있는 원천기술

-
연구 6배 정밀한 3D 뇌 모사 플랫폼 구현 성공
기존의 3차원(3D) 신경세포 배양 기술은 뇌의 복잡한 다층 구조를 정밀하게 구현하기 어렵고, 구조와 기능을 동시에 분석할 수 있는 플랫폼이 부족해 뇌 연구에 제약이 있었다. 우리 연구진이 뇌처럼 층을 이루는 신경세포 구조를 3D 프린팅 기술로 구현하고, 그 안에서 신경세포의 활동까지 정밀하게 측정할 수 있는 통합 플랫폼 개발에 성공했다. 우리 대학 바이오및뇌공학과 박제균·남윤기 교수 공동연구팀이 뇌 조직과 유사한 기계적 특성을 가진 저점도 천연 하이드로겔을 이용해 고해상도 3D 다층 신경세포 네트워크를 제작하고, 구조적·기능적 연결성을 동시에 분석할 수 있는 통합 플랫폼을 개발했다고 16일 밝혔다. 기존 바이오프린팅 기술은 구조적 안정성을 위해 고점도 바이오잉크를 사용하지만, 이는 신경세포의 증식과 신경돌기 성장을 제한하고, 반대로 신경세포 친화적인 저점도 하이드로겔은 정밀한 패턴 형성이 어려워 구조적 안정성과 생물학적 기능 사이의 근본적인 상충
2025-07-16 -
연구 로봇도 사람처럼 위험할때만 즉각 반응한다
인공지능과 로봇 기술의 동반 발전 속에서, 로봇이 사람처럼 효율적으로 환경을 인식하고 반응하는 기술 확보가 중요한 과제로 떠오르고 있다. 이에 한국 연구진이 별도의 복잡한 소프트웨어나 회로 없이도 생명체의 감각 신경계를 모사한 인공 감각 신경계를 새롭게 구현해 주목받고 있다. 이 기술은 에너지 소모를 최소화하면서 외부 자극에 지능적으로 반응할 수 있어, 초소형 로봇이나 로봇 의수 등 의료 및 특수 환경에서의 활용이 기대된다. 우리 대학 전기및전자공학부 최신현 석좌교수, 충남대학교 반도체융합학과 이종원 교수 공동연구팀이 생명체의 감각 신경계 기능을 모사하는 차세대 뉴로모픽 반도체 기반 인공 감각 신경계를 개발하고, 이를 통해 외부 자극에 효율적으로 대응하는 신개념 로봇 시스템을 증명했다고 15일 밝혔다. 사람을 포함한 동물은 안전하거나 익숙한 자극은 무시하고, 중요한 자극에는 선별적으로 민감하게 반응함으로써, 에너지 낭비를 방지하면서도 중요한 자극에 집중해 민첩하게 외부 변
2025-07-15 -
연구 뇌는 포도당을 구별한다..비만·당뇨 치료의 단서 찾아
‘우리의 뇌는 어떻게 장내에서 흡수된 다양한 영양소 중 포도당을 구별해낼까?’ 우리 대학 연구진은 이 질문에서 출발해, 뇌가 단순히 총열량(칼로리)을 감지하는 수준을 넘어 특정 영양소, 특히 포도당을 선택적으로 인식할 수 있다는 사실을 입증했다. 이번 연구는 향후 식욕 조절 및 대사성 질환 치료 전략에 새로운 패러다임을 제시할 수 있을 것으로 기대된다. 우리 대학 생명과학과 서성배 교수 연구팀이 바이오및뇌공학과 박영균 교수팀, 생명과학과 이승희 교수팀, 뉴욕 알버트 아인슈타인 의과대학과의 협력을 통해, 배고픔 상태에서 포도당이 결핍된 동물이 장내의 포도당을 선택적으로 인식하고 선호하도록 유도하는 장-뇌 회로의 존재를 규명했다고 9일 밝혔다. 생물은 당, 단백질, 지방 등 다양한 영양소로부터 에너지를 얻는다. 기존 연구들은 장내 총열량 정보가 시상하부의 배고픔 뉴런(hunger neurons)을 억제함으로써 식욕을 조절한다는 사실을 밝혀왔으나, 특정 포도
2025-07-09 -
연구 60% 이상 챗GPT 추론 성능 향상할 NPU 핵심기술 개발
오픈AI 챗GPT4, 구글 Gemnini 2.5 등 최신 생성형AI 모델들은 높은 메모리 대역폭(Bandwidth) 뿐만 아니라 많은 메모리 용량(Capacity)를 필요로 한다. 마이크로소프트, 구글 등 생성형AI 클라우드 운영 기업들이 엔비디아 GPU를 수십만 장씩 구매하는 이유다. 이런 고성능 AI 인프라 구축의 핵심 난제를 해소할 방안으로, 한국 연구진이 최신 GPU 대비 약 44% 낮은 전력 소모에도 평균 60% 이상 생성형 AI 모델의 추론 성능을 향상할 NPU(신경망처리장치)* 핵심 기술을 개발하는데 성공했다. *NPU(Neural Processing Unit): 인공신경망(Neural Network)을 빠르게 처리하기 위해 만든 AI 전용 반도체 칩 우리 대학 전산학부 박종세 교수 연구팀과 (주)하이퍼엑셀(전기및전자공학부 김주영 교수 창업기업)이 연구 협력을 통해, 챗GPT와 같은 생성형AI 클라우드에 특화된 고성능·저전력의 NPU(신경망처리장치)
2025-07-04 -
연구 "파킨슨병을 편집하다” 염증 RNA 편집 효소 세계 최초 발견
파킨슨병(PD)은 알파시누클린(α-synuclein) 단백질이 뇌세포 내에서 비정상적으로 응집되어 신경세포를 손상시키는 퇴행성 신경질환이다. KAIST 연구진은 파킨슨병의 핵심 병리 중 하나인 신경염증 조절에 있어 RNA 편집(RNA editing)이 중요한 역할을 한다는 사실을 세계 최초로 밝혀냈다. 우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 UCL 국립신경전문병원 연구소 및 프랜시스 크릭 연구소와의 공동 연구를 통해, 뇌를 보호하고자 염증 반응을 일으키는 교세포(astrocyte)에 대해 RNA 편집 효소인 에이다원(ADAR1)이 면역 반응을 조절하는 중요한 역할을 한다는 것을 밝혀내고 파킨슨병의 병리 진행에 핵심적인 역할을 한다는 사실을 입증했다. 최민이 교수 연구팀은 뇌 면역세포의 염증반응을 알아보고자 파킨슨 환자에게서 유래한 줄기세포를 이용해 뇌의 신경세포를 돕는 교세포와 신경세포로 구성된 세포 모델을 만들고, 파킨슨병의 원인이 된다고 알려진 알파
2025-04-28