연구
,_Se-Bum_Paik_(center),_and_Woochul_Choi_(right)_1.jpg)
< (왼쪽부터) 송준호 연구원, 백세범 교수, 최우철 박사과정 >
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 뇌신경과학 연구에서 광범위하게 사용되는 실험용 쥐의 뇌 절편 영상을 자동으로 보정하고 규격화하여 신경세포의 3차원 분포정보를 정확하게 얻을 수 있는 핵심 분석 기술을 개발했다.
이 기술은 실험자의 경험에 의존하던 기존 분석 방식의 문제점을 해결하는 한편 여러 개체에서 얻은 뇌 이미지를 표준적인 3차원 지도상에서 비교 분석할 수 있도록 한다. 이는 기존의 개체별 분석에서는 관측하기 힘든 뇌세포 간 상호 연결 형태의 정확한 공간적 분포를 발견할 수 있는 길을 열었다는 점에서 의미가 크다.
연구팀은 생명과학과 이승희 교수팀과의 협력 연구를 통해 실험에서 얻어진 쥐의 뇌 절편 데이터를 분석했는데, 이 기술을 적용한 결과 시각시스템의 초기구조인 외측 슬상핵(Lateral geniculate nucleus)과 시각피질 (Visual cortex) 사이의 정확한 연결 구조 분포를 측정할 수 있었다. 기존 분석 방식으로는 불가능했던 다중 개체로부터 얻어진 데이터의 표준화를 통해 뇌 전역에 걸친 신경세포의 연결성을 분석할 수 있음을 확인한 것이다.
뇌인지공학프로그램 최우철 박사과정과 송준호 연구원이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `셀(cell)'의 온라인 자매지 `셀 리포츠(Cell Reports)' 5월 26일 자에 게재됐다. (논문명 : Precise mapping of single neurons by calibrated 3-D reconstruction of brain slices reveals topographic projection in mouse visual cortex).
이에 앞서 연구팀은 이 기술을 활용해 UC 버클리대학의 양단(Yang Dan) 교수와의 공동연구에도 참여했고 그 결과를 국제 학술지 `사이언스 (Science)' 1월 24일 자에 발표했다. (논문명: A Common Hub for Sleep and Motor Control in the Substantia Nigra).
통상 쥐의 뇌 절편 영상을 이용한 연구에서는 특정 단백질에 형광물질을 발현시킨 뇌를 잘라 신경세포의 분포 등을 분석하는 방법이 광범위하게 사용된다. 이때 형광을 발현하는 신경세포를 현미경을 통해 연구자의 육안으로 관측하고, 얼마나 많은 신경세포가 뇌의 어느 특정 영역에 위치하는지 일일이 수동적으로 분석한다. 이런 방법은 연구자의 경험에 크게 의존하여 오차가 클 수밖에 없고, 각각의 개체에서 관측된 신경세포의 위치나 수량을 표준적인 공통의 방법으로 동시에 분석할 수 없다는 한계를 갖고 있다.
백 교수 연구팀은 미국의 Allen Brain Atlas 프로젝트에서 제공한 쥐 두뇌의 3차원 표준 데이터에 기반하여, 임의의 각도에서 잘라낸 뇌 절편 이미지들을 SURF(Speeded Up Robust Feature Points) 특징점과 HOG(Histogram of Oriented Gradients descriptor) 형상 기술자를 이용하여 데이터베이스와 비교하는 계산적인 분석 방법을 사용했다.
그 결과, 실험에서 얻은 뇌 이미지와 가장 잘 일치하는 데이터베이스의 3차원 위치를 100마이크로미터(μm), 1도 이내의 오차로 찾아낼 수 있었다. 연구팀은 이를 통해 각 2차원 뇌 이미지의 위치 정보를 3차원 공간상의 위치로 정확히 계산하고, 여러 개체에서 얻어진 신경 세포의 위치를 동일한 3차원 공간에 투영해 정확하게 분석할 수 있음을 확인했다.
따라서 이 기술을 활용하면 다양한 기법으로 생성된 뇌 슬라이스 이미지를 이용해 신경세포의 3차원 위치를 뇌 전체에서 자동적으로 계산할 수 있어, 기존의 방법으로는 분석하기 어려운 수천~수만 개의 신경세포들의 정확한 뇌 내 분포 위치 및 상대적 공간 배열을 한번에 분석하는 것이 가능하다.
또 신경세포들의 연결성을 표준적으로 보정된 3차원 공간에서 표현할 수 있어 특정 뇌 영역 간의 연결은 물론 뇌 전역의 네트워크 분포를 여러 개체의 데이터를 사용해 동시분석도 가능하다. 따라서 기존 방식의 동물실험 분석에서 요구되던 시간과 비용을 크게 줄일 수 있을 것으로 기대된다.
올 6월 현재 백 교수 연구팀의 이 기술은 KAIST내 여러 실험실과 미국 MIT, 하버드(Harvard), 칼텍(Caltech), UC 샌디에고(San Diego) 등 세계 유수 대학의 연구 그룹에서 진행하는 뇌 신경 세포의 네트워크 분석에 활용되고 있다.
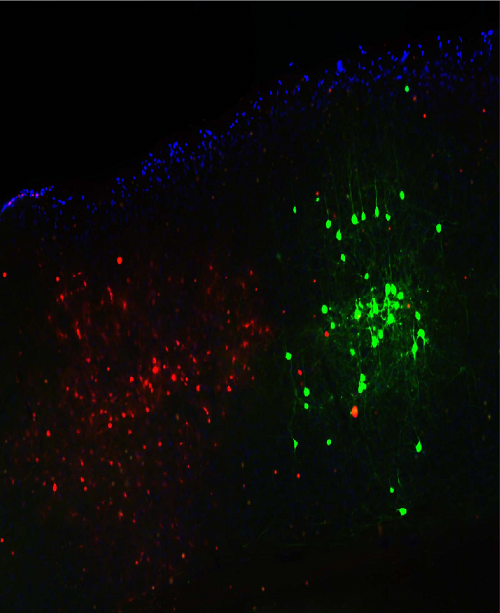
< 그림 1. 형광물질을 발현시킨 뇌 절편 영상에서의 신경세포의 분포 >
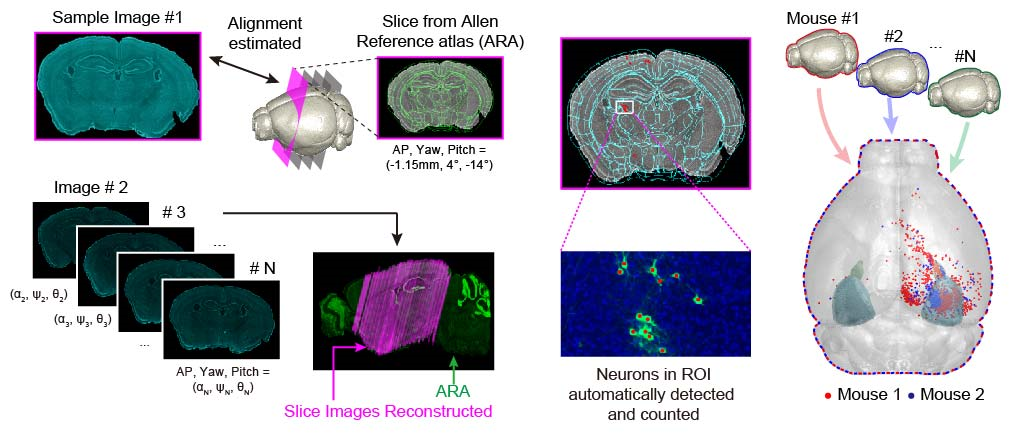
< 그림 2. 뇌 절편 영상의 3차원 위치 계산 및 투영 과정 >
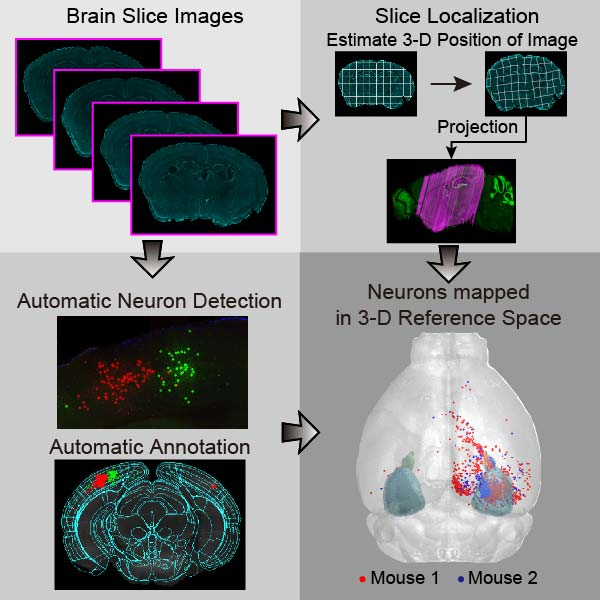
< 그림 3. 뇌 절편 데이터의 위치 정보를 계산하고 형태를 보정하여 표준화된 3차원 지도의 정확한 위치에 투영하는 기술 모식도 >
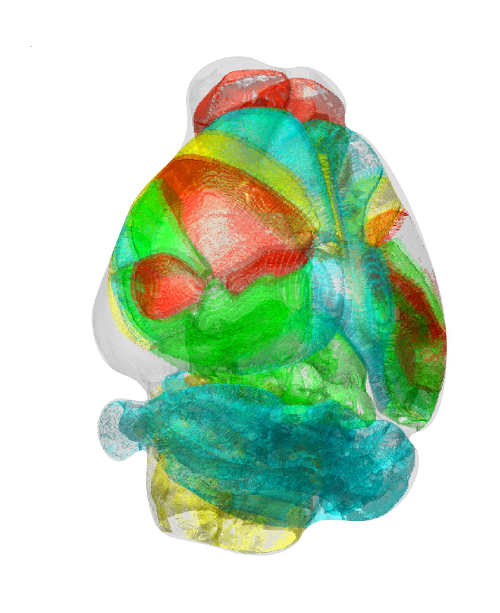
< 그림 4. 쥐의 표준화된 3차원 뇌 지도 >
백세범 교수는 "이번 연구를 통해 개발된 기술은 형광 뇌 이미지를 이용하는 모든 연구에 바로 적용할 수 있을 뿐만 아니라 그 밖에 다양한 종류의 이미지 데이터에도 광범위하게 적용 가능하다ˮ면서 "향후 쥐의 뇌 슬라이스를 이용하는 다양한 분석에 표준적인 기법으로 자리 잡을 수 있을 것으로 기대된다ˮ고 말했다.
이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST의 모험연구사업의 지원을 받아 수행됐다.
-
연구 짠 음식의 뇌종양 악화 유발 원인 세계 최초 밝혀
짠 음식을 자주 섭취하는 식습관이 건강에 해롭다는 것은 널리 알려진 사실이다. 그런데 최근 KAIST 연구진은 짠 음식이 뇌종양까지 악화시킬 수 있다는 사실을 세계 최초로, “왜 나빠지는지", "무엇이 그 과정을 유도하는지", "어떤 유전자가, 어떤 단백질이 작용하는지"까지 분자적 인과관계를 입증해 주목받고 있다. 우리 대학 생명과학과 이흥규 교수 연구팀이 고염식이 장내 미생물 구성을 변화시키고, 이로 인해 증식이 증대된 미생물에 의해 분비되는 대사물질인‘프로피오네이트(propionate)‘가 장내에 과도하게 축적되어 뇌종양을 악화시킨다는 사실을 밝혀냈다. 연구팀은 뇌종양 마우스 모델을 이용한 실험에서 이 같은 사실을 입증했다. 마우스에게 4주간 짠 사료를 섭취하게 한 뒤 종양세포를 주입하자 일반식이 그룹에 비해 생존율이 크게 낮아지고 종양 크기가 증가하는 것을 확인했다. 이어 항생제로 장내 미생물을 제거하거나, 무균 마우스에 분변(고염사료 섭
2025-06-02 -
인물 한순규 교수팀, 한국 최초 신렛(Synlett) 최우수논문상 수상
우리 대학 화학과 한순규 교수 연구팀이 독일의 유서 깊은 학술 출판사 티메(Thieme)가 수여하는 2024 신렛(Synlett) 최우수 논문상(Synlett Best Paper Award 2024)을 수상했다고 30일 밝혔다. 티메는 매해 유기화학 분야 SCI 저널인 신렛에 출판된 논문 중 최우수 논문 1편을 선정해 최우수 논문상을 수여해왔다. 한순규 교수 연구팀은 지난 10여 년간 천연물 합성 연구에 집중하며 다양한 생리활성을 가지는 이차대사물의 효율적이고 독창적인 합성법을 개발했다. 특히 광대싸리나무에서 유래하는 초복잡 세큐리네가 천연물 합성분야에서는 세계적인 선도그룹으로 괄목할 만한 연구성과를 성취했다. 수상 논문에서 한순규 교수 연구팀은 세계 최초로 자연에서 극소량만 얻을 수 있는 희귀한 천연물인 4α-하이드록시알로세큐리닌과 세큐린진 F를 시중에 쉽게 구할 수 있는 시작 물질로부터 인공적으로 처음부터 끝까지 만들어내는 데 성공했다. 세큐리네가 천연물은
2025-05-30 -
연구 심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다. 우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다. *pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향
2025-05-15 -
연구 "파킨슨병을 편집하다” 염증 RNA 편집 효소 세계 최초 발견
파킨슨병(PD)은 알파시누클린(α-synuclein) 단백질이 뇌세포 내에서 비정상적으로 응집되어 신경세포를 손상시키는 퇴행성 신경질환이다. KAIST 연구진은 파킨슨병의 핵심 병리 중 하나인 신경염증 조절에 있어 RNA 편집(RNA editing)이 중요한 역할을 한다는 사실을 세계 최초로 밝혀냈다. 우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 UCL 국립신경전문병원 연구소 및 프랜시스 크릭 연구소와의 공동 연구를 통해, 뇌를 보호하고자 염증 반응을 일으키는 교세포(astrocyte)에 대해 RNA 편집 효소인 에이다원(ADAR1)이 면역 반응을 조절하는 중요한 역할을 한다는 것을 밝혀내고 파킨슨병의 병리 진행에 핵심적인 역할을 한다는 사실을 입증했다. 최민이 교수 연구팀은 뇌 면역세포의 염증반응을 알아보고자 파킨슨 환자에게서 유래한 줄기세포를 이용해 뇌의 신경세포를 돕는 교세포와 신경세포로 구성된 세포 모델을 만들고, 파킨슨병의 원인이 된다고 알려진 알파
2025-04-28 -
연구 세계 최초 카이럴자성 양자점 개발- 빛 구동 AI용 소자 구현
기존 양자점(quantum dots)에는 카이랄 방향성, 광학적 또는 자기적 특성을 복합적으로 구현하는 것이 매우 어려운 기술이었다. KAIST 연구진이 이런 한계를 극복하고, 세계 최초로 광학적 카이랄성과 자성의 융합 특성을 동시에 갖춘 ‘카이럴 자성 양자점’을 개발하고, 이를 활용하여 사람의 뇌처럼 정보를 보고, 판단하고, 저장하며 초기화할 수 있는 기능을 단일 소자에 집약해, 고성능 AI 하드웨어의 새로운 패러다임을 제시했다. 우리 대학 신소재공학과 염지현 교수 연구팀이 빛에 의해 비대칭 반응하는 카이랄성과 자성을 동시에 갖는 특수 나노입자인 양자점(CFQD)을 세계 최초로 개발하고, 저전력 인간 뇌 구조와 작동 방식을 모방한 인공지능 뉴로모픽 소자(ChiropS)까지 성공적으로 구현했다. 신소재공학과 염지현 교수 연구팀이 개발한 카이랄 양자점을 활용한 광 시냅스 트랜지스터는 편광 구분, 멀티 파장 인식, 전기 소거 등 다양한 기능을 단일 소자에 집
2025-04-25