연구

< (왼쪽부터) 강창원 우리 대학 생명과학과 명예교수, 홍성철 서울대 물리천문학부 교수, 송은호 제1저자 >
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
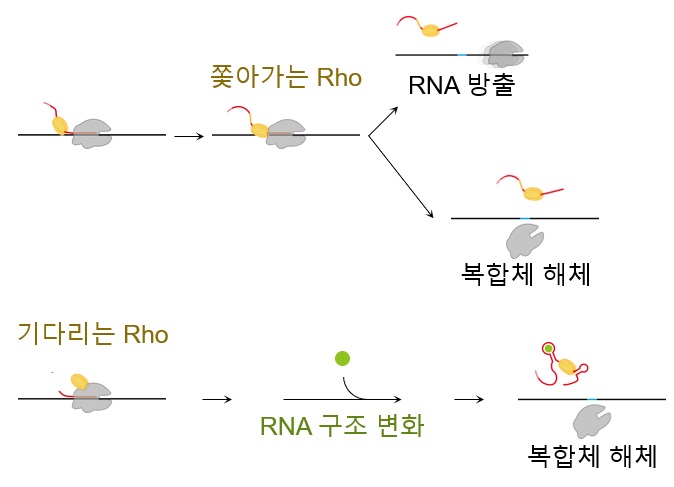
< 그림 1. 종결인자 Rho에 의한 끝내기 세 갈래의 진행 속도와 조절 양상의 차이 >
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
-
연구 21개 화학반응 동시 분석..AI 신약 개발 판 바꾼다
임산부의 입덧 완화 목적으로 사용됐던 약물인 탈리도마이드(Thalidomide)는 생체 내에서는 광학 이성질체*의 특성으로 한쪽 이성질체는 진정 효과를 나타내지만, 다른 쪽은 기형 유발이라는 심각한 부작용을 일으킨다. 이런 예처럼, 신약 개발에서는 원하는 광학 이성질체만을 선택적으로 합성하는 정밀 유기합성 기술이 중요하다. 하지만, 여러 반응물을 동시에 분석하는 것 자체가 어려웠던 기존 방식을 극복하고, 우리 연구진이 세계 최초로 21종의 반응물을 동시에 정밀 분석하는 기술을 개발해, AI와 로봇을 활용하는 신약 개발에 획기적인 기여가 기대된다. *광학 이성질체: 동일한 화학식을 가지며 거울상 관계에 있으면서 서로 겹칠 수 없는 비대칭 구조로 존재하는 분자 쌍을 말한다. 이는 왼손과 오른손처럼 형태는 유사하지만 포개어지지 않는 관계와 유사하다. 우리 대학 화학과 김현우 교수 연구팀이 인공지능 기반 자율합성* 시대에 적합한 혁신적인 광학이성질체 분석 기술을 개발했다고 16일
2025-06-16 -
연구 세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다. 우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다. RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있
2025-06-10 -
연구 바이러스 면역반응‘켰다 껐다’단백질 스위치 발견
팬데믹 이후에도 다양한 신종 감염병이 출현하며 우리는 여전히 강력하고 지속적인 면역 방어를 요구하는 바이러스 위협에 직면해 있다. 동시에 과잉으로 면역 체계가 반응하면 오히려 몸의 조직을 해치는 부작용이 생기기도 한다. KAIST·국제 연구진이 이런 바이러스에 면역 반응을 조절하는 스위치 역할의 단백질을 찾아내는데 성공했다. 향후 감염병 대응과 자가면역질환 치료의 새로운 기반을 마련할 것으로 기대된다. 우리 대학 생명화학공학과 김유식 교수와 미국 플로리다주립대 차승희 교수 공동 연구팀이 세포 내 미토콘드리아에서 유래한 이중나선 RNA가 면역반응을 증폭시키는 메커니즘을 규명하고, 이를 조절하는 단백질 슬러프(SLIRP)가 바이러스 감염과 자가면역질환 양쪽에서 ‘면역 스위치’ 역할을 수행하는 것을 밝혀냈다. 자가면역질환은 면역 체계가 외부 침입자와 자기 조직을 구분하지 못하고 스스로를 공격하는 질환으로, 쉐그렌 증후군, 전신홍반루푸스 등으로 아
2025-05-14 -
연구 "파킨슨병을 편집하다” 염증 RNA 편집 효소 세계 최초 발견
파킨슨병(PD)은 알파시누클린(α-synuclein) 단백질이 뇌세포 내에서 비정상적으로 응집되어 신경세포를 손상시키는 퇴행성 신경질환이다. KAIST 연구진은 파킨슨병의 핵심 병리 중 하나인 신경염증 조절에 있어 RNA 편집(RNA editing)이 중요한 역할을 한다는 사실을 세계 최초로 밝혀냈다. 우리 대학 뇌인지과학과 최민이 교수 연구팀이 영국 UCL 국립신경전문병원 연구소 및 프랜시스 크릭 연구소와의 공동 연구를 통해, 뇌를 보호하고자 염증 반응을 일으키는 교세포(astrocyte)에 대해 RNA 편집 효소인 에이다원(ADAR1)이 면역 반응을 조절하는 중요한 역할을 한다는 것을 밝혀내고 파킨슨병의 병리 진행에 핵심적인 역할을 한다는 사실을 입증했다. 최민이 교수 연구팀은 뇌 면역세포의 염증반응을 알아보고자 파킨슨 환자에게서 유래한 줄기세포를 이용해 뇌의 신경세포를 돕는 교세포와 신경세포로 구성된 세포 모델을 만들고, 파킨슨병의 원인이 된다고 알려진 알파
2025-04-28 -
연구 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다. *카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을
2025-03-19