-
 정확한 우울증 예측 이제는 손목에서 가능하다
정신질환 팬데믹이 발생했다. 전 세계적으로 약 10억 명이 크고 작은 정신질환을 앓고 있다. 한국도 더욱 심각하여 현재 우울증 및 불안장애 환자는 약 180만 명이며 총 정신질환자는 5년 새 37% 증가하여 약 465만 명이다. 한미 공동 연구진이 웨어러블 기기를 통해 수집되는 생체 데이터를 활용해 내일의 기분을 예측하고, 나아가 우울증 증상의 발현 가능성을 예측하는 기술을 개발했다.
우리 대학 뇌인지과학과 김대욱 교수 연구팀이 미국 미시간 대학교 수학과 대니엘 포저(Daniel B. Forger) 교수팀과 공동연구로 스마트워치로부터 수집되는 활동량, 심박수 데이터로부터 교대 근무자의 수면 장애, 우울감, 식욕부진, 과식, 집중력 저하와 같은 우울증 관련 증상을 예측하는 기술을 개발했다고 15일 밝혔다.
WHO에 따르면 정신질환의 새로운 유망한 치료 방향은 충동성, 감정 반응, 의사 결정 및 전반적인 기분에 직접적인 영향을 주는 뇌 시상하부에 위치한 생체시계(circadian clock)와 수면(sleep stage)에 중점을 두는 것이다.
하지만 현재 내재적 생체리듬(endogenous circadian rhythms)과 수면 상태를 측정하기 위해서는 하룻밤 동안 30분 간격으로 피를 뽑아 우리 몸의 멜라토닌 호르몬 농도 변화를 측정하고 수면다원검사(polysomnography, PSG)를 수행해야 한다. 이 때문에 병원 입원이 불가피하여, 통원 치료를 받는 정신질환자가 대부분인 실제 의료 현장에서 두 요소를 고려한 치료법 개발은 지난 반세기 동안 큰 진전이 없었다. 더불어 검사 비용 또한 무시할 수 없어(PSG: 보험료 적용 없을 시 약 100만원) 사회적 약자는 현재 정신건강치료의 사각지대에 있다.
이러한 문제를 극복하기 위한 해결책은 공간의 제약 없이 실시간으로 심박수, 체온, 활동량 등 다양한 생체 데이터를 손쉽게 수집할 수 있다는 웨어러블 기기다. 그러나 현재 웨어러블 기기는 생체시계의 위상과 같은 의료 현장에서 필요로 하는 바이오마커(Biomarker)의 간접적인 정보만을 제공하는 한계를 가지고 있다.
공동연구팀은 스마트워치로부터 수집된 심박수와 활동량 시계열 데이터 등 매일 변화하는 생체시계의 위상을 정확히 추정하는 필터링(Filtering) 기술을 개발했다. 이는 뇌 속 일주기 리듬을 정밀하게 묘사하는 디지털 트윈(Digital twin)을 구현한 것으로, 이를 활용해 일주기 리듬 교란을 추정하는 데 활용될 수 있다.
이 생체시계 디지털 트윈의 우울증 증상 예측 활용 가능성을 미시간 대학교 신경과학 연구소의 스리잔 센(Srijan Sen) 교수 및 정신건강의학과의 에이미 보너트(Amy Bohnert) 교수 연구팀과의 협업을 통해 검증했다.
협업 연구팀은 약 800명의 교대 근무자가 참여한 대규모 전향 코호트 연구를 수행해 해당 기술을 통해 추정된 일주기 리듬 교란 디지털 바이오마커가 내일의 기분과 우울증의 대표적인 증상인 수면 문제, 식욕 변화, 집중력 저하, 자살 생각을 포함한 총 6가지 증상을 예측할 수 있음을 보였다.
김대욱 교수는 “수학을 활용해 그동안 잘 활용되지 못했던 웨어러블 생체 데이터를 실제 질병 관리에 적용할 수 있는 실마리를 제공하는 연구를 진행할 수 있어 매우 뜻깊다”라며, “이번 연구를 통해 연속적이고 비침습적인 정신건강 모니터링 기술을 제시할 수 있을 것으로 기대된다. 이는 현재 사회적 약자들이 우울증 증상을 경험할 때 상담센터에 연락하는 등 스스로 능동적인 행동을 취해야만 도움을 받을 수 있는 문제를 해결해, 정신건강 관리의 새로운 패러다임을 제시할 것으로 보인다”고 말했다.
뇌인지과학과 김대욱 교수가 공동 제1 저자 및 교신저자로 참여한 이번 연구 결과는 국제 학술지 ‘npj Digital Medicine’ 12월 5일 온라인판에 게재됐다. (논문명: The real-world association between digital markers of circadian disruption and mental health risks) DOI: 10.1038/s41746-024-01348-6
한편 이번 연구는 KAIST 신임교원 연구지원사업, 미국 국립과학재단, 미국 국립보건원, 미국 육군연구소 MURI 프로그램의 지원을 받아 수행됐다.
정확한 우울증 예측 이제는 손목에서 가능하다
정신질환 팬데믹이 발생했다. 전 세계적으로 약 10억 명이 크고 작은 정신질환을 앓고 있다. 한국도 더욱 심각하여 현재 우울증 및 불안장애 환자는 약 180만 명이며 총 정신질환자는 5년 새 37% 증가하여 약 465만 명이다. 한미 공동 연구진이 웨어러블 기기를 통해 수집되는 생체 데이터를 활용해 내일의 기분을 예측하고, 나아가 우울증 증상의 발현 가능성을 예측하는 기술을 개발했다.
우리 대학 뇌인지과학과 김대욱 교수 연구팀이 미국 미시간 대학교 수학과 대니엘 포저(Daniel B. Forger) 교수팀과 공동연구로 스마트워치로부터 수집되는 활동량, 심박수 데이터로부터 교대 근무자의 수면 장애, 우울감, 식욕부진, 과식, 집중력 저하와 같은 우울증 관련 증상을 예측하는 기술을 개발했다고 15일 밝혔다.
WHO에 따르면 정신질환의 새로운 유망한 치료 방향은 충동성, 감정 반응, 의사 결정 및 전반적인 기분에 직접적인 영향을 주는 뇌 시상하부에 위치한 생체시계(circadian clock)와 수면(sleep stage)에 중점을 두는 것이다.
하지만 현재 내재적 생체리듬(endogenous circadian rhythms)과 수면 상태를 측정하기 위해서는 하룻밤 동안 30분 간격으로 피를 뽑아 우리 몸의 멜라토닌 호르몬 농도 변화를 측정하고 수면다원검사(polysomnography, PSG)를 수행해야 한다. 이 때문에 병원 입원이 불가피하여, 통원 치료를 받는 정신질환자가 대부분인 실제 의료 현장에서 두 요소를 고려한 치료법 개발은 지난 반세기 동안 큰 진전이 없었다. 더불어 검사 비용 또한 무시할 수 없어(PSG: 보험료 적용 없을 시 약 100만원) 사회적 약자는 현재 정신건강치료의 사각지대에 있다.
이러한 문제를 극복하기 위한 해결책은 공간의 제약 없이 실시간으로 심박수, 체온, 활동량 등 다양한 생체 데이터를 손쉽게 수집할 수 있다는 웨어러블 기기다. 그러나 현재 웨어러블 기기는 생체시계의 위상과 같은 의료 현장에서 필요로 하는 바이오마커(Biomarker)의 간접적인 정보만을 제공하는 한계를 가지고 있다.
공동연구팀은 스마트워치로부터 수집된 심박수와 활동량 시계열 데이터 등 매일 변화하는 생체시계의 위상을 정확히 추정하는 필터링(Filtering) 기술을 개발했다. 이는 뇌 속 일주기 리듬을 정밀하게 묘사하는 디지털 트윈(Digital twin)을 구현한 것으로, 이를 활용해 일주기 리듬 교란을 추정하는 데 활용될 수 있다.
이 생체시계 디지털 트윈의 우울증 증상 예측 활용 가능성을 미시간 대학교 신경과학 연구소의 스리잔 센(Srijan Sen) 교수 및 정신건강의학과의 에이미 보너트(Amy Bohnert) 교수 연구팀과의 협업을 통해 검증했다.
협업 연구팀은 약 800명의 교대 근무자가 참여한 대규모 전향 코호트 연구를 수행해 해당 기술을 통해 추정된 일주기 리듬 교란 디지털 바이오마커가 내일의 기분과 우울증의 대표적인 증상인 수면 문제, 식욕 변화, 집중력 저하, 자살 생각을 포함한 총 6가지 증상을 예측할 수 있음을 보였다.
김대욱 교수는 “수학을 활용해 그동안 잘 활용되지 못했던 웨어러블 생체 데이터를 실제 질병 관리에 적용할 수 있는 실마리를 제공하는 연구를 진행할 수 있어 매우 뜻깊다”라며, “이번 연구를 통해 연속적이고 비침습적인 정신건강 모니터링 기술을 제시할 수 있을 것으로 기대된다. 이는 현재 사회적 약자들이 우울증 증상을 경험할 때 상담센터에 연락하는 등 스스로 능동적인 행동을 취해야만 도움을 받을 수 있는 문제를 해결해, 정신건강 관리의 새로운 패러다임을 제시할 것으로 보인다”고 말했다.
뇌인지과학과 김대욱 교수가 공동 제1 저자 및 교신저자로 참여한 이번 연구 결과는 국제 학술지 ‘npj Digital Medicine’ 12월 5일 온라인판에 게재됐다. (논문명: The real-world association between digital markers of circadian disruption and mental health risks) DOI: 10.1038/s41746-024-01348-6
한편 이번 연구는 KAIST 신임교원 연구지원사업, 미국 국립과학재단, 미국 국립보건원, 미국 육군연구소 MURI 프로그램의 지원을 받아 수행됐다.
2025.01.15
조회수 3954
-
 홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14
조회수 4376
-
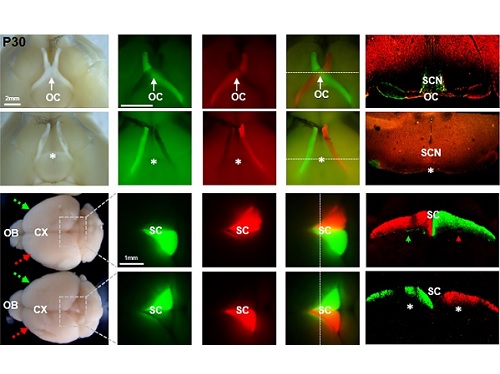 왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02
조회수 8597
-
 기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29
조회수 10799
-
 심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22
조회수 9974
-
 예종철 교수, 국제자기공명의과학회(ISMRM)에서 기조강연
〈 예종철 교수 〉
우리 대학 바이오및뇌공학과 예종철 교수가 5월 14일 캐나다 몬트리올에서 열린 제27회 ‘국제자기공명의과학회(ISMRM, International Society for Magnetic Resoance in Medicine) 연차 총회에서 기조 강연을 했다.
’의료인공지능(Machine Learning for Medical Imaging)‘을 주제로 강연을 한 예종철 교수는 인공지능을 이용한 고속 MRI 획득 및 복원 기술의 연구를 소개하고, 인공지능 블랙박스를 해석하기 위한 수학적 이론을 발표했다.
ISMRM 연차 총회는 전 세계 수 천명의 과학자와 의사들이 참여하는 자기공명영상(MRI) 분야 최대 학회이다.
예 교수는 방사선학 분야 대표 언론 AuntMinnie.com과 총회 이후 진행된 인터뷰를 통해 “인공지능이 단지 진단의 영역을 넘어 기존에 불가능했던 고화질의 영상을 만들어 의사들의 진단을 더욱 정확하게 하는 새 방향으로 급격히 발전하고 있다”라고 말했다.
예종철 교수, 국제자기공명의과학회(ISMRM)에서 기조강연
〈 예종철 교수 〉
우리 대학 바이오및뇌공학과 예종철 교수가 5월 14일 캐나다 몬트리올에서 열린 제27회 ‘국제자기공명의과학회(ISMRM, International Society for Magnetic Resoance in Medicine) 연차 총회에서 기조 강연을 했다.
’의료인공지능(Machine Learning for Medical Imaging)‘을 주제로 강연을 한 예종철 교수는 인공지능을 이용한 고속 MRI 획득 및 복원 기술의 연구를 소개하고, 인공지능 블랙박스를 해석하기 위한 수학적 이론을 발표했다.
ISMRM 연차 총회는 전 세계 수 천명의 과학자와 의사들이 참여하는 자기공명영상(MRI) 분야 최대 학회이다.
예 교수는 방사선학 분야 대표 언론 AuntMinnie.com과 총회 이후 진행된 인터뷰를 통해 “인공지능이 단지 진단의 영역을 넘어 기존에 불가능했던 고화질의 영상을 만들어 의사들의 진단을 더욱 정확하게 하는 새 방향으로 급격히 발전하고 있다”라고 말했다.
2019.05.22
조회수 9995
-
 강창원 교수, 대전 MBC 주관 '2011 한빛대상' 수상
우리 학교 생명과학과 강창원 교수가 대전 MBC에서 주관하는 "2011 한빛대상" 수상자로 선정됐다.
부문별 수상자는 ▲과학기술 부문 강창원(60) KAIST 생명과학부 교수 ▲사회봉사 부문 이승호(47) 경북한의원 원장 ▲효행다문화 부문 주부 문유경(35)씨 ▲문화예술체육 부문 노덕일(70) 한국관악협회 회장 ▲지역경제발전 부문 한형기(58) ㈜SAC 대표이사 ▲특별상 부문 김영한(91) 향토사학자 등이다.
강창원 교수는 주의력결핍 과잉행동장애(ADHD)의 질병원인 유전자를 발굴하고 의학 최고권위지 네이처 메디슨(Nature Medicine)에 발표했다.
시상식은 29일 오후 6시 50분 대전 MBC 공개홀에서 가졌으며, 수상자에게는 상패와 상금 1천만원씩이 수여된다.
한편, 한빛대상은 대전·충남지역 각 분야에서 봉사하고 공헌한 숨은 일꾼을 찾아 널리 알리고 지역민들과 함께 보람을 나누기 위한 행사로, 대전 MBC는 2005년에 이 상을 제정했다.
강창원 교수, 대전 MBC 주관 '2011 한빛대상' 수상
우리 학교 생명과학과 강창원 교수가 대전 MBC에서 주관하는 "2011 한빛대상" 수상자로 선정됐다.
부문별 수상자는 ▲과학기술 부문 강창원(60) KAIST 생명과학부 교수 ▲사회봉사 부문 이승호(47) 경북한의원 원장 ▲효행다문화 부문 주부 문유경(35)씨 ▲문화예술체육 부문 노덕일(70) 한국관악협회 회장 ▲지역경제발전 부문 한형기(58) ㈜SAC 대표이사 ▲특별상 부문 김영한(91) 향토사학자 등이다.
강창원 교수는 주의력결핍 과잉행동장애(ADHD)의 질병원인 유전자를 발굴하고 의학 최고권위지 네이처 메디슨(Nature Medicine)에 발표했다.
시상식은 29일 오후 6시 50분 대전 MBC 공개홀에서 가졌으며, 수상자에게는 상패와 상금 1천만원씩이 수여된다.
한편, 한빛대상은 대전·충남지역 각 분야에서 봉사하고 공헌한 숨은 일꾼을 찾아 널리 알리고 지역민들과 함께 보람을 나누기 위한 행사로, 대전 MBC는 2005년에 이 상을 제정했다.
2011.10.04
조회수 11520
 정확한 우울증 예측 이제는 손목에서 가능하다
정신질환 팬데믹이 발생했다. 전 세계적으로 약 10억 명이 크고 작은 정신질환을 앓고 있다. 한국도 더욱 심각하여 현재 우울증 및 불안장애 환자는 약 180만 명이며 총 정신질환자는 5년 새 37% 증가하여 약 465만 명이다. 한미 공동 연구진이 웨어러블 기기를 통해 수집되는 생체 데이터를 활용해 내일의 기분을 예측하고, 나아가 우울증 증상의 발현 가능성을 예측하는 기술을 개발했다.
우리 대학 뇌인지과학과 김대욱 교수 연구팀이 미국 미시간 대학교 수학과 대니엘 포저(Daniel B. Forger) 교수팀과 공동연구로 스마트워치로부터 수집되는 활동량, 심박수 데이터로부터 교대 근무자의 수면 장애, 우울감, 식욕부진, 과식, 집중력 저하와 같은 우울증 관련 증상을 예측하는 기술을 개발했다고 15일 밝혔다.
WHO에 따르면 정신질환의 새로운 유망한 치료 방향은 충동성, 감정 반응, 의사 결정 및 전반적인 기분에 직접적인 영향을 주는 뇌 시상하부에 위치한 생체시계(circadian clock)와 수면(sleep stage)에 중점을 두는 것이다.
하지만 현재 내재적 생체리듬(endogenous circadian rhythms)과 수면 상태를 측정하기 위해서는 하룻밤 동안 30분 간격으로 피를 뽑아 우리 몸의 멜라토닌 호르몬 농도 변화를 측정하고 수면다원검사(polysomnography, PSG)를 수행해야 한다. 이 때문에 병원 입원이 불가피하여, 통원 치료를 받는 정신질환자가 대부분인 실제 의료 현장에서 두 요소를 고려한 치료법 개발은 지난 반세기 동안 큰 진전이 없었다. 더불어 검사 비용 또한 무시할 수 없어(PSG: 보험료 적용 없을 시 약 100만원) 사회적 약자는 현재 정신건강치료의 사각지대에 있다.
이러한 문제를 극복하기 위한 해결책은 공간의 제약 없이 실시간으로 심박수, 체온, 활동량 등 다양한 생체 데이터를 손쉽게 수집할 수 있다는 웨어러블 기기다. 그러나 현재 웨어러블 기기는 생체시계의 위상과 같은 의료 현장에서 필요로 하는 바이오마커(Biomarker)의 간접적인 정보만을 제공하는 한계를 가지고 있다.
공동연구팀은 스마트워치로부터 수집된 심박수와 활동량 시계열 데이터 등 매일 변화하는 생체시계의 위상을 정확히 추정하는 필터링(Filtering) 기술을 개발했다. 이는 뇌 속 일주기 리듬을 정밀하게 묘사하는 디지털 트윈(Digital twin)을 구현한 것으로, 이를 활용해 일주기 리듬 교란을 추정하는 데 활용될 수 있다.
이 생체시계 디지털 트윈의 우울증 증상 예측 활용 가능성을 미시간 대학교 신경과학 연구소의 스리잔 센(Srijan Sen) 교수 및 정신건강의학과의 에이미 보너트(Amy Bohnert) 교수 연구팀과의 협업을 통해 검증했다.
협업 연구팀은 약 800명의 교대 근무자가 참여한 대규모 전향 코호트 연구를 수행해 해당 기술을 통해 추정된 일주기 리듬 교란 디지털 바이오마커가 내일의 기분과 우울증의 대표적인 증상인 수면 문제, 식욕 변화, 집중력 저하, 자살 생각을 포함한 총 6가지 증상을 예측할 수 있음을 보였다.
김대욱 교수는 “수학을 활용해 그동안 잘 활용되지 못했던 웨어러블 생체 데이터를 실제 질병 관리에 적용할 수 있는 실마리를 제공하는 연구를 진행할 수 있어 매우 뜻깊다”라며, “이번 연구를 통해 연속적이고 비침습적인 정신건강 모니터링 기술을 제시할 수 있을 것으로 기대된다. 이는 현재 사회적 약자들이 우울증 증상을 경험할 때 상담센터에 연락하는 등 스스로 능동적인 행동을 취해야만 도움을 받을 수 있는 문제를 해결해, 정신건강 관리의 새로운 패러다임을 제시할 것으로 보인다”고 말했다.
뇌인지과학과 김대욱 교수가 공동 제1 저자 및 교신저자로 참여한 이번 연구 결과는 국제 학술지 ‘npj Digital Medicine’ 12월 5일 온라인판에 게재됐다. (논문명: The real-world association between digital markers of circadian disruption and mental health risks) DOI: 10.1038/s41746-024-01348-6
한편 이번 연구는 KAIST 신임교원 연구지원사업, 미국 국립과학재단, 미국 국립보건원, 미국 육군연구소 MURI 프로그램의 지원을 받아 수행됐다.
2025.01.15 조회수 3954
정확한 우울증 예측 이제는 손목에서 가능하다
정신질환 팬데믹이 발생했다. 전 세계적으로 약 10억 명이 크고 작은 정신질환을 앓고 있다. 한국도 더욱 심각하여 현재 우울증 및 불안장애 환자는 약 180만 명이며 총 정신질환자는 5년 새 37% 증가하여 약 465만 명이다. 한미 공동 연구진이 웨어러블 기기를 통해 수집되는 생체 데이터를 활용해 내일의 기분을 예측하고, 나아가 우울증 증상의 발현 가능성을 예측하는 기술을 개발했다.
우리 대학 뇌인지과학과 김대욱 교수 연구팀이 미국 미시간 대학교 수학과 대니엘 포저(Daniel B. Forger) 교수팀과 공동연구로 스마트워치로부터 수집되는 활동량, 심박수 데이터로부터 교대 근무자의 수면 장애, 우울감, 식욕부진, 과식, 집중력 저하와 같은 우울증 관련 증상을 예측하는 기술을 개발했다고 15일 밝혔다.
WHO에 따르면 정신질환의 새로운 유망한 치료 방향은 충동성, 감정 반응, 의사 결정 및 전반적인 기분에 직접적인 영향을 주는 뇌 시상하부에 위치한 생체시계(circadian clock)와 수면(sleep stage)에 중점을 두는 것이다.
하지만 현재 내재적 생체리듬(endogenous circadian rhythms)과 수면 상태를 측정하기 위해서는 하룻밤 동안 30분 간격으로 피를 뽑아 우리 몸의 멜라토닌 호르몬 농도 변화를 측정하고 수면다원검사(polysomnography, PSG)를 수행해야 한다. 이 때문에 병원 입원이 불가피하여, 통원 치료를 받는 정신질환자가 대부분인 실제 의료 현장에서 두 요소를 고려한 치료법 개발은 지난 반세기 동안 큰 진전이 없었다. 더불어 검사 비용 또한 무시할 수 없어(PSG: 보험료 적용 없을 시 약 100만원) 사회적 약자는 현재 정신건강치료의 사각지대에 있다.
이러한 문제를 극복하기 위한 해결책은 공간의 제약 없이 실시간으로 심박수, 체온, 활동량 등 다양한 생체 데이터를 손쉽게 수집할 수 있다는 웨어러블 기기다. 그러나 현재 웨어러블 기기는 생체시계의 위상과 같은 의료 현장에서 필요로 하는 바이오마커(Biomarker)의 간접적인 정보만을 제공하는 한계를 가지고 있다.
공동연구팀은 스마트워치로부터 수집된 심박수와 활동량 시계열 데이터 등 매일 변화하는 생체시계의 위상을 정확히 추정하는 필터링(Filtering) 기술을 개발했다. 이는 뇌 속 일주기 리듬을 정밀하게 묘사하는 디지털 트윈(Digital twin)을 구현한 것으로, 이를 활용해 일주기 리듬 교란을 추정하는 데 활용될 수 있다.
이 생체시계 디지털 트윈의 우울증 증상 예측 활용 가능성을 미시간 대학교 신경과학 연구소의 스리잔 센(Srijan Sen) 교수 및 정신건강의학과의 에이미 보너트(Amy Bohnert) 교수 연구팀과의 협업을 통해 검증했다.
협업 연구팀은 약 800명의 교대 근무자가 참여한 대규모 전향 코호트 연구를 수행해 해당 기술을 통해 추정된 일주기 리듬 교란 디지털 바이오마커가 내일의 기분과 우울증의 대표적인 증상인 수면 문제, 식욕 변화, 집중력 저하, 자살 생각을 포함한 총 6가지 증상을 예측할 수 있음을 보였다.
김대욱 교수는 “수학을 활용해 그동안 잘 활용되지 못했던 웨어러블 생체 데이터를 실제 질병 관리에 적용할 수 있는 실마리를 제공하는 연구를 진행할 수 있어 매우 뜻깊다”라며, “이번 연구를 통해 연속적이고 비침습적인 정신건강 모니터링 기술을 제시할 수 있을 것으로 기대된다. 이는 현재 사회적 약자들이 우울증 증상을 경험할 때 상담센터에 연락하는 등 스스로 능동적인 행동을 취해야만 도움을 받을 수 있는 문제를 해결해, 정신건강 관리의 새로운 패러다임을 제시할 것으로 보인다”고 말했다.
뇌인지과학과 김대욱 교수가 공동 제1 저자 및 교신저자로 참여한 이번 연구 결과는 국제 학술지 ‘npj Digital Medicine’ 12월 5일 온라인판에 게재됐다. (논문명: The real-world association between digital markers of circadian disruption and mental health risks) DOI: 10.1038/s41746-024-01348-6
한편 이번 연구는 KAIST 신임교원 연구지원사업, 미국 국립과학재단, 미국 국립보건원, 미국 육군연구소 MURI 프로그램의 지원을 받아 수행됐다.
2025.01.15 조회수 3954 홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 4376
홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 4376 왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8597
왼쪽 눈이 본 것을 오른쪽 뇌가 알게 하라
인간을 비롯한 대부분 동물의 신체 기관들은 대칭적 구조를 가지고 있다. 이를 통해 몸의 좌우 균형을 맞추고, 움직이고, 반응을 할 수 있게 된다. 동물의 시각이 시작되는 안구 역시 머리의 양쪽에 하나씩 위치하며 한쪽 눈으로 볼 때 보다 더 넓은 영역의 물체를 인식할 수 있게 된다. 사람이나 고양이 같은 경우는 양쪽 눈이 정면을 향하고 있고, 개나 쥐 같은 동물은 눈이 사람보다 측면부를 향해 있고, 많은 물고기의 경우는 두 눈이 완전히 반대쪽을 향하고 있다. 이로 인해 좌우측 눈이 받아들이는 이미지 역시 차이를 보이게 된다. 인간의 경우 좌측과 우측 눈이 인식하는 이미지의 50%에 가까운 영역이 겹치는 반면, 생쥐의 경우는 5% 이하의 영역이 중복이 되며, 물고기는 중복된 영역이 거의 없다. 이들 겹치는 시각 영역 이미지의 위상차를 뇌가 인식해 동물은 물체의 입체감을 느낄 수 있다. 또, 물체가 움직이는 경우에는 좌측 눈과 우측 눈에 감지된 물체의 이미지의 시간차 정보가 뇌에서 처리되어 물체의 이동 경로를 감지하고 예측할 수 있게 된다. 결국, 중복된 시각 영역이 넓을수록 외부 물체의 입체감과 이동을 더 잘 감지할 수 있게 되어, 대부분 포식 동물들이 넓은 중복 영역을 확보하기 위해 안구를 정면에 위치하는 경우가 많다.
이렇게 좌우 안구에서 인식된 이미지를 뇌의 특정 영역에 전달하기 위해 눈에서 나온 시신경은 뇌의 좌우 반구에 모두 연결이 되어 있다. 흥미롭게 좌우 반구로 연결되는 시신경 비율은 좌우 안구 이미지의 중복 비율에 역비례해서, 인간의 경우 50% 시신경이 반대쪽 뇌로 연결되고, 생쥐의 경우 95% 내외, 물고기는 100% 반대쪽으로 연결된다. 시신경이 좌측 또는 우측 중 어느 쪽 뇌로 뻗어 나갈 것인지를 결정하는 과정은 시신경이 눈에서 출발해 시상하부 영역에 도달할 때 시상하부 중간선에 존재하는 경로 결정자(pathway selection cue)에 의해 일어난다고 알려져 있다. 오랜 동안 이러한 동물의 양안 시각계 (binocular visual system)의 핵심인 시상하부 중간선에서 경로 결정에 관련된 메커니즘을 이해하려는 시도가 있어 왔고 일부 경로 결정 인자들이 밝혀진 바도 있다. 하지만, 핵심인자의 부재로 이 과정에 대한 명확한 이해는 부족한 상황이었다.
생명과학과 김진우 교수 연구실에서는 시신경 및 시상하부 중간선에 많이 발현되는 VAX1 유전자에 대한 연구를 수행해 오고 있다. 이 유전자가 결핍된 생쥐와 사람은 시신경이 제대로 성장하지 못하고 시신경이 시상하부에서 교차하지 못하는 발달 이상을 보였다. VAX1이 호메오도메인을 가지는 전사인자의 특성을 가지고 있기 때문에 당연히 시상하부에서 경로 결정자의 유전자 발현을 조절해 시신경 교차(optic chiasm)를 생성할 것이라고 추정하였으나, 김교수 연구팀에서는 VAX1이 시상하부 세포에서 전사인자로 기능하기 보다는 눈의 망막신경절세포에서 뻗어 나온 시신경 축삭(axon)에서 mRNA 번역인자로 작용하여 시신경의 성장을 유도한다는 놀라운 사실을 발견하여 2014년 발표한 바 있다. 하지만, VAX1이 전혀 없는 동물은 두개골 기형 때문에 생존하기 어려워 이러한 VAX1 이상으로 인해 시신경 교차가 없는 동물의 시각 반응 및 행동에 대한 이해는 이루어지지 못하고 있었다.
김 교수 연구실에서 VAX1의 전사인자 기능은 유지한 채 시신경 축삭에 작용하지 못하는 VAX1(AA) 생쥐를 제작하였고, 이 생쥐는 외형적 이상이 전혀 없이 정상적으로 태어나 성장하였다. 다만, VAX1(AA) 생쥐는 모든 시신경이 안구와 같은 쪽 뇌에만 연결되는 시신경 교차 결핍증(agenesis of optic chiasm, AOC)을 나타냈다. 이 생쥐의 시각을 다양한 방법을 통해 검증한 결과, 눈 속의 신경 조직인 망막이 빛을 감지하는 기능은 정상이나 입체 시각이 전혀 없었고, 시력 역시 저하되어 있었다.
흥미로운 점은 VAX1(AA) 생쥐의 눈이 아무런 자극이 없는 상태에서도 지속적으로 상하궤도 운동을 하는 시소안구진탕증(Seesaw Nystagmus)를 보인다는 것이었다. 이러한 시소안구진탕증은 시신경 교차에 이상이 있는 사람과 벨지안쉽도그(Belgian sheepdog)에서도 관찰이 된 바 있어서 시신경 교차 결여가 VAX1(AA) 생쥐의 안구 운동 이상의 원인임을 알 수 있었다.
더욱 흥미로운 점은 VAX1(AA) 생쥐의 시각 운동 반응이 반전되어 있다는 점이었다. 왼쪽 눈에 빛을 주면 오른쪽 동공이 먼저 축소되고, 물체 이동을 감지한 후에는 움직이던 눈이 오히려 정면을 응시하는 등, 시각 정보와 반대되는 안구의 움직임을 보였다. VAX1(AA) 생쥐는 시신경 교차에만 이상이 있고 시각을 처리하는 뇌 부위는 정상적으로 형성이 되어 있기 때문에, 이 결과는 우측 눈에서 오는 신호를 처리해 우측 눈으로 운동 정보를 보내야 할 좌측뇌가 정작 좌측 눈에서 오는 신호를 받아 우측 눈을 자극하는 입력-출력 반전(input-output inversion) 현상 때문으로 해석되었다. 하지만, 아직 VAX1(AA) 생쥐의 좌측 눈에서 들어 온 시각 신호가 어떤 뇌 부위를 안구로 다시 전달되는지에 대한 정보가 거의 전무하기 때문에 이러한 반전된 시각-운동 신경망에 대한 이해는 부족한 상황이다. 이를 해결하기 위해 김교수팀은 시각 자극을 받은 VAX1(AA) 생쥐의 뇌를 자기 공명 영상 분석하는 공동 연구를 시작하였다. 이 연구를 통해 동물의 시각 정보가 어떤 경로로 뇌에서 처리되어 운동 신경을 활성화 할 수 있는지에 대한 이해를 심화할 수 있을 것으로 기대한다.
이번 연구는 국제학술지인 Experimental & Molecular Medicine (https://doi.org/10.1038/s12276-023-00930-4) 2월3일자로 발표됐다. KAIST 생명과학과 김진우 교수 연구팀 민광욱 박사가 제1저자로 연구를 주도하였고, 생명과학과 이승희 교수 연구팀, 바이오및뇌공학과 박영균 교수 연구팀, 연세대학교 이한웅 교수 연구팀, 한국뇌연구원 김남석 박사, 기초과학연구원 이창준 박사 연구팀이 함께 참여하였다. 본 연구는 과학기술정보통신부 중견연구자연구지원사업과 선도연구센터사업, 그리고 KAIST 국제공동연구지원사업의 지원을 받아 수행됐다.
2023.03.02 조회수 8597 기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 10799
기저 질환이 없는 코로나19 환자의 중증 신규 유전적 위험 인자 규명
우리 대학 생명과학과 정인경 교수 연구팀이 서울대병원 강창경, 고영일, 분당서울대병원 송경호 교수, 경북대병원 문준호 교수, 국립중앙의료원 이지연 교수, 지놈오피니언 社로 이루어진 산·학·병 공동연구를 통해 기저 질환이 없는 저위험군의 신규 코로나19 중증 위험 인자를 발굴하고, 발굴된 인자의 과잉 염증반응에 대한 분자 메커니즘을 제시했다고 29일 밝혔다.
코로나19 바이러스(SARS-CoV2)는 지난 2년이 넘도록 확산하면서 전 세계적으로 6억 명 이상이 감염됐고, 이 중 6백만 명 이상이 사망했다. 이러한 심각성으로 인해 코로나19 바이러스의 병리에 관한 연구가 활발히 진행됐고, 단핵구(큰 크기의 백혈구, Monocyte)의 과잉 염증반응으로 인한 중증 진행 메커니즘 등이 밝혀졌다.
하지만 개별 코로나19 환자마다 면역 반응의 편차가 크게 나타나는 현상에 대해서는 앞서 찾은 연구 결과만으로는 전부 설명할 수 없다. 예를 들어 중증 코로나19 환자 중에서 당뇨병이나 고혈압 등의 기저 질환이 없는 경우도 빈번하기에 이들이 코로나19 감염 시 중증으로 진행될 수 있는 신규 위험 인자를 발굴하는 것은 환자 맞춤형 치료에 있어 매우 중요하다.
우리 대학 생명과학과 최백규, 박성완 석박사통합과정과 서울대병원 강창경 교수가 주도한 이번 연구에서는 기존의 기저 질환이 없는 중증 코로나19 환자의 중증 요인을 알아내기 위해, 국내 4개의 병원이 합동해 총 243명의 코로나19 환자의 임상 정보를 수집 및 분석했다. 연구팀은 그 집단의 임상적 특징을 밝히고, 단일세포 유전자 발현 분석과 후성유전학적 분석을 도입해 관찰된 임상적 특징과 중증 코로나19 내 과잉 염증반응 간의 유전자 발현 조절 메커니즘을 분석했다.
그 결과, 기저 질환이 없는 집단 내 중증 환자는 `클론성조혈증'이라는 특징을 가지고 있는 것을 관찰하였다. 이는 혈액 및 면역 세포를 형성하는 골수 줄기세포 중 후천적 유전자 변이가 있는 집단을 의미한다. 또한 단일세포 유전자 발현 분석을 통해 클론성조혈증을 가진 중증 환자의 경우 단핵구에서 특이적인 과잉 염증반응이 관찰되는 것을 확인했고, 클론성조혈증으로 인해 변화한 후성유전학적 특징이 단핵구 특이적인 과잉 염증반응을 일으키는 유전자 발현을 유도하는 것을 연구팀은 확인했다.
해외 연구단에서도 유사하게 클론성조혈증과 코로나19 간의 관련성에 주목한 연구들이 있었으나 코로나19와의 관련성을 명확히 밝히지 못했고, 과잉 염증반응으로 이어지는 분자 모델 역시 제시하지 못했다. 이에 반해 공동 연구팀은 생물정보학 기반 계층화된 환자 분류법과 환자 유래 다양한 면역 세포를 단 하나의 세포 수준에서 유전자 발현 패턴 및 조절 기전을 해석할 수 있는 단일세포 오믹스 생물학 기법을 적용해 클론성조혈증이 코로나19의 신규 중증 인자임을 명확하게 제시했다. 해당 연구 결과는 앞으로 기저질환이 없는 저위험군 환자라도 클론성조혈증을 갖는 경우 코로나19 감염 시 보다 체계적인 치료 및 관리가 필요함을 의미한다.
이번 연구 결과는 두 개의 국제 학술지, `헤마톨로지카(haematologica, IF=11.04)'에 9월 15일 字 (논문명: Clinical impact of clonal hematopoiesis on severe COVID-19 patients without canonical risk factors) 온라인 게재가 되었으며. ‘실험 및 분자 의학(Experimental & Molecular Medicine, IF=11.590)'에 지난 8월 1일 字 (논문명: Single-cell transcriptome analyses reveal distinct gene expression signatures of severe COVID-19 in the presence of clonal hematopoiesis) 게재 승인됐다.
이번 연구는 장기화된 코로나19 팬데믹 상황 속에서 연구계·의료계·산업계로 이루어진 연구팀 서로 간의 긴밀한 협력을 통해 코로나19 환자의 신규 중증 인자를 밝히고, 그에 대한 분자적 기전을 제시해 환자별 맞춤 치료전략을 제시한 연구로 중개 연구(translational research)의 좋은 예시로 평가받는다.
이번 연구를 수행한 우리 대학 최백규 석박사통합과정은 "최신의 분자실험 기법인 단일세포 오믹스 실험과 생물정보학 분석 기술의 융합이 신규 코로나19 중증 환자의 아형과 관련 유전자 조절 기전을 규명 가능케 하였다ˮ며, "다른 질환에도 바이오 데이터 기반 융합 연구 기법을 적용할 것이다ˮ고 말했다.
분당서울대병원 송경호 교수는 "이번 연구는 임상 현장에서 코로나 환자별 맞춤 치료 전략을 정립하는 데 있어서 중요한 정보를 제공한 연구ˮ라며 "앞으로도 중증 코로나19 환자의 생존율을 높이기 위해 임상 정보를 바탕으로 한 맞춤 치료전략 연구를 이어나가겠다ˮ라고 밝혔다.
지놈오피니언 대표를 겸임하고 있는 서울대병원 고영일 교수는 "회사에서 개발한 클론성조혈증 탐지 및 분석 기술이 코로나19 팬데믹 해결에 도움이 되어 보람차다ˮ면서 "앞으로도 새로운 바이오마커를 발굴 및 분석하는 기술을 개발해 인류의 건강한 삶에 지속적으로 기여하고 싶다ˮ고 말했다.
한편 이번 연구는 서경배과학재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2022.09.29 조회수 10799 심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 9974
심각한 염증 부작용 없앤 새로운 알츠하이머병 치료제 개발
우리 대학 생명과학과 김찬혁, 정원석 교수 공동연구팀이 알츠하이머병에 대한 새로운 형태의 단백질 치료제를 개발했다고 22일 밝혔다.
연구팀은 세포 포식작용에 관여하는 단백질을 응용한 `Gas6 융합단백질'을 제작하고 이를 통해 알츠하이머병을 유발하는 베타 아밀로이드 플라크(단백질 응집체)를 제거할 수 있는 새로운 형태의 치료제를 개발했다. 기존의 베타 아밀로이드를 표적으로 하는 항체 기반 치료제가 불확실한 치료 효과와 더불어 심각한 부작용을 일으키는 것이 보고되고 있는 가운데, 이를 근본적으로 극복할 수 있는 새로운 방식의 치료제를 연구팀은 제작한 것이다. 또한 해당 접근법은 향후 다양한 퇴행성 뇌 질환 및 자가면역질환 치료에 폭넓게 응용될 수 있을 것으로 기대된다.
생명과학과 박사과정 정현철, 이세영 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 메디슨 (Nature Medicine)' 8월 4일 字 온라인 출판됐다. (논문명 : Anti-inflammatory clearance of amyloid beta by a chimeric Gas6 fusion protein).
알츠하이머병은 기억상실과 인지장애를 동반하는 노인성 치매의 대표적 원인이다. 최근 국내 언론에 잘못 알려진 바와는 달리, 알츠하이머병은 뇌에 쌓이는 베타 아밀로이드 응집체 (비정상적으로 39~43개의 아미노산으로 잘려진 아밀로이드 조각들의 응집체)에 의한 시냅스 손상과 세포 독성으로 발병한다는 것이 학계 및 의료계의 정설이다. 이러한 정설에 의구심이 일었던 것은 아직까지 수많은 노력에도 불구하고 베타 아밀로이드를 제거하는 알츠하이머병 치료제가 성공적으로 개발되지 못했기 때문이었다. 최근 베타 아밀로이드를 표적으로 하는 항체 기반 치료제인 아두헬름이 사상 처음으로 알츠하이머병의 근원 치료제로써 2021년 6월 미국에서 FDA 승인이 이뤄졌으나, 치료 효과 및 부작용에 관한 논란이 여전히 지속되고 있다.
아두헬름과 같은 항체 기반의 치료제를 처방받은 알츠하이머병 환자들에게서 나타나는 가장 큰 부작용은 뇌 부종 (ARIA-E) 및 뇌 미세혈관출혈 (ARIA-H)이다. 이러한 부작용은 뇌 염증과 밀접하게 관련돼 있는데, 이는 항체 기반 치료제들이 면역세포에서 발현되는 Fc 수용체를 통해 필연적으로 염증반응을 일으키기 때문으로 알려져 있다. 이 Fc 수용체는 다른 한편으로는 면역세포가 항체에 의한 포식작용을 통해 베타 아밀로이드 응집체를 제거하는데 필수적인 기능을 한다. 따라서 심각한 염증 부작용을 근본적으로 예방하면서 베타 아밀로이드 응집체를 효과적으로 제거하는 치료제를 개발하는 것은 알츠하이머병 치료의 오랜 딜레마였다.
연구팀은 이러한 문제를 기존 항체의 틀에서 벗어나 새로운 기전의 단백질 치료제를 디자인함으로써 해결했다. 우리 몸에는 끊임없이 죽어 나가는 세포들을 제거하기 위한 특수한 포식작용 경로가 존재하는데, 연구팀은 이에 관여하는 Gas6라는 단백질을 인위적으로 조작해 베타 아밀로이드를 표적으로 하는 융합단백질을 제작했다. 연구팀은 실험을 통해 이 융합단백질(anti-Abeta-Gas6)이 뇌 안에서 선택적으로 베타 아밀로이드를 제거함과 동시에 염증반응을 오히려 억제한다는 것을 증명했다.
또한 알츠하이머 질병 쥐 모델을 통해 연구팀이 개발한 융합단백질이 미세아교세포와 별아교세포를 동시에 활용해 뇌 속에 축적된 베타 아밀로이드의 양을 현저하게 줄이는 것을 발견했다. 이는 기존의 항체 치료제가 미세아교세포를 통해서만 베타 아밀로이드를 줄일 수 있는 것에 비해 뚜렷한 이점으로 보인다. 동시에 연구팀은 Gas6 융합단백질이 항체 치료제에 의해서 더 악화되는 미세아교세포에 의한 과도한 시냅스 제거 현상을 획기적으로 억제할 수 있음을 밝혔다. 더 나아가, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 손상된 인지능력 및 기억력이 항체 치료제보다도 높은 수준으로 회복되는 결과도 확인했다.
추가로 기존의 항체 기반 치료제를 처방받은 알츠하이머 환자에게서 나타났던 부작용인 뇌 미세혈관 출혈도, Gas6 융합단백질을 주입한 알츠하이머 질병 쥐 모델에서는 현저하게 감소하는 것을 연구팀은 증명했다.
따라서 연구팀이 개발한 융합단백질은 새로운 형태의 작용기전을 적용한 최초의 알츠하이머 질병 치료제이며, 이러한 형태의 치료제는 다양한 퇴행성 뇌 질환 및 자가 면역질환에 적용될 수 있을 것으로 기대된다.
연구팀은 "지금까지 많은 항체 기반 치료제가 성공하지 못했던 이유는 뇌 조직 및 혈관에 쌓이는 베타 아밀로이드가 올바른 방식으로 청소되지 않았기 때문ˮ이라며 "Gas6 융합단백질을 통해서는 베타 아밀로이드가 염증반응 없이 청소되기 때문에 부작용이 낮을 뿐만 아니라 높은 인지기능의 향상도 기대할 수 있을 것ˮ이라고 말했다.
연구팀은 이번 Gas6 융합단백질 치료기술을 기반으로 2021년 8월에 일리미스테라퓨틱스(Illimis Therapeutics, 대표이사: 박상훈)를 설립했고, 향후 이를 통해 베타 아밀로이드를 표적으로 하는 알츠하이머 치료제(GAIA-Abeta, ILM01) 개발뿐 아니라, 표적을 타우 등으로 치환하는 치료제도 개발하여 다양한 확장 및 임상 개발을 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 사업(프렙과제) 및 치매극복연구개발사업단 (KDRC, 단장: 묵인희)의 지원을 받아 수행됐다.
2022.08.22 조회수 9974 예종철 교수, 국제자기공명의과학회(ISMRM)에서 기조강연
〈 예종철 교수 〉
우리 대학 바이오및뇌공학과 예종철 교수가 5월 14일 캐나다 몬트리올에서 열린 제27회 ‘국제자기공명의과학회(ISMRM, International Society for Magnetic Resoance in Medicine) 연차 총회에서 기조 강연을 했다.
’의료인공지능(Machine Learning for Medical Imaging)‘을 주제로 강연을 한 예종철 교수는 인공지능을 이용한 고속 MRI 획득 및 복원 기술의 연구를 소개하고, 인공지능 블랙박스를 해석하기 위한 수학적 이론을 발표했다.
ISMRM 연차 총회는 전 세계 수 천명의 과학자와 의사들이 참여하는 자기공명영상(MRI) 분야 최대 학회이다.
예 교수는 방사선학 분야 대표 언론 AuntMinnie.com과 총회 이후 진행된 인터뷰를 통해 “인공지능이 단지 진단의 영역을 넘어 기존에 불가능했던 고화질의 영상을 만들어 의사들의 진단을 더욱 정확하게 하는 새 방향으로 급격히 발전하고 있다”라고 말했다.
2019.05.22 조회수 9995
예종철 교수, 국제자기공명의과학회(ISMRM)에서 기조강연
〈 예종철 교수 〉
우리 대학 바이오및뇌공학과 예종철 교수가 5월 14일 캐나다 몬트리올에서 열린 제27회 ‘국제자기공명의과학회(ISMRM, International Society for Magnetic Resoance in Medicine) 연차 총회에서 기조 강연을 했다.
’의료인공지능(Machine Learning for Medical Imaging)‘을 주제로 강연을 한 예종철 교수는 인공지능을 이용한 고속 MRI 획득 및 복원 기술의 연구를 소개하고, 인공지능 블랙박스를 해석하기 위한 수학적 이론을 발표했다.
ISMRM 연차 총회는 전 세계 수 천명의 과학자와 의사들이 참여하는 자기공명영상(MRI) 분야 최대 학회이다.
예 교수는 방사선학 분야 대표 언론 AuntMinnie.com과 총회 이후 진행된 인터뷰를 통해 “인공지능이 단지 진단의 영역을 넘어 기존에 불가능했던 고화질의 영상을 만들어 의사들의 진단을 더욱 정확하게 하는 새 방향으로 급격히 발전하고 있다”라고 말했다.
2019.05.22 조회수 9995 강창원 교수, 대전 MBC 주관 '2011 한빛대상' 수상
우리 학교 생명과학과 강창원 교수가 대전 MBC에서 주관하는 "2011 한빛대상" 수상자로 선정됐다.
부문별 수상자는 ▲과학기술 부문 강창원(60) KAIST 생명과학부 교수 ▲사회봉사 부문 이승호(47) 경북한의원 원장 ▲효행다문화 부문 주부 문유경(35)씨 ▲문화예술체육 부문 노덕일(70) 한국관악협회 회장 ▲지역경제발전 부문 한형기(58) ㈜SAC 대표이사 ▲특별상 부문 김영한(91) 향토사학자 등이다.
강창원 교수는 주의력결핍 과잉행동장애(ADHD)의 질병원인 유전자를 발굴하고 의학 최고권위지 네이처 메디슨(Nature Medicine)에 발표했다.
시상식은 29일 오후 6시 50분 대전 MBC 공개홀에서 가졌으며, 수상자에게는 상패와 상금 1천만원씩이 수여된다.
한편, 한빛대상은 대전·충남지역 각 분야에서 봉사하고 공헌한 숨은 일꾼을 찾아 널리 알리고 지역민들과 함께 보람을 나누기 위한 행사로, 대전 MBC는 2005년에 이 상을 제정했다.
2011.10.04 조회수 11520
강창원 교수, 대전 MBC 주관 '2011 한빛대상' 수상
우리 학교 생명과학과 강창원 교수가 대전 MBC에서 주관하는 "2011 한빛대상" 수상자로 선정됐다.
부문별 수상자는 ▲과학기술 부문 강창원(60) KAIST 생명과학부 교수 ▲사회봉사 부문 이승호(47) 경북한의원 원장 ▲효행다문화 부문 주부 문유경(35)씨 ▲문화예술체육 부문 노덕일(70) 한국관악협회 회장 ▲지역경제발전 부문 한형기(58) ㈜SAC 대표이사 ▲특별상 부문 김영한(91) 향토사학자 등이다.
강창원 교수는 주의력결핍 과잉행동장애(ADHD)의 질병원인 유전자를 발굴하고 의학 최고권위지 네이처 메디슨(Nature Medicine)에 발표했다.
시상식은 29일 오후 6시 50분 대전 MBC 공개홀에서 가졌으며, 수상자에게는 상패와 상금 1천만원씩이 수여된다.
한편, 한빛대상은 대전·충남지역 각 분야에서 봉사하고 공헌한 숨은 일꾼을 찾아 널리 알리고 지역민들과 함께 보람을 나누기 위한 행사로, 대전 MBC는 2005년에 이 상을 제정했다.
2011.10.04 조회수 11520