-
 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20
조회수 3240
-
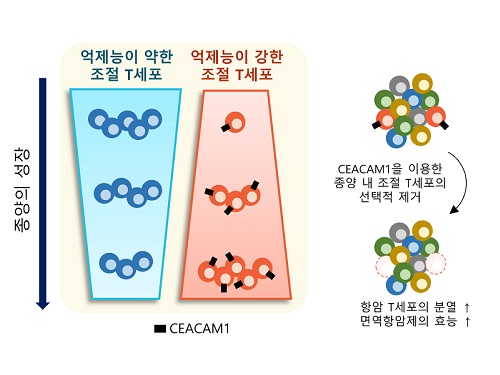 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06
조회수 3200
-
 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02
조회수 3959
-
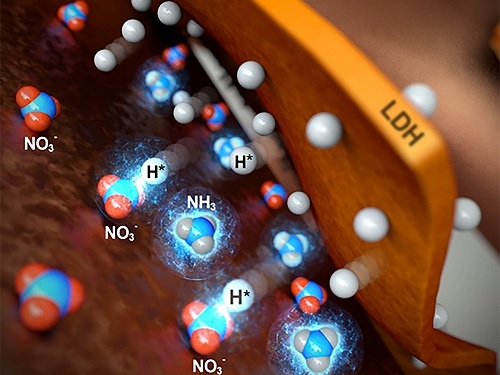 저농도 폐수에서 암모니아 생산 기술 개발
현대사회에서 우리의 삶을 위협하는 탄소 순환 불균형에 못지않게 부각되는 질소 순환 문제가 중요한 이슈다. 특히 질산염은 수질 오염, 산성비, 그리고 최근 기승을 부리는 미세먼지의 생성 원인으로도 알려져 있으며, 암모니아는 주로 농업용 비료, 플라스틱, 폭발물, 의약품, 선박용 청정원료, 수소 운반체, 암모니아 발전 등 다양한 산업군에 쓰이는 유용한 자원이다.
우리 대학 신소재공학과 강정구 교수 연구팀이 전기를 이용해 저농도 질산염 수용액으로부터 암모니아를 생산하는 고효율 촉매를 개발했다고 8일 밝혔다.
연구팀이 개발한 전기 촉매는 구리 금속 폼(Cu foam)과 니켈-철 층상이중수산화물(NiFe Layered double hydroxide)의 복합체로 구성돼 있다. 구리 폼은 질산염을 선택적으로 흡착하고, 니켈-철 층상이중수산화물은 화학이나 생체반응을 통해 반응 중 생성된 중간체 수소 라디칼을 생성해 구리 폼에 전달함으로써 질산염이 암모니아로 바뀌도록 효율적으로 진행한다. 구리, 철, 니켈 모두 귀금속과 비교해 지구에 풍부하고 비교적 저렴하므로 연구팀이 개발한 기술은 친환경적이고 경제적인 원천기술이다.
이 기술은 질산염을 통해 직접적으로 암모니아를 생산할 수 있을 뿐 아니라, 기존 질산염 환원의 가장 큰 문제였던 저농도 질산염 수용액에서도 좋은 성능을 갖는다. 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 저농도 폐수를 이용해 암모니아를 생산할 수 있어 경제적이고 실용적이다는 특성을 가진다.
김건한 박사 (現 옥스퍼드 대학교 화학과, KAIST 신소재공학과 졸업생)가 제1 저자로 참여하고, 더모트 오헤어 교수 (옥스퍼드 대학교 화학과) 연구팀이 공동으로 참여한 강정구 교수 연구팀의 이번 연구 결과는 에너지 및 환경 분야 국제 학술지 `에너지 환경 과학(Energy & Environmental Science, IF 39.71)' 1월 24일 字 온라인 게재됐다. (논문명: Energy-efficient electrochemical ammonia production from dilute nitrate solution)
현재 암모니아 생산은 대부분 `하버-보쉬 공정'을 통해 생산된다. 이 공정은 고온, 고압의 합성 조건을 전제로 하기 때문에 안전성에서 문제를 갖고 있을 뿐만 아니라 값비싼 수소 기체를 반응물로 이용하기 때문에 경제성 문제를 동시에 유발한다. 이에 대한 대안으로, 친환경적이며 값싸고 풍부한 질소 기체를 직접 전기 환원시키는 전기화학적 질소 환원법도 수용액에 대한 낮은 용해도와 강한 질소-질소 삼중결합 때문에 발생하는 낮은 효율로 큰 문제를 겪고 있다.
반면, 전기에너지를 이용해 질산염을 암모니아로 환원시키는 전기화학적 질산염 환원법은 수용액에 잘 녹는 질산염과 상대적으로 더 약한 질소-산소 결합에너지로 질소 환원법보다 더 높은 효율을 가지고 있다. 하지만, 기존의 질산염 전기 촉매의 경우, 경쟁 반응인 물 환원 반응으로 인해 암모니아로의 환원 효율이 떨어진다는 단점을 가지고 있다. 또한, 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 폐수의 경우, 약 10mM(밀리몰) 이하 낮은 농도의 질산염을 포함하고 있는데, 저농도에서 촉매 특성이 급격히 떨어진다는 특성이 있다.
이에 강정구 교수 연구팀은 표면적이 넓은 구리 금속 폼을 호스트로 사용하여 저농도의 질산염이 효율적으로 흡착될 수 있도록 했다. 한편, 호스트인 구리 금속 폼에 수소 라디칼 생성이 가능한 니켈-철 층상이중산화물을 포함하는 `구리 금속 폼/니켈-철 층상이중수산화물' 복합체를 형성하였는데, 니켈-철 층상이중수산화물의 전기전도도가 낮아 질산염 환원이 일어나는 전압에서 수소-수소 결합을 통한 수소가스 (H2)를 생성하지 않고 효율적으로 수소 라디칼 (H)을 물로부터 만들 수 있었다.
강정구 교수는 "친환경적인 전기에너지를 이용해 질산염 환원법으로 암모니아를 생성하는 경우, 주로 메탄 리포밍을 통해 생산되는 값비싼 수소 기체를 이용하며 고온/고압의 반응 조건으로 유발되는 안전성 문제를 가진 하버-보쉬 공정을 효과적으로 대체할 수 있다ˮ라고 소개하면서 "특히, 반응 자리와 수소 라디칼 자리가 분리된 촉매 구조를 통해 저농도 질산염에서도 효율적으로 암모니아를 생성할 수 있기 때문에, 실제 강물, 하천, 공장 폐수에 포함돼있는 질산염을 농축시키는 과정 없이도 효율적으로 암모니아를 생산할 수 있어 질산염을 통한 암모니아 생산의 상용화에 이바지할 것이다ˮ고 말했다.
한편 이번 연구는 과학기술정보통신부 나노 및 소재기술개발사업 미래기술연구실의 지원을 받아 수행됐다.
저농도 폐수에서 암모니아 생산 기술 개발
현대사회에서 우리의 삶을 위협하는 탄소 순환 불균형에 못지않게 부각되는 질소 순환 문제가 중요한 이슈다. 특히 질산염은 수질 오염, 산성비, 그리고 최근 기승을 부리는 미세먼지의 생성 원인으로도 알려져 있으며, 암모니아는 주로 농업용 비료, 플라스틱, 폭발물, 의약품, 선박용 청정원료, 수소 운반체, 암모니아 발전 등 다양한 산업군에 쓰이는 유용한 자원이다.
우리 대학 신소재공학과 강정구 교수 연구팀이 전기를 이용해 저농도 질산염 수용액으로부터 암모니아를 생산하는 고효율 촉매를 개발했다고 8일 밝혔다.
연구팀이 개발한 전기 촉매는 구리 금속 폼(Cu foam)과 니켈-철 층상이중수산화물(NiFe Layered double hydroxide)의 복합체로 구성돼 있다. 구리 폼은 질산염을 선택적으로 흡착하고, 니켈-철 층상이중수산화물은 화학이나 생체반응을 통해 반응 중 생성된 중간체 수소 라디칼을 생성해 구리 폼에 전달함으로써 질산염이 암모니아로 바뀌도록 효율적으로 진행한다. 구리, 철, 니켈 모두 귀금속과 비교해 지구에 풍부하고 비교적 저렴하므로 연구팀이 개발한 기술은 친환경적이고 경제적인 원천기술이다.
이 기술은 질산염을 통해 직접적으로 암모니아를 생산할 수 있을 뿐 아니라, 기존 질산염 환원의 가장 큰 문제였던 저농도 질산염 수용액에서도 좋은 성능을 갖는다. 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 저농도 폐수를 이용해 암모니아를 생산할 수 있어 경제적이고 실용적이다는 특성을 가진다.
김건한 박사 (現 옥스퍼드 대학교 화학과, KAIST 신소재공학과 졸업생)가 제1 저자로 참여하고, 더모트 오헤어 교수 (옥스퍼드 대학교 화학과) 연구팀이 공동으로 참여한 강정구 교수 연구팀의 이번 연구 결과는 에너지 및 환경 분야 국제 학술지 `에너지 환경 과학(Energy & Environmental Science, IF 39.71)' 1월 24일 字 온라인 게재됐다. (논문명: Energy-efficient electrochemical ammonia production from dilute nitrate solution)
현재 암모니아 생산은 대부분 `하버-보쉬 공정'을 통해 생산된다. 이 공정은 고온, 고압의 합성 조건을 전제로 하기 때문에 안전성에서 문제를 갖고 있을 뿐만 아니라 값비싼 수소 기체를 반응물로 이용하기 때문에 경제성 문제를 동시에 유발한다. 이에 대한 대안으로, 친환경적이며 값싸고 풍부한 질소 기체를 직접 전기 환원시키는 전기화학적 질소 환원법도 수용액에 대한 낮은 용해도와 강한 질소-질소 삼중결합 때문에 발생하는 낮은 효율로 큰 문제를 겪고 있다.
반면, 전기에너지를 이용해 질산염을 암모니아로 환원시키는 전기화학적 질산염 환원법은 수용액에 잘 녹는 질산염과 상대적으로 더 약한 질소-산소 결합에너지로 질소 환원법보다 더 높은 효율을 가지고 있다. 하지만, 기존의 질산염 전기 촉매의 경우, 경쟁 반응인 물 환원 반응으로 인해 암모니아로의 환원 효율이 떨어진다는 단점을 가지고 있다. 또한, 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 폐수의 경우, 약 10mM(밀리몰) 이하 낮은 농도의 질산염을 포함하고 있는데, 저농도에서 촉매 특성이 급격히 떨어진다는 특성이 있다.
이에 강정구 교수 연구팀은 표면적이 넓은 구리 금속 폼을 호스트로 사용하여 저농도의 질산염이 효율적으로 흡착될 수 있도록 했다. 한편, 호스트인 구리 금속 폼에 수소 라디칼 생성이 가능한 니켈-철 층상이중산화물을 포함하는 `구리 금속 폼/니켈-철 층상이중수산화물' 복합체를 형성하였는데, 니켈-철 층상이중수산화물의 전기전도도가 낮아 질산염 환원이 일어나는 전압에서 수소-수소 결합을 통한 수소가스 (H2)를 생성하지 않고 효율적으로 수소 라디칼 (H)을 물로부터 만들 수 있었다.
강정구 교수는 "친환경적인 전기에너지를 이용해 질산염 환원법으로 암모니아를 생성하는 경우, 주로 메탄 리포밍을 통해 생산되는 값비싼 수소 기체를 이용하며 고온/고압의 반응 조건으로 유발되는 안전성 문제를 가진 하버-보쉬 공정을 효과적으로 대체할 수 있다ˮ라고 소개하면서 "특히, 반응 자리와 수소 라디칼 자리가 분리된 촉매 구조를 통해 저농도 질산염에서도 효율적으로 암모니아를 생성할 수 있기 때문에, 실제 강물, 하천, 공장 폐수에 포함돼있는 질산염을 농축시키는 과정 없이도 효율적으로 암모니아를 생산할 수 있어 질산염을 통한 암모니아 생산의 상용화에 이바지할 것이다ˮ고 말했다.
한편 이번 연구는 과학기술정보통신부 나노 및 소재기술개발사업 미래기술연구실의 지원을 받아 수행됐다.
2023.02.08
조회수 3794
-
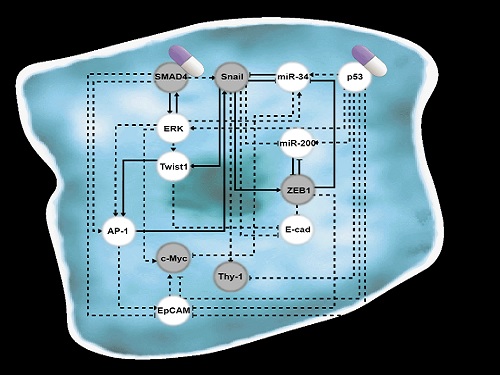 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30
조회수 4372
-
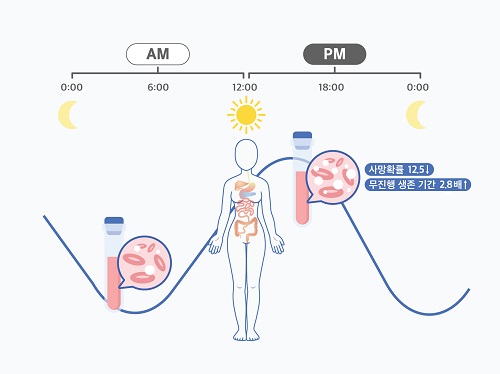 여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15
조회수 3737
-
 해킹 동아리 GoN, 국내·외 각종 대회 석권
우리 대학 정보보안 및 해킹 동아리 GoN이 국내·외 각종 대회를 석권했다.
GoN은 지난달 7일부터 이틀간 과학기술정보통신부 주최로 열린 국제해킹방어대회 '코드게이트 2022'에서 대학생부 1위를 차지해 과기정통부 장관상과 상금 1천만 원을 수상했다.
'코드게이트 2022'는 세계 최고의 화이트해커들이 실력을 겨루는 국제적인 해킹방어대회로 2008년 시작돼 올해로 14번째 대회를 맞았다. 이번 대회에는 일반부 48개국 2,647개 팀, 대학생부 국내 8개 대학 225개 팀, 주니어부 27개국 196명이 참가했다. GoN에서는 김동옥(전산학부 18), 민승기(화학과 17), 박창완(전기및전자공학부 17), 허현(전산학부 20) 학생이 팀을 이뤄 1박 2일간 경연을 펼쳤으며, 숭실대 '해군 해난구조전대' 팀과 고려대 'CyKor'팀이 각각 2위와 3위에 올랐다.
또한, 지난 10월 개최된 2022 암호분석경진대회에서도 일반부 대상을 차지하는 성과를 거뒀다.
암호분석경진대회는 암호분석 기술 발전 및 암호해독 분야의 우수 인재를 발굴하기 위해 국방암호특화연구센터가 주최하고 777사령부가 후원하는 대회로 고등학생부터 일반인까지 모두 참가할 수 있다. 올해 대회는 ▲ 대칭키 암호 ▲ 블록체인 ▲ 임베디드 시스템 상에서의 암호 최적화 ▲ 암호에 대한 부채널 공격 ▲ 해시 함수 ▲ 양자내성 암호 등의 분야가 문제로 출제되었다. GoN에서는 박창완(전기및전자공학부 17), 민승기(화학과 17), 최유빈(새내기과정학부 22), 이재웅(전산학부 20) 학생이 참가해 암호 최적화, 양자내성 암호 분야에서 우수한 성적을 거둬 국방부장관상인 대상과 상금 600만 원을 수상했다. 허현 GoN 회장은 "연이은 대회 입상으로 우리 동아리의 저력을 보여준 것 같아 기쁘고 뿌듯하다"라며, "앞으로도 활발하게 활동해 좋은 성과가 나올 수 있도록 노력하겠다"라고 소감을 전했다.
해킹 동아리 GoN, 국내·외 각종 대회 석권
우리 대학 정보보안 및 해킹 동아리 GoN이 국내·외 각종 대회를 석권했다.
GoN은 지난달 7일부터 이틀간 과학기술정보통신부 주최로 열린 국제해킹방어대회 '코드게이트 2022'에서 대학생부 1위를 차지해 과기정통부 장관상과 상금 1천만 원을 수상했다.
'코드게이트 2022'는 세계 최고의 화이트해커들이 실력을 겨루는 국제적인 해킹방어대회로 2008년 시작돼 올해로 14번째 대회를 맞았다. 이번 대회에는 일반부 48개국 2,647개 팀, 대학생부 국내 8개 대학 225개 팀, 주니어부 27개국 196명이 참가했다. GoN에서는 김동옥(전산학부 18), 민승기(화학과 17), 박창완(전기및전자공학부 17), 허현(전산학부 20) 학생이 팀을 이뤄 1박 2일간 경연을 펼쳤으며, 숭실대 '해군 해난구조전대' 팀과 고려대 'CyKor'팀이 각각 2위와 3위에 올랐다.
또한, 지난 10월 개최된 2022 암호분석경진대회에서도 일반부 대상을 차지하는 성과를 거뒀다.
암호분석경진대회는 암호분석 기술 발전 및 암호해독 분야의 우수 인재를 발굴하기 위해 국방암호특화연구센터가 주최하고 777사령부가 후원하는 대회로 고등학생부터 일반인까지 모두 참가할 수 있다. 올해 대회는 ▲ 대칭키 암호 ▲ 블록체인 ▲ 임베디드 시스템 상에서의 암호 최적화 ▲ 암호에 대한 부채널 공격 ▲ 해시 함수 ▲ 양자내성 암호 등의 분야가 문제로 출제되었다. GoN에서는 박창완(전기및전자공학부 17), 민승기(화학과 17), 최유빈(새내기과정학부 22), 이재웅(전산학부 20) 학생이 참가해 암호 최적화, 양자내성 암호 분야에서 우수한 성적을 거둬 국방부장관상인 대상과 상금 600만 원을 수상했다. 허현 GoN 회장은 "연이은 대회 입상으로 우리 동아리의 저력을 보여준 것 같아 기쁘고 뿌듯하다"라며, "앞으로도 활발하게 활동해 좋은 성과가 나올 수 있도록 노력하겠다"라고 소감을 전했다.
2022.12.05
조회수 4126
-
 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04
조회수 4724
-
 항암효과 갖는 세큐리네가 천연물의 총괄적 합성 원천기술 개발
우리 대학 화학과 한순규 교수 연구팀이 항암효과를 가지는 고산화준위 세큐리네가 알칼로이드*의 총괄적인 합성 방법을 개발했다고 30일 밝혔다.
* 알칼로이드란 질소를 함유하는 알칼리성의 유기물질을 말하는데 그 중 한국에서도 자생하는 식물인 광대싸리(학명: Securinega Suffruticosa)에서 주로 추출되고 이 식물 내에서 생합성적인 산화 대사가 일어난 알칼로이드를 통틀어 고산화준위 세큐리네가 알칼로이드라고 칭한다.
한 교수 연구팀은 반응 조건의 세심한 설계를 통해 세큐리네가 골격의 특정 위치에 원하는 반응이 일어나도록 해 7종의 세큐리네가 알칼로이드를 총괄적으로 합성하는 데 성공했다. 합성 천연물 중 세큐린진(securingine) D는 다양한 암세포에 대해 높은 항암 활성을 가지는 만큼, 이번 연구 결과에 기반한 항암제 개발연구도 기대된다.
화학과 박상빈 석박사통합과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 9월 2일자에 게재됐다. (논문명 : Collective total synthesis of C4-oxygenated securinine-type alkaloids via stereocontrolled diversifications on the piperidine core)
천연물 전합성(total synthesis)은 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 복잡한 천연물을 인위적으로 합성하는 학문 분야다. 목표 물질의 가능한 합성 경로를 찾으면서 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 천연물에 도달할 수 있는 하이-리스크 하이-리턴의 연구 분야다.
한 교수 연구팀은 자연에서 여러 효소의 작용을 통해 이루어지는 세큐리네가 골격의 산화, 원자 재배열 등을 인공적으로 구현해 천연물의 합성을 이뤄냈을 뿐만 아니라 기본 골격의 탄소 배열을 상호변환하는 기법을 최초로 개발해내 세큐리네가 화학에 새로운 지평을 열었다.
이번 연구를 통해 합성에 성공한 천연물로 세큐리티닌(securitinine), 세큐아마민(secu'amamine) D, 세큐린진(securingine) A, C, D, 필란틴(phyllanthine), 4-에피-필란틴(4-epi-phyllanthine)이 있으며, 이 중 필란틴을 제외하고는 모두 세계 최초의 합성이다.
그 중 세큐린진 D는 높은 항암효과를 가져 의약적 연구가 수반돼야 하지만 자연계에서 극소량만 추출돼 추가적인 생리활성 연구에 어려움이 있었다. 한 교수 연구팀에서 이를 인공적으로 합성하는 방법을 개발하면서 그러한 연구에도 박차를 가할 수 있게 됐다.
천연물은 처음 추출된 뒤 분광학적 기법을 통해 그 구조를 밝히는데, 이 과정에서 오류가 생기는 경우가 종종 있다. 천연물 전합성은 이러한 오류를 해결하는 데에 있어 `최종 병기'와 같은 역할을 한다. 세큐린진 A, C, D의 경우, 계산 화학적 기법을 통해 기존과 다른 구조 후보가 제안된 바 있는데, 연구팀은 이번 합성 연구를 통해 새로 제안된 구조가 천연물의 실제 구조라는 것을 입증해냈다.
화학과 한순규 교수는 "이번 연구를 통해 모든 고산화준위 세큐리네가 알칼로이드의 합성 전략을 세우는 기반을 마련할 수 있었다ˮ며 "연구팀은 여기서 멈추지 않고 이 연구 성과를 퇴행성 신경질환 치료 효과가 있다고 알려진 더욱 복잡한 이합체 고산화준위 세큐리네가 알칼로이드의 합성 연구에도 활발히 응용할 계획이다ˮ라고 밝혔다.
한편 이번 연구는 한국연구재단 이공분야 기초연구사업 중견연구자지원사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
항암효과 갖는 세큐리네가 천연물의 총괄적 합성 원천기술 개발
우리 대학 화학과 한순규 교수 연구팀이 항암효과를 가지는 고산화준위 세큐리네가 알칼로이드*의 총괄적인 합성 방법을 개발했다고 30일 밝혔다.
* 알칼로이드란 질소를 함유하는 알칼리성의 유기물질을 말하는데 그 중 한국에서도 자생하는 식물인 광대싸리(학명: Securinega Suffruticosa)에서 주로 추출되고 이 식물 내에서 생합성적인 산화 대사가 일어난 알칼로이드를 통틀어 고산화준위 세큐리네가 알칼로이드라고 칭한다.
한 교수 연구팀은 반응 조건의 세심한 설계를 통해 세큐리네가 골격의 특정 위치에 원하는 반응이 일어나도록 해 7종의 세큐리네가 알칼로이드를 총괄적으로 합성하는 데 성공했다. 합성 천연물 중 세큐린진(securingine) D는 다양한 암세포에 대해 높은 항암 활성을 가지는 만큼, 이번 연구 결과에 기반한 항암제 개발연구도 기대된다.
화학과 박상빈 석박사통합과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 9월 2일자에 게재됐다. (논문명 : Collective total synthesis of C4-oxygenated securinine-type alkaloids via stereocontrolled diversifications on the piperidine core)
천연물 전합성(total synthesis)은 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 복잡한 천연물을 인위적으로 합성하는 학문 분야다. 목표 물질의 가능한 합성 경로를 찾으면서 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 천연물에 도달할 수 있는 하이-리스크 하이-리턴의 연구 분야다.
한 교수 연구팀은 자연에서 여러 효소의 작용을 통해 이루어지는 세큐리네가 골격의 산화, 원자 재배열 등을 인공적으로 구현해 천연물의 합성을 이뤄냈을 뿐만 아니라 기본 골격의 탄소 배열을 상호변환하는 기법을 최초로 개발해내 세큐리네가 화학에 새로운 지평을 열었다.
이번 연구를 통해 합성에 성공한 천연물로 세큐리티닌(securitinine), 세큐아마민(secu'amamine) D, 세큐린진(securingine) A, C, D, 필란틴(phyllanthine), 4-에피-필란틴(4-epi-phyllanthine)이 있으며, 이 중 필란틴을 제외하고는 모두 세계 최초의 합성이다.
그 중 세큐린진 D는 높은 항암효과를 가져 의약적 연구가 수반돼야 하지만 자연계에서 극소량만 추출돼 추가적인 생리활성 연구에 어려움이 있었다. 한 교수 연구팀에서 이를 인공적으로 합성하는 방법을 개발하면서 그러한 연구에도 박차를 가할 수 있게 됐다.
천연물은 처음 추출된 뒤 분광학적 기법을 통해 그 구조를 밝히는데, 이 과정에서 오류가 생기는 경우가 종종 있다. 천연물 전합성은 이러한 오류를 해결하는 데에 있어 `최종 병기'와 같은 역할을 한다. 세큐린진 A, C, D의 경우, 계산 화학적 기법을 통해 기존과 다른 구조 후보가 제안된 바 있는데, 연구팀은 이번 합성 연구를 통해 새로 제안된 구조가 천연물의 실제 구조라는 것을 입증해냈다.
화학과 한순규 교수는 "이번 연구를 통해 모든 고산화준위 세큐리네가 알칼로이드의 합성 전략을 세우는 기반을 마련할 수 있었다ˮ며 "연구팀은 여기서 멈추지 않고 이 연구 성과를 퇴행성 신경질환 치료 효과가 있다고 알려진 더욱 복잡한 이합체 고산화준위 세큐리네가 알칼로이드의 합성 연구에도 활발히 응용할 계획이다ˮ라고 밝혔다.
한편 이번 연구는 한국연구재단 이공분야 기초연구사업 중견연구자지원사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2022.09.30
조회수 4513
-
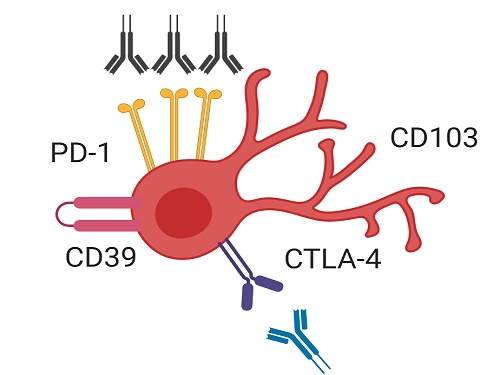 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14
조회수 4226
-
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12
조회수 5670
-
 2022 실리콘밸리 글로벌 창업 부트 캠프 성료
우리 대학이 예비 창업자 및 초기 창업자를 위한 '2022 실리콘밸리 글로벌 창업 부트 캠프(Global Entrepreneurship Summer Camp, 이하 GESC)'를 개최해 성공적으로 마무리했다. 국제협력처 글로벌사업기획센터(처장 임만성)와 창업원(원장 김영태)이 공동주최한 '2022 KAIST GESC' 프로그램은 교내에서 처음 시행하는 실리콘밸리 산-학 연계 창업 부트캠프 프로그램이다. 실리콘밸리 현지를 방문해 창업 기업의 사례를 체험하는 기회를 제공하고, 향후 실리콘밸리로 진출할 수 있는 네트워크를 마련해주고자 시범적으로 기획되었다.
이를 위해, 재학생을 포함한 예비 창업자와 법인설립 1년 이내의 초기 창업자 등 총 20명을 이달 초 선발했다. 선발된 학생 중에는 KAIST에 재학 중인 에티오피아·멕시코·인도네시아·키르기스스탄 등 다양한 국적의 외국인 학생들도 포함되어 있어 국적을 초월한 글로벌 팀워크의 중요성을 상기하는 계기가 되었다. 참가자들은 일주일간의 국내 교육을 수료한 후 지난 27일부터 미국 스탠퍼드 대학교, 실리콘밸리 코트라 무역관(관장 박용민) 및 현지 기업을 방문해 실리콘밸리 내 우리 대학 동문 및 현지 전문가들과 협력하는 창업 교육 및 스타트업 현장 체험을 진행했다. 실리콘밸리 코트라 무역관에서는 현지의 엑셀러레이터(accelerator)와 KAIST의 학생팀을 연계시켜 각 팀의 비즈니스 아이템과 모델이 글로벌 시장가치를 창출하는 사업으로 발전할 수 있도록 돕는 시간이 마련됐다. 특히, 실리콘밸리에서 성장하고 있는 모션투에이아이(Motion2AI, 대표 김병수), 임프리메드(ImpriMed, 대표 임성원), 메딕 라이프 사이언스(Medic Life Sciences, 대표 한규호) 등의 기업이 창업에 대한 열정과 도전정신을 불어넣어줄 강연과 스타트업 현장 방문 등으로 함께했다. 창업 교육 워크숍의 일부를 주관한 스탠퍼드 대학교 기술 벤처 프로그램(The Stanford Technology Ventures Program, 이하 STVP)의 모윤 르이 펑(Mo-Yun Lei Fong) 원장은 "KAIST와의 협력해 기획된 이번 워크숍을 통해 미래의 기업가들을 글로벌 시민으로 육성하고자 하는 STVP의 비전을 실현하고 특히, 한국의 학생들에게 글로벌 기업가가 되기 위해 반드시 필요한 통찰력에 대하여 알려주는 기회가 마련되어 기뻤다"라고 밝혔다. 이어, "STVP 또한 이번 프로그램을 기획하면서 한국 대학과의 네트워크가 구축되었고, KAIST 학생들과의 소통하며 한국의 문화와 아이디어를 이해하고 글로벌 문화와 관련된 커리큘럼을 개선할 수 있었다"라고 덧붙였다. 선발된 학생들은 국내·외에서 2주간 진행한 글로벌 창업교육에서 습득한 내용을 바탕으로 사업계획서를 작성하고, 미국 현지 창업 액셀러레이터인 '플러그 앤 플레이(Plug and Play)'에서 투자자를 초청해 지난 1일 최종 피칭을 펼쳤다. 최종 피칭에 앞서 이종문 암벡스 벤처 파트너스(AmBex Venture Partners) 회장이 특별 강연해 학생들에게 글로벌 기업가 정신을 바탕으로 한 사회적 기여의 중요성을 역설했다.참가자들은 최종 피칭에서 메타버스 데이트 서비스 · AI 소음차단 베개 · VR 원격회의 오피스 · AI 한국어 튜터링 앱 등 다양한 기술을 적용한 창의적인 사업 아이템을 발표했으며, 2주간이라는 짧은 기간 동안 준비해 우수한 수준의 피칭을 선보여 심사위원들의 호평을 받았다. 그중 1위는 항공우주공학과, 기술경영학부, 수리과학과, 생명화학공학과 등 다양한 학과의 학생으로 구성된 '보드 KAIST 요트 클럽(Bored KAIST Yacht Club)'팀의 '메타-에버랜드(Meta-Everland)'가 선정됐다. 이승희 기술경영학부 석사과정 학생은 "우리팀의 아이템은 메타데이트를 통해 실시간으로 오프라인과 유사한 데이트를 경험할 수 있게 하는 서비스"라며, "이번 프로그램을 통해 창업이 어려운 것이 아닌, 누구나 재미있게 도전해 볼 수 있는 경험이라는 사실을 알게 되었다"라고 전했다. 이어, "실리콘밸리 현지에서 활동하고 있는 투자자나 엑셀러레이터의 심사와 조언을 받으며 흥미로운 아이디어만 가지고도 투자자나 심사위원의 관심을 받을 수 있다는 중요한 사실을 깨달았다"라고 소감을 밝혔다. 피칭 1위를 차지한 팀은 흥미로운 사업 아이템과 우수한 팀워크로 프로그램 기간 중 멘토로 활동한 현지 엑셀러레이터로부터 실리콘밸리 현지의 사업파트너를 소개받기도 했다. 또한, 프로그램에 함께 참가한 황병훈 생명화학공학과 석사과정 학생은 "실리콘밸리 최전선에서 일하고 있는 사람들이 어떤 태도나 마음가짐으로 일하고 있는지 알게 되어 졸업 후 진로와 스타트업 창업을 생각하는 시야가 많이 확장되었다"라고 소감을 전했다. 몬드라곤 마리나(MONDRAGON MARINA) 글로벌 정보통신 기술 프로그램 석사과정 학생은 "실리콘밸리에서 활동하고 있는 스타트업 CEO를 만나 대화하며 실리콘밸리와 한국의 창업 에코 시스템의 다른 점을 배울 수 있어 뜻깊었다"라고 말했다.
윤상수 주샌프란시스코 총영사는 "이번 프로그램이 지속적으로 발전한다면 과학기술을 통한 혁신적인 기술 가치를 창출할 수 있을 것으로 기대된다"라고 말하며 "총영사관에서도 프로그램이 잘 지속될 수 있도록 협조할 계획이다"라고 덧붙였다.
실리콘밸리 교육에 학생들을 인솔한 임만성 국제협력처장은 "KAIST에서 처음으로 시행한 실리콘밸리 산-학 연계 창업 부트캠프인 만큼 학생들이 더욱더 넓은 시야를 가지고 글로벌 창업의 꿈을 키우는 멋진 기회가 되었을 것으로 생각한다"라고 말했다.
프로그램을 공동 주최한 김영태 창업원장은 "이번 교육 프로그램을 통해 개발된 우수한 사업 아이템이 글로벌 시장에서 경쟁력을 갖출 수 있도록 창업원의 다양한 프로그램을 통해 지원할 계획"이라고 전했다. 한편, 글로벌사업기획센터와 창업원은 이번 프로그램의 성공적인 개최를 발판삼아 글로벌 시장에서 경쟁력을 갖춘 예비 창업가를 육성하기 위한 'KAIST GESC' 프로그램을 지속 발전시킬 예정이다.
2022 실리콘밸리 글로벌 창업 부트 캠프 성료
우리 대학이 예비 창업자 및 초기 창업자를 위한 '2022 실리콘밸리 글로벌 창업 부트 캠프(Global Entrepreneurship Summer Camp, 이하 GESC)'를 개최해 성공적으로 마무리했다. 국제협력처 글로벌사업기획센터(처장 임만성)와 창업원(원장 김영태)이 공동주최한 '2022 KAIST GESC' 프로그램은 교내에서 처음 시행하는 실리콘밸리 산-학 연계 창업 부트캠프 프로그램이다. 실리콘밸리 현지를 방문해 창업 기업의 사례를 체험하는 기회를 제공하고, 향후 실리콘밸리로 진출할 수 있는 네트워크를 마련해주고자 시범적으로 기획되었다.
이를 위해, 재학생을 포함한 예비 창업자와 법인설립 1년 이내의 초기 창업자 등 총 20명을 이달 초 선발했다. 선발된 학생 중에는 KAIST에 재학 중인 에티오피아·멕시코·인도네시아·키르기스스탄 등 다양한 국적의 외국인 학생들도 포함되어 있어 국적을 초월한 글로벌 팀워크의 중요성을 상기하는 계기가 되었다. 참가자들은 일주일간의 국내 교육을 수료한 후 지난 27일부터 미국 스탠퍼드 대학교, 실리콘밸리 코트라 무역관(관장 박용민) 및 현지 기업을 방문해 실리콘밸리 내 우리 대학 동문 및 현지 전문가들과 협력하는 창업 교육 및 스타트업 현장 체험을 진행했다. 실리콘밸리 코트라 무역관에서는 현지의 엑셀러레이터(accelerator)와 KAIST의 학생팀을 연계시켜 각 팀의 비즈니스 아이템과 모델이 글로벌 시장가치를 창출하는 사업으로 발전할 수 있도록 돕는 시간이 마련됐다. 특히, 실리콘밸리에서 성장하고 있는 모션투에이아이(Motion2AI, 대표 김병수), 임프리메드(ImpriMed, 대표 임성원), 메딕 라이프 사이언스(Medic Life Sciences, 대표 한규호) 등의 기업이 창업에 대한 열정과 도전정신을 불어넣어줄 강연과 스타트업 현장 방문 등으로 함께했다. 창업 교육 워크숍의 일부를 주관한 스탠퍼드 대학교 기술 벤처 프로그램(The Stanford Technology Ventures Program, 이하 STVP)의 모윤 르이 펑(Mo-Yun Lei Fong) 원장은 "KAIST와의 협력해 기획된 이번 워크숍을 통해 미래의 기업가들을 글로벌 시민으로 육성하고자 하는 STVP의 비전을 실현하고 특히, 한국의 학생들에게 글로벌 기업가가 되기 위해 반드시 필요한 통찰력에 대하여 알려주는 기회가 마련되어 기뻤다"라고 밝혔다. 이어, "STVP 또한 이번 프로그램을 기획하면서 한국 대학과의 네트워크가 구축되었고, KAIST 학생들과의 소통하며 한국의 문화와 아이디어를 이해하고 글로벌 문화와 관련된 커리큘럼을 개선할 수 있었다"라고 덧붙였다. 선발된 학생들은 국내·외에서 2주간 진행한 글로벌 창업교육에서 습득한 내용을 바탕으로 사업계획서를 작성하고, 미국 현지 창업 액셀러레이터인 '플러그 앤 플레이(Plug and Play)'에서 투자자를 초청해 지난 1일 최종 피칭을 펼쳤다. 최종 피칭에 앞서 이종문 암벡스 벤처 파트너스(AmBex Venture Partners) 회장이 특별 강연해 학생들에게 글로벌 기업가 정신을 바탕으로 한 사회적 기여의 중요성을 역설했다.참가자들은 최종 피칭에서 메타버스 데이트 서비스 · AI 소음차단 베개 · VR 원격회의 오피스 · AI 한국어 튜터링 앱 등 다양한 기술을 적용한 창의적인 사업 아이템을 발표했으며, 2주간이라는 짧은 기간 동안 준비해 우수한 수준의 피칭을 선보여 심사위원들의 호평을 받았다. 그중 1위는 항공우주공학과, 기술경영학부, 수리과학과, 생명화학공학과 등 다양한 학과의 학생으로 구성된 '보드 KAIST 요트 클럽(Bored KAIST Yacht Club)'팀의 '메타-에버랜드(Meta-Everland)'가 선정됐다. 이승희 기술경영학부 석사과정 학생은 "우리팀의 아이템은 메타데이트를 통해 실시간으로 오프라인과 유사한 데이트를 경험할 수 있게 하는 서비스"라며, "이번 프로그램을 통해 창업이 어려운 것이 아닌, 누구나 재미있게 도전해 볼 수 있는 경험이라는 사실을 알게 되었다"라고 전했다. 이어, "실리콘밸리 현지에서 활동하고 있는 투자자나 엑셀러레이터의 심사와 조언을 받으며 흥미로운 아이디어만 가지고도 투자자나 심사위원의 관심을 받을 수 있다는 중요한 사실을 깨달았다"라고 소감을 밝혔다. 피칭 1위를 차지한 팀은 흥미로운 사업 아이템과 우수한 팀워크로 프로그램 기간 중 멘토로 활동한 현지 엑셀러레이터로부터 실리콘밸리 현지의 사업파트너를 소개받기도 했다. 또한, 프로그램에 함께 참가한 황병훈 생명화학공학과 석사과정 학생은 "실리콘밸리 최전선에서 일하고 있는 사람들이 어떤 태도나 마음가짐으로 일하고 있는지 알게 되어 졸업 후 진로와 스타트업 창업을 생각하는 시야가 많이 확장되었다"라고 소감을 전했다. 몬드라곤 마리나(MONDRAGON MARINA) 글로벌 정보통신 기술 프로그램 석사과정 학생은 "실리콘밸리에서 활동하고 있는 스타트업 CEO를 만나 대화하며 실리콘밸리와 한국의 창업 에코 시스템의 다른 점을 배울 수 있어 뜻깊었다"라고 말했다.
윤상수 주샌프란시스코 총영사는 "이번 프로그램이 지속적으로 발전한다면 과학기술을 통한 혁신적인 기술 가치를 창출할 수 있을 것으로 기대된다"라고 말하며 "총영사관에서도 프로그램이 잘 지속될 수 있도록 협조할 계획이다"라고 덧붙였다.
실리콘밸리 교육에 학생들을 인솔한 임만성 국제협력처장은 "KAIST에서 처음으로 시행한 실리콘밸리 산-학 연계 창업 부트캠프인 만큼 학생들이 더욱더 넓은 시야를 가지고 글로벌 창업의 꿈을 키우는 멋진 기회가 되었을 것으로 생각한다"라고 말했다.
프로그램을 공동 주최한 김영태 창업원장은 "이번 교육 프로그램을 통해 개발된 우수한 사업 아이템이 글로벌 시장에서 경쟁력을 갖출 수 있도록 창업원의 다양한 프로그램을 통해 지원할 계획"이라고 전했다. 한편, 글로벌사업기획센터와 창업원은 이번 프로그램의 성공적인 개최를 발판삼아 글로벌 시장에서 경쟁력을 갖춘 예비 창업가를 육성하기 위한 'KAIST GESC' 프로그램을 지속 발전시킬 예정이다.
2022.07.04
조회수 6317
 말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 3240
말기 고형암 표적 2세대 면역치료제 개발
암은 현대인의 건강을 위협하는 대표적인 질병으로 꼽히고 있다. 최근의 암 연구 중에서 가장 많은 진전이 있었던 분야는 암 환자가 갖고 있는 면역체계를 활용해 암을 극복하는 면역 항암치료다. 여기 기존의 모든 항암 치료에 불응한 말기 고형암 환자들에게 적용 가능한 차세대 면역 항암 치료법이 개발되어 화제다.
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역시스템이 억제되는 종양미세환경을 극복하는 ‘2세대 T세포 수용체 T (T cell receptor specific T, 이하 TCR-T) 세포’ 치료제를 개발했다고 20일 밝혔다.
연구팀은 유전자 조작을 통해 암세포를 직접 파괴할 수 있도록 하는 TCR-T 세포 치료제 제작에 크리스퍼-캐스9 유전자 편집 기술을 이용해 T 세포 수용체 신호전달의 핵심적인 CD247 유전자에 추가신호 전달체인 트레프2-결합 도메인이 포함되도록 개량했다. 이러한 유전자 편집을 통한 개량은 TCR-T 세포의 증식 및 지속성을 향상시켰고, 생쥐를 이용한 악성 흑색종 모델에서 탁월한 항암 효과를 보임을 확인했다.
KAIST 생명과학과 나상준 박사와 김세기 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '저널 포 이뮤노쎄라피 오브 캔서 (Journal for Immunotherapy of Cancer)'에 지난 4월 5일 출판됐다. (논문명: Engineering second-generation TCR-T cells by site-specific integration of TRAF-binding motifs into the CD247 locus)
초기 미비한 항암 효과를 보이던 1세대 키메라 항원 수용체 (chimeric antigen receptor, 이하 CAR)를 장착한 CAR-T 세포와 다르게, 추가신호 전달체가 포함된 2세대 CAR-T 세포는 말기 백혈병 환자들을 대상으로 80% 이상의 높은 치료 효과를 보이며 ‘기적의 항암제’로 불리고 있다. 하지만 현 CAR-T 치료제는 B세포성 급성 백혈병과 다발 골수종 같은 혈액암에만 치료 효과가 국한돼 있으며, 고형암 환자들을 대상으로 높은 치료효과를 보이는 CAR-T 치료제가 아직까지 없다는 점이 해결해야 할 과제로 대두되고 있다. 또한 TCR-T 치료제는 CAR-T와는 다르게 아직 1세대 구조에 머물고 있다.
이러한 관점에서, 연구진은 고형암을 표적으로 하는 TCR-T 세포에 추가 신호 전달체인 트레프2-결합 도메인이 포함된 2세대 TCR-T 세포 치료제를 개발했다. 단일 단백질로 이뤄진 CAR와 다르게 단백질 복합체를 형성하는 TCR에 추가신호 전달체를 포함시키는 엔지니어링은 훨씬 도전적이다. 연구진은 다양한 시도 끝에 TCR의 형성과 기존 신호전달에 영향을 주지 않으면서 동시에 추가 신호가 유발되는 최적의 TCR 모듈을 구축했다.
제1 저자인 나상준 박사는 “고형암이 형성하는 면역억제 환경에서, 기존 1세대 TCR-T 세포의 항암효과는 제한될 수 밖에 없다”라며 “반면 2세대 TCR-T 세포는 면역억제 환경에서도 지속적인 항암효과를 유지하도록 고안된 기술 전략으로, 기존 치료제의 효과를 기대하기 어려운 고형암 환자들에게 필요한 치료제가 될 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
2023.04.20 조회수 3240 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3200
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3200 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 3959
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 3959 저농도 폐수에서 암모니아 생산 기술 개발
현대사회에서 우리의 삶을 위협하는 탄소 순환 불균형에 못지않게 부각되는 질소 순환 문제가 중요한 이슈다. 특히 질산염은 수질 오염, 산성비, 그리고 최근 기승을 부리는 미세먼지의 생성 원인으로도 알려져 있으며, 암모니아는 주로 농업용 비료, 플라스틱, 폭발물, 의약품, 선박용 청정원료, 수소 운반체, 암모니아 발전 등 다양한 산업군에 쓰이는 유용한 자원이다.
우리 대학 신소재공학과 강정구 교수 연구팀이 전기를 이용해 저농도 질산염 수용액으로부터 암모니아를 생산하는 고효율 촉매를 개발했다고 8일 밝혔다.
연구팀이 개발한 전기 촉매는 구리 금속 폼(Cu foam)과 니켈-철 층상이중수산화물(NiFe Layered double hydroxide)의 복합체로 구성돼 있다. 구리 폼은 질산염을 선택적으로 흡착하고, 니켈-철 층상이중수산화물은 화학이나 생체반응을 통해 반응 중 생성된 중간체 수소 라디칼을 생성해 구리 폼에 전달함으로써 질산염이 암모니아로 바뀌도록 효율적으로 진행한다. 구리, 철, 니켈 모두 귀금속과 비교해 지구에 풍부하고 비교적 저렴하므로 연구팀이 개발한 기술은 친환경적이고 경제적인 원천기술이다.
이 기술은 질산염을 통해 직접적으로 암모니아를 생산할 수 있을 뿐 아니라, 기존 질산염 환원의 가장 큰 문제였던 저농도 질산염 수용액에서도 좋은 성능을 갖는다. 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 저농도 폐수를 이용해 암모니아를 생산할 수 있어 경제적이고 실용적이다는 특성을 가진다.
김건한 박사 (現 옥스퍼드 대학교 화학과, KAIST 신소재공학과 졸업생)가 제1 저자로 참여하고, 더모트 오헤어 교수 (옥스퍼드 대학교 화학과) 연구팀이 공동으로 참여한 강정구 교수 연구팀의 이번 연구 결과는 에너지 및 환경 분야 국제 학술지 `에너지 환경 과학(Energy & Environmental Science, IF 39.71)' 1월 24일 字 온라인 게재됐다. (논문명: Energy-efficient electrochemical ammonia production from dilute nitrate solution)
현재 암모니아 생산은 대부분 `하버-보쉬 공정'을 통해 생산된다. 이 공정은 고온, 고압의 합성 조건을 전제로 하기 때문에 안전성에서 문제를 갖고 있을 뿐만 아니라 값비싼 수소 기체를 반응물로 이용하기 때문에 경제성 문제를 동시에 유발한다. 이에 대한 대안으로, 친환경적이며 값싸고 풍부한 질소 기체를 직접 전기 환원시키는 전기화학적 질소 환원법도 수용액에 대한 낮은 용해도와 강한 질소-질소 삼중결합 때문에 발생하는 낮은 효율로 큰 문제를 겪고 있다.
반면, 전기에너지를 이용해 질산염을 암모니아로 환원시키는 전기화학적 질산염 환원법은 수용액에 잘 녹는 질산염과 상대적으로 더 약한 질소-산소 결합에너지로 질소 환원법보다 더 높은 효율을 가지고 있다. 하지만, 기존의 질산염 전기 촉매의 경우, 경쟁 반응인 물 환원 반응으로 인해 암모니아로의 환원 효율이 떨어진다는 단점을 가지고 있다. 또한, 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 폐수의 경우, 약 10mM(밀리몰) 이하 낮은 농도의 질산염을 포함하고 있는데, 저농도에서 촉매 특성이 급격히 떨어진다는 특성이 있다.
이에 강정구 교수 연구팀은 표면적이 넓은 구리 금속 폼을 호스트로 사용하여 저농도의 질산염이 효율적으로 흡착될 수 있도록 했다. 한편, 호스트인 구리 금속 폼에 수소 라디칼 생성이 가능한 니켈-철 층상이중산화물을 포함하는 `구리 금속 폼/니켈-철 층상이중수산화물' 복합체를 형성하였는데, 니켈-철 층상이중수산화물의 전기전도도가 낮아 질산염 환원이 일어나는 전압에서 수소-수소 결합을 통한 수소가스 (H2)를 생성하지 않고 효율적으로 수소 라디칼 (H)을 물로부터 만들 수 있었다.
강정구 교수는 "친환경적인 전기에너지를 이용해 질산염 환원법으로 암모니아를 생성하는 경우, 주로 메탄 리포밍을 통해 생산되는 값비싼 수소 기체를 이용하며 고온/고압의 반응 조건으로 유발되는 안전성 문제를 가진 하버-보쉬 공정을 효과적으로 대체할 수 있다ˮ라고 소개하면서 "특히, 반응 자리와 수소 라디칼 자리가 분리된 촉매 구조를 통해 저농도 질산염에서도 효율적으로 암모니아를 생성할 수 있기 때문에, 실제 강물, 하천, 공장 폐수에 포함돼있는 질산염을 농축시키는 과정 없이도 효율적으로 암모니아를 생산할 수 있어 질산염을 통한 암모니아 생산의 상용화에 이바지할 것이다ˮ고 말했다.
한편 이번 연구는 과학기술정보통신부 나노 및 소재기술개발사업 미래기술연구실의 지원을 받아 수행됐다.
2023.02.08 조회수 3794
저농도 폐수에서 암모니아 생산 기술 개발
현대사회에서 우리의 삶을 위협하는 탄소 순환 불균형에 못지않게 부각되는 질소 순환 문제가 중요한 이슈다. 특히 질산염은 수질 오염, 산성비, 그리고 최근 기승을 부리는 미세먼지의 생성 원인으로도 알려져 있으며, 암모니아는 주로 농업용 비료, 플라스틱, 폭발물, 의약품, 선박용 청정원료, 수소 운반체, 암모니아 발전 등 다양한 산업군에 쓰이는 유용한 자원이다.
우리 대학 신소재공학과 강정구 교수 연구팀이 전기를 이용해 저농도 질산염 수용액으로부터 암모니아를 생산하는 고효율 촉매를 개발했다고 8일 밝혔다.
연구팀이 개발한 전기 촉매는 구리 금속 폼(Cu foam)과 니켈-철 층상이중수산화물(NiFe Layered double hydroxide)의 복합체로 구성돼 있다. 구리 폼은 질산염을 선택적으로 흡착하고, 니켈-철 층상이중수산화물은 화학이나 생체반응을 통해 반응 중 생성된 중간체 수소 라디칼을 생성해 구리 폼에 전달함으로써 질산염이 암모니아로 바뀌도록 효율적으로 진행한다. 구리, 철, 니켈 모두 귀금속과 비교해 지구에 풍부하고 비교적 저렴하므로 연구팀이 개발한 기술은 친환경적이고 경제적인 원천기술이다.
이 기술은 질산염을 통해 직접적으로 암모니아를 생산할 수 있을 뿐 아니라, 기존 질산염 환원의 가장 큰 문제였던 저농도 질산염 수용액에서도 좋은 성능을 갖는다. 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 저농도 폐수를 이용해 암모니아를 생산할 수 있어 경제적이고 실용적이다는 특성을 가진다.
김건한 박사 (現 옥스퍼드 대학교 화학과, KAIST 신소재공학과 졸업생)가 제1 저자로 참여하고, 더모트 오헤어 교수 (옥스퍼드 대학교 화학과) 연구팀이 공동으로 참여한 강정구 교수 연구팀의 이번 연구 결과는 에너지 및 환경 분야 국제 학술지 `에너지 환경 과학(Energy & Environmental Science, IF 39.71)' 1월 24일 字 온라인 게재됐다. (논문명: Energy-efficient electrochemical ammonia production from dilute nitrate solution)
현재 암모니아 생산은 대부분 `하버-보쉬 공정'을 통해 생산된다. 이 공정은 고온, 고압의 합성 조건을 전제로 하기 때문에 안전성에서 문제를 갖고 있을 뿐만 아니라 값비싼 수소 기체를 반응물로 이용하기 때문에 경제성 문제를 동시에 유발한다. 이에 대한 대안으로, 친환경적이며 값싸고 풍부한 질소 기체를 직접 전기 환원시키는 전기화학적 질소 환원법도 수용액에 대한 낮은 용해도와 강한 질소-질소 삼중결합 때문에 발생하는 낮은 효율로 큰 문제를 겪고 있다.
반면, 전기에너지를 이용해 질산염을 암모니아로 환원시키는 전기화학적 질산염 환원법은 수용액에 잘 녹는 질산염과 상대적으로 더 약한 질소-산소 결합에너지로 질소 환원법보다 더 높은 효율을 가지고 있다. 하지만, 기존의 질산염 전기 촉매의 경우, 경쟁 반응인 물 환원 반응으로 인해 암모니아로의 환원 효율이 떨어진다는 단점을 가지고 있다. 또한, 실제 하천이나 강물, 혹은 여러 질산염을 배출하는 폐수의 경우, 약 10mM(밀리몰) 이하 낮은 농도의 질산염을 포함하고 있는데, 저농도에서 촉매 특성이 급격히 떨어진다는 특성이 있다.
이에 강정구 교수 연구팀은 표면적이 넓은 구리 금속 폼을 호스트로 사용하여 저농도의 질산염이 효율적으로 흡착될 수 있도록 했다. 한편, 호스트인 구리 금속 폼에 수소 라디칼 생성이 가능한 니켈-철 층상이중산화물을 포함하는 `구리 금속 폼/니켈-철 층상이중수산화물' 복합체를 형성하였는데, 니켈-철 층상이중수산화물의 전기전도도가 낮아 질산염 환원이 일어나는 전압에서 수소-수소 결합을 통한 수소가스 (H2)를 생성하지 않고 효율적으로 수소 라디칼 (H)을 물로부터 만들 수 있었다.
강정구 교수는 "친환경적인 전기에너지를 이용해 질산염 환원법으로 암모니아를 생성하는 경우, 주로 메탄 리포밍을 통해 생산되는 값비싼 수소 기체를 이용하며 고온/고압의 반응 조건으로 유발되는 안전성 문제를 가진 하버-보쉬 공정을 효과적으로 대체할 수 있다ˮ라고 소개하면서 "특히, 반응 자리와 수소 라디칼 자리가 분리된 촉매 구조를 통해 저농도 질산염에서도 효율적으로 암모니아를 생성할 수 있기 때문에, 실제 강물, 하천, 공장 폐수에 포함돼있는 질산염을 농축시키는 과정 없이도 효율적으로 암모니아를 생산할 수 있어 질산염을 통한 암모니아 생산의 상용화에 이바지할 것이다ˮ고 말했다.
한편 이번 연구는 과학기술정보통신부 나노 및 소재기술개발사업 미래기술연구실의 지원을 받아 수행됐다.
2023.02.08 조회수 3794 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 4372
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 4372 여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 3737
여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 3737 해킹 동아리 GoN, 국내·외 각종 대회 석권
우리 대학 정보보안 및 해킹 동아리 GoN이 국내·외 각종 대회를 석권했다.
GoN은 지난달 7일부터 이틀간 과학기술정보통신부 주최로 열린 국제해킹방어대회 '코드게이트 2022'에서 대학생부 1위를 차지해 과기정통부 장관상과 상금 1천만 원을 수상했다.
'코드게이트 2022'는 세계 최고의 화이트해커들이 실력을 겨루는 국제적인 해킹방어대회로 2008년 시작돼 올해로 14번째 대회를 맞았다. 이번 대회에는 일반부 48개국 2,647개 팀, 대학생부 국내 8개 대학 225개 팀, 주니어부 27개국 196명이 참가했다. GoN에서는 김동옥(전산학부 18), 민승기(화학과 17), 박창완(전기및전자공학부 17), 허현(전산학부 20) 학생이 팀을 이뤄 1박 2일간 경연을 펼쳤으며, 숭실대 '해군 해난구조전대' 팀과 고려대 'CyKor'팀이 각각 2위와 3위에 올랐다.
또한, 지난 10월 개최된 2022 암호분석경진대회에서도 일반부 대상을 차지하는 성과를 거뒀다.
암호분석경진대회는 암호분석 기술 발전 및 암호해독 분야의 우수 인재를 발굴하기 위해 국방암호특화연구센터가 주최하고 777사령부가 후원하는 대회로 고등학생부터 일반인까지 모두 참가할 수 있다. 올해 대회는 ▲ 대칭키 암호 ▲ 블록체인 ▲ 임베디드 시스템 상에서의 암호 최적화 ▲ 암호에 대한 부채널 공격 ▲ 해시 함수 ▲ 양자내성 암호 등의 분야가 문제로 출제되었다. GoN에서는 박창완(전기및전자공학부 17), 민승기(화학과 17), 최유빈(새내기과정학부 22), 이재웅(전산학부 20) 학생이 참가해 암호 최적화, 양자내성 암호 분야에서 우수한 성적을 거둬 국방부장관상인 대상과 상금 600만 원을 수상했다. 허현 GoN 회장은 "연이은 대회 입상으로 우리 동아리의 저력을 보여준 것 같아 기쁘고 뿌듯하다"라며, "앞으로도 활발하게 활동해 좋은 성과가 나올 수 있도록 노력하겠다"라고 소감을 전했다.
2022.12.05 조회수 4126
해킹 동아리 GoN, 국내·외 각종 대회 석권
우리 대학 정보보안 및 해킹 동아리 GoN이 국내·외 각종 대회를 석권했다.
GoN은 지난달 7일부터 이틀간 과학기술정보통신부 주최로 열린 국제해킹방어대회 '코드게이트 2022'에서 대학생부 1위를 차지해 과기정통부 장관상과 상금 1천만 원을 수상했다.
'코드게이트 2022'는 세계 최고의 화이트해커들이 실력을 겨루는 국제적인 해킹방어대회로 2008년 시작돼 올해로 14번째 대회를 맞았다. 이번 대회에는 일반부 48개국 2,647개 팀, 대학생부 국내 8개 대학 225개 팀, 주니어부 27개국 196명이 참가했다. GoN에서는 김동옥(전산학부 18), 민승기(화학과 17), 박창완(전기및전자공학부 17), 허현(전산학부 20) 학생이 팀을 이뤄 1박 2일간 경연을 펼쳤으며, 숭실대 '해군 해난구조전대' 팀과 고려대 'CyKor'팀이 각각 2위와 3위에 올랐다.
또한, 지난 10월 개최된 2022 암호분석경진대회에서도 일반부 대상을 차지하는 성과를 거뒀다.
암호분석경진대회는 암호분석 기술 발전 및 암호해독 분야의 우수 인재를 발굴하기 위해 국방암호특화연구센터가 주최하고 777사령부가 후원하는 대회로 고등학생부터 일반인까지 모두 참가할 수 있다. 올해 대회는 ▲ 대칭키 암호 ▲ 블록체인 ▲ 임베디드 시스템 상에서의 암호 최적화 ▲ 암호에 대한 부채널 공격 ▲ 해시 함수 ▲ 양자내성 암호 등의 분야가 문제로 출제되었다. GoN에서는 박창완(전기및전자공학부 17), 민승기(화학과 17), 최유빈(새내기과정학부 22), 이재웅(전산학부 20) 학생이 참가해 암호 최적화, 양자내성 암호 분야에서 우수한 성적을 거둬 국방부장관상인 대상과 상금 600만 원을 수상했다. 허현 GoN 회장은 "연이은 대회 입상으로 우리 동아리의 저력을 보여준 것 같아 기쁘고 뿌듯하다"라며, "앞으로도 활발하게 활동해 좋은 성과가 나올 수 있도록 노력하겠다"라고 소감을 전했다.
2022.12.05 조회수 4126 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 4724
악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 4724 항암효과 갖는 세큐리네가 천연물의 총괄적 합성 원천기술 개발
우리 대학 화학과 한순규 교수 연구팀이 항암효과를 가지는 고산화준위 세큐리네가 알칼로이드*의 총괄적인 합성 방법을 개발했다고 30일 밝혔다.
* 알칼로이드란 질소를 함유하는 알칼리성의 유기물질을 말하는데 그 중 한국에서도 자생하는 식물인 광대싸리(학명: Securinega Suffruticosa)에서 주로 추출되고 이 식물 내에서 생합성적인 산화 대사가 일어난 알칼로이드를 통틀어 고산화준위 세큐리네가 알칼로이드라고 칭한다.
한 교수 연구팀은 반응 조건의 세심한 설계를 통해 세큐리네가 골격의 특정 위치에 원하는 반응이 일어나도록 해 7종의 세큐리네가 알칼로이드를 총괄적으로 합성하는 데 성공했다. 합성 천연물 중 세큐린진(securingine) D는 다양한 암세포에 대해 높은 항암 활성을 가지는 만큼, 이번 연구 결과에 기반한 항암제 개발연구도 기대된다.
화학과 박상빈 석박사통합과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 9월 2일자에 게재됐다. (논문명 : Collective total synthesis of C4-oxygenated securinine-type alkaloids via stereocontrolled diversifications on the piperidine core)
천연물 전합성(total synthesis)은 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 복잡한 천연물을 인위적으로 합성하는 학문 분야다. 목표 물질의 가능한 합성 경로를 찾으면서 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 천연물에 도달할 수 있는 하이-리스크 하이-리턴의 연구 분야다.
한 교수 연구팀은 자연에서 여러 효소의 작용을 통해 이루어지는 세큐리네가 골격의 산화, 원자 재배열 등을 인공적으로 구현해 천연물의 합성을 이뤄냈을 뿐만 아니라 기본 골격의 탄소 배열을 상호변환하는 기법을 최초로 개발해내 세큐리네가 화학에 새로운 지평을 열었다.
이번 연구를 통해 합성에 성공한 천연물로 세큐리티닌(securitinine), 세큐아마민(secu'amamine) D, 세큐린진(securingine) A, C, D, 필란틴(phyllanthine), 4-에피-필란틴(4-epi-phyllanthine)이 있으며, 이 중 필란틴을 제외하고는 모두 세계 최초의 합성이다.
그 중 세큐린진 D는 높은 항암효과를 가져 의약적 연구가 수반돼야 하지만 자연계에서 극소량만 추출돼 추가적인 생리활성 연구에 어려움이 있었다. 한 교수 연구팀에서 이를 인공적으로 합성하는 방법을 개발하면서 그러한 연구에도 박차를 가할 수 있게 됐다.
천연물은 처음 추출된 뒤 분광학적 기법을 통해 그 구조를 밝히는데, 이 과정에서 오류가 생기는 경우가 종종 있다. 천연물 전합성은 이러한 오류를 해결하는 데에 있어 `최종 병기'와 같은 역할을 한다. 세큐린진 A, C, D의 경우, 계산 화학적 기법을 통해 기존과 다른 구조 후보가 제안된 바 있는데, 연구팀은 이번 합성 연구를 통해 새로 제안된 구조가 천연물의 실제 구조라는 것을 입증해냈다.
화학과 한순규 교수는 "이번 연구를 통해 모든 고산화준위 세큐리네가 알칼로이드의 합성 전략을 세우는 기반을 마련할 수 있었다ˮ며 "연구팀은 여기서 멈추지 않고 이 연구 성과를 퇴행성 신경질환 치료 효과가 있다고 알려진 더욱 복잡한 이합체 고산화준위 세큐리네가 알칼로이드의 합성 연구에도 활발히 응용할 계획이다ˮ라고 밝혔다.
한편 이번 연구는 한국연구재단 이공분야 기초연구사업 중견연구자지원사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2022.09.30 조회수 4513
항암효과 갖는 세큐리네가 천연물의 총괄적 합성 원천기술 개발
우리 대학 화학과 한순규 교수 연구팀이 항암효과를 가지는 고산화준위 세큐리네가 알칼로이드*의 총괄적인 합성 방법을 개발했다고 30일 밝혔다.
* 알칼로이드란 질소를 함유하는 알칼리성의 유기물질을 말하는데 그 중 한국에서도 자생하는 식물인 광대싸리(학명: Securinega Suffruticosa)에서 주로 추출되고 이 식물 내에서 생합성적인 산화 대사가 일어난 알칼로이드를 통틀어 고산화준위 세큐리네가 알칼로이드라고 칭한다.
한 교수 연구팀은 반응 조건의 세심한 설계를 통해 세큐리네가 골격의 특정 위치에 원하는 반응이 일어나도록 해 7종의 세큐리네가 알칼로이드를 총괄적으로 합성하는 데 성공했다. 합성 천연물 중 세큐린진(securingine) D는 다양한 암세포에 대해 높은 항암 활성을 가지는 만큼, 이번 연구 결과에 기반한 항암제 개발연구도 기대된다.
화학과 박상빈 석박사통합과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 9월 2일자에 게재됐다. (논문명 : Collective total synthesis of C4-oxygenated securinine-type alkaloids via stereocontrolled diversifications on the piperidine core)
천연물 전합성(total synthesis)은 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 복잡한 천연물을 인위적으로 합성하는 학문 분야다. 목표 물질의 가능한 합성 경로를 찾으면서 각 단계의 화학반응이 모두 성공적으로 이뤄져야만 목표하는 천연물에 도달할 수 있는 하이-리스크 하이-리턴의 연구 분야다.
한 교수 연구팀은 자연에서 여러 효소의 작용을 통해 이루어지는 세큐리네가 골격의 산화, 원자 재배열 등을 인공적으로 구현해 천연물의 합성을 이뤄냈을 뿐만 아니라 기본 골격의 탄소 배열을 상호변환하는 기법을 최초로 개발해내 세큐리네가 화학에 새로운 지평을 열었다.
이번 연구를 통해 합성에 성공한 천연물로 세큐리티닌(securitinine), 세큐아마민(secu'amamine) D, 세큐린진(securingine) A, C, D, 필란틴(phyllanthine), 4-에피-필란틴(4-epi-phyllanthine)이 있으며, 이 중 필란틴을 제외하고는 모두 세계 최초의 합성이다.
그 중 세큐린진 D는 높은 항암효과를 가져 의약적 연구가 수반돼야 하지만 자연계에서 극소량만 추출돼 추가적인 생리활성 연구에 어려움이 있었다. 한 교수 연구팀에서 이를 인공적으로 합성하는 방법을 개발하면서 그러한 연구에도 박차를 가할 수 있게 됐다.
천연물은 처음 추출된 뒤 분광학적 기법을 통해 그 구조를 밝히는데, 이 과정에서 오류가 생기는 경우가 종종 있다. 천연물 전합성은 이러한 오류를 해결하는 데에 있어 `최종 병기'와 같은 역할을 한다. 세큐린진 A, C, D의 경우, 계산 화학적 기법을 통해 기존과 다른 구조 후보가 제안된 바 있는데, 연구팀은 이번 합성 연구를 통해 새로 제안된 구조가 천연물의 실제 구조라는 것을 입증해냈다.
화학과 한순규 교수는 "이번 연구를 통해 모든 고산화준위 세큐리네가 알칼로이드의 합성 전략을 세우는 기반을 마련할 수 있었다ˮ며 "연구팀은 여기서 멈추지 않고 이 연구 성과를 퇴행성 신경질환 치료 효과가 있다고 알려진 더욱 복잡한 이합체 고산화준위 세큐리네가 알칼로이드의 합성 연구에도 활발히 응용할 계획이다ˮ라고 밝혔다.
한편 이번 연구는 한국연구재단 이공분야 기초연구사업 중견연구자지원사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2022.09.30 조회수 4513 유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 4226
유방암 환자의 면역 항암치료 원리 발견해 효과적인 치료 전략 제시
우리 대학 의과학대학원 신의철 교수 연구팀이 연세대학교 의과대학 김승일 교수, 가톨릭대 의과대학 박우찬 교수 연구팀과 공동 연구를 통해 유방암 환자의 면역 항암치료 핵심 원리를 발견했다고 14일 밝혔다.
이번 연구를 통해, 최근 유행하는 면역 항암치료에 좋은 반응을 보일 것으로 예상되는 유방암 환자들을 선별해 효과적인 암 치료 전략을 제시할 것으로 기대된다.
연세대학교 의과대학 외과학 교실 이용준 강사, 김지예 임상 조교수가 공동 제1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 `사이언스 면역학(Science Immunology)' 8월 26일 字 온라인판에 게재됐다. (논문명 : CD39+ tissue-resident memory CD8+ T cells with a clonal overlap across compartments mediate anti-tumor immunity in breast cancer)
암 환자는 암세포에 대항해 이를 제거하는 역할을 하는 세포독성 T세포의 기능이 현저히 약해져 암세포에 대한 효과적인 면역반응을 나타내지 못한다. 이러한 세포독성 T세포 약화의 주된 이유는 PD-1이라는 세포독성 T세포의 기능을 저하하는 억제 수용체가 종양 조직 내 세포독성 T세포에 과다하게 발현되기 때문으로 알려져 있다.
최근 유행하고 있는 면역항암제의 기본원리는 바로 이 PD-1 억제 수용체의 기능을 차단해 약화돼 있던 세포독성 T세포의 기능을 회복시키는 것이다. 이러한 면역항암제는 유방암 환자에게서 기존의 치료를 대체할 수 있는 표준치료로 자리 잡아 가고 있지만, 투여받은 유방암 환자 중 일부에서만 치료 효과가 나타나며 이에 대한 이유를 알지 못하고 있다. 따라서, 많은 연구자가 유방암에서 면역 항암치료의 기전을 이해하고 치료에 효과를 보이는 환자를 선별하고자 하는 연구를 활발히 수행하고 있다.
이번 연구에서 공동 연구팀은 종양 조직에 존재하는 세포독성 T세포 중에서도 CD39 단백질과 조직 상주 마커 단백질을 동시에 발현하는 조직 상주 기억 T세포(CD39+ tissue-resident memory CD8+ T cell)가 유방암 환자에서 효과적인 항암 면역반응을 매개하는 핵심 면역세포임을 새롭게 밝혔다.
종양 조직에 존재하는 세포독성 T세포 중에는 항암 면역반응에 영향을 주지 않는 방관자(bystander) 세포들이 존재한다는 사실은 이미 잘 알려져 있었다. 이렇게 항암 면역반응과는 상관없는 방관자 세포들도 종양 조직에 있기 때문에 암 환자의 항암 면역반응을 정확히 측정하고 분석하는 데 어려움이 있었다. 연구팀은 CD39 단백질과 조직 상주 마커 단백질의 발현을 측정해 항암 면역반응과 관련이 있는 세포독성 T세포들만 분리해 개별 환자의 항암 면역반응을 정확히 측정할 수 있음을 새롭게 밝혔다.
그리고 유방암 환자에서 CD39를 발현하는 조직 상주 기억 세포독성 T세포는 특징적으로 삼중음성유방암(triple-negative breast cancer) 환자에게서 증가해 있었고, CD39를 발현하는 조직 상주 기억 세포독성 T세포가 증가해 있는 유방암 환자들은 수술 이후에도 재발이 적게 나타나는 등 좋은 예후를 보였다.
이번 연구에서 연구팀은 유방암 환자에서 면역항암제 치료 효율을 높이는 전략을 제시했다. 구체적으로, CD39를 발현하는 조직 상주 기억 세포독성 T세포들이 PD-1을 차단하는 면역항암제 처리에 반응해 그 기능이 효과적으로 회복됐다. 그리고 CTLA-4라는 다른 억제 수용체까지 함께 차단하자 세포독성 T세포의 기능 회복은 더욱 크게 나타났다. 따라서 이러한 면역항암제의 병용요법을 CD39 발현 조직 상주 기억 세포독성 T세포가 증가해 있는 환자들에게 선별적으로 사용한다면 치료 효과를 극대화할 수 있을 것으로 기대할 수 있다.
이번 연구는 연세대학교 및 가톨릭대 의과대학 외과 연구팀과 KAIST 의과학대학원이 유방암 환자의 항암 면역반응 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로서 중개 연구(translational research)의 주요 성과로 평가받는다.
신의철 교수는 "이번 연구는 항암 면역반응의 메커니즘과 측정에 대해 상세히 연구함으로써 유방암에서 새로운 임상 치료 전략을 제시하게 된 중요한 연구ˮ라며 "향후 암 환자의 생존율을 보다 높일 수 있도록 항암 면역반응 연구 및 면역 항암치료의 *적응증에 관한 연구를 계속하겠다ˮ라고 말했다.
☞ 적응증(indication): 어떠한 약제나 수술 따위에 의하여 치료 효과가 기대되는 병이나 증상
2022.09.14 조회수 4226 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 5670
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 5670 2022 실리콘밸리 글로벌 창업 부트 캠프 성료
우리 대학이 예비 창업자 및 초기 창업자를 위한 '2022 실리콘밸리 글로벌 창업 부트 캠프(Global Entrepreneurship Summer Camp, 이하 GESC)'를 개최해 성공적으로 마무리했다. 국제협력처 글로벌사업기획센터(처장 임만성)와 창업원(원장 김영태)이 공동주최한 '2022 KAIST GESC' 프로그램은 교내에서 처음 시행하는 실리콘밸리 산-학 연계 창업 부트캠프 프로그램이다. 실리콘밸리 현지를 방문해 창업 기업의 사례를 체험하는 기회를 제공하고, 향후 실리콘밸리로 진출할 수 있는 네트워크를 마련해주고자 시범적으로 기획되었다.
이를 위해, 재학생을 포함한 예비 창업자와 법인설립 1년 이내의 초기 창업자 등 총 20명을 이달 초 선발했다. 선발된 학생 중에는 KAIST에 재학 중인 에티오피아·멕시코·인도네시아·키르기스스탄 등 다양한 국적의 외국인 학생들도 포함되어 있어 국적을 초월한 글로벌 팀워크의 중요성을 상기하는 계기가 되었다. 참가자들은 일주일간의 국내 교육을 수료한 후 지난 27일부터 미국 스탠퍼드 대학교, 실리콘밸리 코트라 무역관(관장 박용민) 및 현지 기업을 방문해 실리콘밸리 내 우리 대학 동문 및 현지 전문가들과 협력하는 창업 교육 및 스타트업 현장 체험을 진행했다. 실리콘밸리 코트라 무역관에서는 현지의 엑셀러레이터(accelerator)와 KAIST의 학생팀을 연계시켜 각 팀의 비즈니스 아이템과 모델이 글로벌 시장가치를 창출하는 사업으로 발전할 수 있도록 돕는 시간이 마련됐다. 특히, 실리콘밸리에서 성장하고 있는 모션투에이아이(Motion2AI, 대표 김병수), 임프리메드(ImpriMed, 대표 임성원), 메딕 라이프 사이언스(Medic Life Sciences, 대표 한규호) 등의 기업이 창업에 대한 열정과 도전정신을 불어넣어줄 강연과 스타트업 현장 방문 등으로 함께했다. 창업 교육 워크숍의 일부를 주관한 스탠퍼드 대학교 기술 벤처 프로그램(The Stanford Technology Ventures Program, 이하 STVP)의 모윤 르이 펑(Mo-Yun Lei Fong) 원장은 "KAIST와의 협력해 기획된 이번 워크숍을 통해 미래의 기업가들을 글로벌 시민으로 육성하고자 하는 STVP의 비전을 실현하고 특히, 한국의 학생들에게 글로벌 기업가가 되기 위해 반드시 필요한 통찰력에 대하여 알려주는 기회가 마련되어 기뻤다"라고 밝혔다. 이어, "STVP 또한 이번 프로그램을 기획하면서 한국 대학과의 네트워크가 구축되었고, KAIST 학생들과의 소통하며 한국의 문화와 아이디어를 이해하고 글로벌 문화와 관련된 커리큘럼을 개선할 수 있었다"라고 덧붙였다. 선발된 학생들은 국내·외에서 2주간 진행한 글로벌 창업교육에서 습득한 내용을 바탕으로 사업계획서를 작성하고, 미국 현지 창업 액셀러레이터인 '플러그 앤 플레이(Plug and Play)'에서 투자자를 초청해 지난 1일 최종 피칭을 펼쳤다. 최종 피칭에 앞서 이종문 암벡스 벤처 파트너스(AmBex Venture Partners) 회장이 특별 강연해 학생들에게 글로벌 기업가 정신을 바탕으로 한 사회적 기여의 중요성을 역설했다.참가자들은 최종 피칭에서 메타버스 데이트 서비스 · AI 소음차단 베개 · VR 원격회의 오피스 · AI 한국어 튜터링 앱 등 다양한 기술을 적용한 창의적인 사업 아이템을 발표했으며, 2주간이라는 짧은 기간 동안 준비해 우수한 수준의 피칭을 선보여 심사위원들의 호평을 받았다. 그중 1위는 항공우주공학과, 기술경영학부, 수리과학과, 생명화학공학과 등 다양한 학과의 학생으로 구성된 '보드 KAIST 요트 클럽(Bored KAIST Yacht Club)'팀의 '메타-에버랜드(Meta-Everland)'가 선정됐다. 이승희 기술경영학부 석사과정 학생은 "우리팀의 아이템은 메타데이트를 통해 실시간으로 오프라인과 유사한 데이트를 경험할 수 있게 하는 서비스"라며, "이번 프로그램을 통해 창업이 어려운 것이 아닌, 누구나 재미있게 도전해 볼 수 있는 경험이라는 사실을 알게 되었다"라고 전했다. 이어, "실리콘밸리 현지에서 활동하고 있는 투자자나 엑셀러레이터의 심사와 조언을 받으며 흥미로운 아이디어만 가지고도 투자자나 심사위원의 관심을 받을 수 있다는 중요한 사실을 깨달았다"라고 소감을 밝혔다. 피칭 1위를 차지한 팀은 흥미로운 사업 아이템과 우수한 팀워크로 프로그램 기간 중 멘토로 활동한 현지 엑셀러레이터로부터 실리콘밸리 현지의 사업파트너를 소개받기도 했다. 또한, 프로그램에 함께 참가한 황병훈 생명화학공학과 석사과정 학생은 "실리콘밸리 최전선에서 일하고 있는 사람들이 어떤 태도나 마음가짐으로 일하고 있는지 알게 되어 졸업 후 진로와 스타트업 창업을 생각하는 시야가 많이 확장되었다"라고 소감을 전했다. 몬드라곤 마리나(MONDRAGON MARINA) 글로벌 정보통신 기술 프로그램 석사과정 학생은 "실리콘밸리에서 활동하고 있는 스타트업 CEO를 만나 대화하며 실리콘밸리와 한국의 창업 에코 시스템의 다른 점을 배울 수 있어 뜻깊었다"라고 말했다.
윤상수 주샌프란시스코 총영사는 "이번 프로그램이 지속적으로 발전한다면 과학기술을 통한 혁신적인 기술 가치를 창출할 수 있을 것으로 기대된다"라고 말하며 "총영사관에서도 프로그램이 잘 지속될 수 있도록 협조할 계획이다"라고 덧붙였다.
실리콘밸리 교육에 학생들을 인솔한 임만성 국제협력처장은 "KAIST에서 처음으로 시행한 실리콘밸리 산-학 연계 창업 부트캠프인 만큼 학생들이 더욱더 넓은 시야를 가지고 글로벌 창업의 꿈을 키우는 멋진 기회가 되었을 것으로 생각한다"라고 말했다.
프로그램을 공동 주최한 김영태 창업원장은 "이번 교육 프로그램을 통해 개발된 우수한 사업 아이템이 글로벌 시장에서 경쟁력을 갖출 수 있도록 창업원의 다양한 프로그램을 통해 지원할 계획"이라고 전했다. 한편, 글로벌사업기획센터와 창업원은 이번 프로그램의 성공적인 개최를 발판삼아 글로벌 시장에서 경쟁력을 갖춘 예비 창업가를 육성하기 위한 'KAIST GESC' 프로그램을 지속 발전시킬 예정이다.
2022.07.04 조회수 6317
2022 실리콘밸리 글로벌 창업 부트 캠프 성료
우리 대학이 예비 창업자 및 초기 창업자를 위한 '2022 실리콘밸리 글로벌 창업 부트 캠프(Global Entrepreneurship Summer Camp, 이하 GESC)'를 개최해 성공적으로 마무리했다. 국제협력처 글로벌사업기획센터(처장 임만성)와 창업원(원장 김영태)이 공동주최한 '2022 KAIST GESC' 프로그램은 교내에서 처음 시행하는 실리콘밸리 산-학 연계 창업 부트캠프 프로그램이다. 실리콘밸리 현지를 방문해 창업 기업의 사례를 체험하는 기회를 제공하고, 향후 실리콘밸리로 진출할 수 있는 네트워크를 마련해주고자 시범적으로 기획되었다.
이를 위해, 재학생을 포함한 예비 창업자와 법인설립 1년 이내의 초기 창업자 등 총 20명을 이달 초 선발했다. 선발된 학생 중에는 KAIST에 재학 중인 에티오피아·멕시코·인도네시아·키르기스스탄 등 다양한 국적의 외국인 학생들도 포함되어 있어 국적을 초월한 글로벌 팀워크의 중요성을 상기하는 계기가 되었다. 참가자들은 일주일간의 국내 교육을 수료한 후 지난 27일부터 미국 스탠퍼드 대학교, 실리콘밸리 코트라 무역관(관장 박용민) 및 현지 기업을 방문해 실리콘밸리 내 우리 대학 동문 및 현지 전문가들과 협력하는 창업 교육 및 스타트업 현장 체험을 진행했다. 실리콘밸리 코트라 무역관에서는 현지의 엑셀러레이터(accelerator)와 KAIST의 학생팀을 연계시켜 각 팀의 비즈니스 아이템과 모델이 글로벌 시장가치를 창출하는 사업으로 발전할 수 있도록 돕는 시간이 마련됐다. 특히, 실리콘밸리에서 성장하고 있는 모션투에이아이(Motion2AI, 대표 김병수), 임프리메드(ImpriMed, 대표 임성원), 메딕 라이프 사이언스(Medic Life Sciences, 대표 한규호) 등의 기업이 창업에 대한 열정과 도전정신을 불어넣어줄 강연과 스타트업 현장 방문 등으로 함께했다. 창업 교육 워크숍의 일부를 주관한 스탠퍼드 대학교 기술 벤처 프로그램(The Stanford Technology Ventures Program, 이하 STVP)의 모윤 르이 펑(Mo-Yun Lei Fong) 원장은 "KAIST와의 협력해 기획된 이번 워크숍을 통해 미래의 기업가들을 글로벌 시민으로 육성하고자 하는 STVP의 비전을 실현하고 특히, 한국의 학생들에게 글로벌 기업가가 되기 위해 반드시 필요한 통찰력에 대하여 알려주는 기회가 마련되어 기뻤다"라고 밝혔다. 이어, "STVP 또한 이번 프로그램을 기획하면서 한국 대학과의 네트워크가 구축되었고, KAIST 학생들과의 소통하며 한국의 문화와 아이디어를 이해하고 글로벌 문화와 관련된 커리큘럼을 개선할 수 있었다"라고 덧붙였다. 선발된 학생들은 국내·외에서 2주간 진행한 글로벌 창업교육에서 습득한 내용을 바탕으로 사업계획서를 작성하고, 미국 현지 창업 액셀러레이터인 '플러그 앤 플레이(Plug and Play)'에서 투자자를 초청해 지난 1일 최종 피칭을 펼쳤다. 최종 피칭에 앞서 이종문 암벡스 벤처 파트너스(AmBex Venture Partners) 회장이 특별 강연해 학생들에게 글로벌 기업가 정신을 바탕으로 한 사회적 기여의 중요성을 역설했다.참가자들은 최종 피칭에서 메타버스 데이트 서비스 · AI 소음차단 베개 · VR 원격회의 오피스 · AI 한국어 튜터링 앱 등 다양한 기술을 적용한 창의적인 사업 아이템을 발표했으며, 2주간이라는 짧은 기간 동안 준비해 우수한 수준의 피칭을 선보여 심사위원들의 호평을 받았다. 그중 1위는 항공우주공학과, 기술경영학부, 수리과학과, 생명화학공학과 등 다양한 학과의 학생으로 구성된 '보드 KAIST 요트 클럽(Bored KAIST Yacht Club)'팀의 '메타-에버랜드(Meta-Everland)'가 선정됐다. 이승희 기술경영학부 석사과정 학생은 "우리팀의 아이템은 메타데이트를 통해 실시간으로 오프라인과 유사한 데이트를 경험할 수 있게 하는 서비스"라며, "이번 프로그램을 통해 창업이 어려운 것이 아닌, 누구나 재미있게 도전해 볼 수 있는 경험이라는 사실을 알게 되었다"라고 전했다. 이어, "실리콘밸리 현지에서 활동하고 있는 투자자나 엑셀러레이터의 심사와 조언을 받으며 흥미로운 아이디어만 가지고도 투자자나 심사위원의 관심을 받을 수 있다는 중요한 사실을 깨달았다"라고 소감을 밝혔다. 피칭 1위를 차지한 팀은 흥미로운 사업 아이템과 우수한 팀워크로 프로그램 기간 중 멘토로 활동한 현지 엑셀러레이터로부터 실리콘밸리 현지의 사업파트너를 소개받기도 했다. 또한, 프로그램에 함께 참가한 황병훈 생명화학공학과 석사과정 학생은 "실리콘밸리 최전선에서 일하고 있는 사람들이 어떤 태도나 마음가짐으로 일하고 있는지 알게 되어 졸업 후 진로와 스타트업 창업을 생각하는 시야가 많이 확장되었다"라고 소감을 전했다. 몬드라곤 마리나(MONDRAGON MARINA) 글로벌 정보통신 기술 프로그램 석사과정 학생은 "실리콘밸리에서 활동하고 있는 스타트업 CEO를 만나 대화하며 실리콘밸리와 한국의 창업 에코 시스템의 다른 점을 배울 수 있어 뜻깊었다"라고 말했다.
윤상수 주샌프란시스코 총영사는 "이번 프로그램이 지속적으로 발전한다면 과학기술을 통한 혁신적인 기술 가치를 창출할 수 있을 것으로 기대된다"라고 말하며 "총영사관에서도 프로그램이 잘 지속될 수 있도록 협조할 계획이다"라고 덧붙였다.
실리콘밸리 교육에 학생들을 인솔한 임만성 국제협력처장은 "KAIST에서 처음으로 시행한 실리콘밸리 산-학 연계 창업 부트캠프인 만큼 학생들이 더욱더 넓은 시야를 가지고 글로벌 창업의 꿈을 키우는 멋진 기회가 되었을 것으로 생각한다"라고 말했다.
프로그램을 공동 주최한 김영태 창업원장은 "이번 교육 프로그램을 통해 개발된 우수한 사업 아이템이 글로벌 시장에서 경쟁력을 갖출 수 있도록 창업원의 다양한 프로그램을 통해 지원할 계획"이라고 전했다. 한편, 글로벌사업기획센터와 창업원은 이번 프로그램의 성공적인 개최를 발판삼아 글로벌 시장에서 경쟁력을 갖춘 예비 창업가를 육성하기 위한 'KAIST GESC' 프로그램을 지속 발전시킬 예정이다.
2022.07.04 조회수 6317