-
 심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
2025.05.15
조회수 3667
-
 빛으로 기억 조절해 정신질환 치료 가능성 열어
우리 뇌에 과도한 기억이 형성되면 극심한 공포와 관련된 기억이 제대로 소멸되지 않아 발생하는 PTSD 같은 정신질환의 원인이 된다고 한다. 우리 연구진이 빛으로 단백질의 활성을 조절하는 광유전학 기술을 개발하고 이를 통해 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성을 열어 화제다.
우리 대학 생명과학과 허원도 교수 연구팀이 뇌에서 기억 형성을 조절하는 새로운 메커니즘을 밝혀냈다. 연구팀은 다양한 뇌 신경전달물질들에 의해 활성화되는 대표적인 세포내 신호전달분자효소인 PLCβ1 단백질*에 집중했다. 이번 연구는 기억 형성과 소멸을 조절하는 데 중요한 역할을 하는 단백질(PLCβ1)의 기능을 규명하였으며, PTSD와 같은 과도한 기억 형성에 의한 정신질환의 새로운 분자적 기전을 밝히는데 기여했다.
*PLCβ1 단백질: 인산지질 가수분해효소 C 베타 1
우리 뇌는 매일 다양한 경험을 통해 새로운 기억을 형성하고 소멸시킨다. 기억 형성과정은 해마라는 뇌 부위에서 이루어지며, 여기서는 양성적 신호와 음성적 신호가 균형을 맞추어 최적의 기억 형성을 유지한다. 그러나 양성 조절 인자가 부족하면 기억 형성에 문제가 생기고, 음성 조절 인자가 손상되면 과도한 기억이 형성된다. 이러한 과도한 기억 형성은 PTSD와 같은 정신질환의 원인이 될 수 있다.
허원도 교수 연구팀은 세계 최초로 단백질(PLCβ1)이 해마에서 기억 억제자로 작용하여 과도한 기억 형성을 억제하는 중요한 역할을 하는 등 동 단백질이 해마에서 특히 중요한 역할을 한다는 것을 밝혔다.
연구팀은 단백질(PLCβ1)을 결핍시킨 마우스에서 과도한 기억 형성과 공포 반응이 증가하는 것을 발견하였고, 반대로 동 단백질이 과발현하거나 광유전학으로 활성화시키면 과도한 공포 반응이 억제되는 것을 확인하였다. 이는 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 하며, 적절한 기억 형성을 유도함을 의미한다.
연구팀은 빛으로 제어하는 광유전학 기술을 개발하여 단백질(PLCβ1)의 기능을 정밀하게 조절하였다. 이 기술은 빛을 이용해 특정 단백질을 활성화하거나 비활성화할 수 있어, 뇌의 특정 부위에서 일어나는 신경 활동을 정밀하게 제어할 수 있다. 이를 통해 연구팀은 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 입증하였다. 이는 광유전학 기술이 신경 과학 연구뿐만 아니라 PTSD와 같은 정신질환 원인 규명 및 치료에도 혁신적인 도구가 될 수 있음을 보여주는 결과이다.
단백질(PLCβ1) 결핍 마우스에서 나타난 과도한 공포 반응은 PTSD 환자의 증상과 유사하다. 연구팀은 동 단백질 활성화가 극심한 스트레스로 인해 과도한 공포 기억이 형성되는 마우스 모델에서 공포 반응을 감소시킬 수 있음을 확인하였다. 이는 동 단백질이 PTSD와 같은 정신질환의 원인에 중요한 역할을 하며 동 단백질을 조절함으로써 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성이 열린 것이다.
교신저자인 허원도 교수는 "이번 연구는 단백질(PLCβ1)이 해마에서 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 밝혀냈으며, 이는 PTSD와 같은 정신질환의 새로운 치료 가능성을 제시한다. 그리고 동 단백질의 기능을 정밀하게 조절함으로써 과도한 공포 기억 형성을 억제할 수 있는 방법을 개발할 수 있을 것으로 기대되며, 이는 정신질환 치료에 혁신적인 돌파구가 될 수 있을 것이다"고 말했다. 아울러 “실제 치료에 적용되거나 동 단백질 신호 억제가 다른 뇌 기능에 어떤 영향을 미치는지, 그리고 인간에게 적용 가능한지에 대한 임상 연구가 추가적으로 필요하다.” 고 첨언했다.
생명과학과 이진수 박사가 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘사이언스 어드밴스(Sciences Advances)’2024년 7월호 인쇄판에 게재될 예정이며, 2024년 6월 28일자로 온라인판에 게재됐다. (논문명: Phospholipase C beta 1 in the dentate gyrus gates fear memory formation through regulation of neuronal excitability). (Impact Factor: 13.6). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 과학기술정보통신부 중견연구사업, KAIST 글로벌특이점 사업의 지원을 받아 수행됐다.
빛으로 기억 조절해 정신질환 치료 가능성 열어
우리 뇌에 과도한 기억이 형성되면 극심한 공포와 관련된 기억이 제대로 소멸되지 않아 발생하는 PTSD 같은 정신질환의 원인이 된다고 한다. 우리 연구진이 빛으로 단백질의 활성을 조절하는 광유전학 기술을 개발하고 이를 통해 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성을 열어 화제다.
우리 대학 생명과학과 허원도 교수 연구팀이 뇌에서 기억 형성을 조절하는 새로운 메커니즘을 밝혀냈다. 연구팀은 다양한 뇌 신경전달물질들에 의해 활성화되는 대표적인 세포내 신호전달분자효소인 PLCβ1 단백질*에 집중했다. 이번 연구는 기억 형성과 소멸을 조절하는 데 중요한 역할을 하는 단백질(PLCβ1)의 기능을 규명하였으며, PTSD와 같은 과도한 기억 형성에 의한 정신질환의 새로운 분자적 기전을 밝히는데 기여했다.
*PLCβ1 단백질: 인산지질 가수분해효소 C 베타 1
우리 뇌는 매일 다양한 경험을 통해 새로운 기억을 형성하고 소멸시킨다. 기억 형성과정은 해마라는 뇌 부위에서 이루어지며, 여기서는 양성적 신호와 음성적 신호가 균형을 맞추어 최적의 기억 형성을 유지한다. 그러나 양성 조절 인자가 부족하면 기억 형성에 문제가 생기고, 음성 조절 인자가 손상되면 과도한 기억이 형성된다. 이러한 과도한 기억 형성은 PTSD와 같은 정신질환의 원인이 될 수 있다.
허원도 교수 연구팀은 세계 최초로 단백질(PLCβ1)이 해마에서 기억 억제자로 작용하여 과도한 기억 형성을 억제하는 중요한 역할을 하는 등 동 단백질이 해마에서 특히 중요한 역할을 한다는 것을 밝혔다.
연구팀은 단백질(PLCβ1)을 결핍시킨 마우스에서 과도한 기억 형성과 공포 반응이 증가하는 것을 발견하였고, 반대로 동 단백질이 과발현하거나 광유전학으로 활성화시키면 과도한 공포 반응이 억제되는 것을 확인하였다. 이는 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 하며, 적절한 기억 형성을 유도함을 의미한다.
연구팀은 빛으로 제어하는 광유전학 기술을 개발하여 단백질(PLCβ1)의 기능을 정밀하게 조절하였다. 이 기술은 빛을 이용해 특정 단백질을 활성화하거나 비활성화할 수 있어, 뇌의 특정 부위에서 일어나는 신경 활동을 정밀하게 제어할 수 있다. 이를 통해 연구팀은 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 입증하였다. 이는 광유전학 기술이 신경 과학 연구뿐만 아니라 PTSD와 같은 정신질환 원인 규명 및 치료에도 혁신적인 도구가 될 수 있음을 보여주는 결과이다.
단백질(PLCβ1) 결핍 마우스에서 나타난 과도한 공포 반응은 PTSD 환자의 증상과 유사하다. 연구팀은 동 단백질 활성화가 극심한 스트레스로 인해 과도한 공포 기억이 형성되는 마우스 모델에서 공포 반응을 감소시킬 수 있음을 확인하였다. 이는 동 단백질이 PTSD와 같은 정신질환의 원인에 중요한 역할을 하며 동 단백질을 조절함으로써 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성이 열린 것이다.
교신저자인 허원도 교수는 "이번 연구는 단백질(PLCβ1)이 해마에서 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 밝혀냈으며, 이는 PTSD와 같은 정신질환의 새로운 치료 가능성을 제시한다. 그리고 동 단백질의 기능을 정밀하게 조절함으로써 과도한 공포 기억 형성을 억제할 수 있는 방법을 개발할 수 있을 것으로 기대되며, 이는 정신질환 치료에 혁신적인 돌파구가 될 수 있을 것이다"고 말했다. 아울러 “실제 치료에 적용되거나 동 단백질 신호 억제가 다른 뇌 기능에 어떤 영향을 미치는지, 그리고 인간에게 적용 가능한지에 대한 임상 연구가 추가적으로 필요하다.” 고 첨언했다.
생명과학과 이진수 박사가 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘사이언스 어드밴스(Sciences Advances)’2024년 7월호 인쇄판에 게재될 예정이며, 2024년 6월 28일자로 온라인판에 게재됐다. (논문명: Phospholipase C beta 1 in the dentate gyrus gates fear memory formation through regulation of neuronal excitability). (Impact Factor: 13.6). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 과학기술정보통신부 중견연구사업, KAIST 글로벌특이점 사업의 지원을 받아 수행됐다.
2024.07.15
조회수 8261
-
 스파이더맨 슈트처럼 내 몸에 착 맞춰지는 옷감형 웨어러블 햅틱 개발
우리 대학 기계공학과 오일권 교수 연구팀이 형상기억합금 와이어를 오그제틱(auxetic) 메타구조로 매듭지어 형상 적응이 가능한 옷감 형태의 착용형 '햅틱(haptic) 인터페이스'를 개발했다고 28일 밝혔다.
착용형 햅틱 인터페이스 기술은 시·청각 기반의 플랫폼의 한계를 벗어나, 피부 표면으로 전해지는 직관적인 촉감으로 메타버스 속 상호작용 몰입도를 높이는 역할을 한다.
하지만 일반적인 햅틱 인터페이스는 피부에 부착하거나 별도의 고정 장치를 착용하는 착용(부착)형으로, 이러한 햅틱 인터페이스는 장시간 사용 시 피부 발진의 위험과 고정 방식은 일상 움직임에서 불편함을 초래할 수 있다. 또 수십 개의 촉각 전달 소자를 장착해 촉감을 모방하는 기존의 제작 방식 역시 장치의 무게·부피 증가로 이어지는 한계를 보이고 있다.
우선 연구팀은 가볍고 편하게 착용할 수 있는 햅틱 인터페이스 개발을 위해 형상기억합금 와이어를 핵심 소재로 선택했다. 형상기억합금 와이어란 상온에서 모양이 쉽게 변형되고, 특정 온도에 도달하면 미리 기억된 형태로 되돌아가는 특징을 갖는 형상기억합금을 철사처럼 가늘고 길게 제작한 것이다. 이러한 형상기억합금 와이어를 기존의 천 제작 방식을 활용해 매듭지어 옷감처럼 제작하는 방식을 활용하였다. 특히, 연구팀은 형상기억합금 와이어를 오그제틱(auxetic) 구조로 매듭지어, 일반 구조에서는 볼 수 없는 3D 방향으로 구조 전체가 동시에 수축 및 이완하는 특성을 구현해 내었고, 이를 통해 착용자의 신체 형상에 순응하며 사이즈가 자동으로 조절되는 옷감형 액추에이터를 개발했다.
또한 연구팀은 8개의 영역을 개별 수축 제어할 수 있도록 설계해 총 아홉 가지 방향과 타이밍에 대한 정보를 사용자에게 촉감 피드백으로 전달할 수 있게 제작했다.
예로 팔목에 착용 시, 사용자는 방향 및 타이밍에 관한 정보를 촉각적으로 인지할 수 있고, 반면 팔꿈치에 착용할 때는 옷감형 액추에이터의 가변강성 기능을 활용해 팔꿈치의 굽힘각도에 따른 피드백을 제공하는 멀티모달(두 가지 이상의 피드백 형태로 정보를 전달) 햅틱 인터페이스로서 개발했다.
이처럼 옷감형 액추에이터를 팔목에 착용한 사용자가 가상현실 속 모빌리티 로봇 주변의 위치정보를 파악하고, 시각과 청각 정보가 제한될 때 장애물을 피해 로봇을 안정적으로 주행하는 실증에도 성공했다.
오일권 교수는 이번 연구성과를 통한 실용화 시 활용에 대해 "착용형 햅틱 인터페이스는 촉각 정보를 활용한 로봇, 무인기 제어와 메타버스가 접목된 의료·교육 등에도 활용할 수 있다"고 말했다.
한편, 이번 연구는 과학기술정보통신부(장관 이종호)와 한국연구재단이 추진하는 리더연구자(창의연구) 지원 사업으로 수행됐다. 연구 성과는 첨단 소재 분야 국제학술지 <어드밴스드 머티리얼스(Advanced Materials)>에 9월 19일 게재됐고, 연구의 우수성을 인정받아 학술지 표지 논문으로 선정됐다. (논문명: Easy-To-Wear Auxetic SMA Knot-Architecture for Spatiotemporal and Multimodal Haptic Feedbacks)
스파이더맨 슈트처럼 내 몸에 착 맞춰지는 옷감형 웨어러블 햅틱 개발
우리 대학 기계공학과 오일권 교수 연구팀이 형상기억합금 와이어를 오그제틱(auxetic) 메타구조로 매듭지어 형상 적응이 가능한 옷감 형태의 착용형 '햅틱(haptic) 인터페이스'를 개발했다고 28일 밝혔다.
착용형 햅틱 인터페이스 기술은 시·청각 기반의 플랫폼의 한계를 벗어나, 피부 표면으로 전해지는 직관적인 촉감으로 메타버스 속 상호작용 몰입도를 높이는 역할을 한다.
하지만 일반적인 햅틱 인터페이스는 피부에 부착하거나 별도의 고정 장치를 착용하는 착용(부착)형으로, 이러한 햅틱 인터페이스는 장시간 사용 시 피부 발진의 위험과 고정 방식은 일상 움직임에서 불편함을 초래할 수 있다. 또 수십 개의 촉각 전달 소자를 장착해 촉감을 모방하는 기존의 제작 방식 역시 장치의 무게·부피 증가로 이어지는 한계를 보이고 있다.
우선 연구팀은 가볍고 편하게 착용할 수 있는 햅틱 인터페이스 개발을 위해 형상기억합금 와이어를 핵심 소재로 선택했다. 형상기억합금 와이어란 상온에서 모양이 쉽게 변형되고, 특정 온도에 도달하면 미리 기억된 형태로 되돌아가는 특징을 갖는 형상기억합금을 철사처럼 가늘고 길게 제작한 것이다. 이러한 형상기억합금 와이어를 기존의 천 제작 방식을 활용해 매듭지어 옷감처럼 제작하는 방식을 활용하였다. 특히, 연구팀은 형상기억합금 와이어를 오그제틱(auxetic) 구조로 매듭지어, 일반 구조에서는 볼 수 없는 3D 방향으로 구조 전체가 동시에 수축 및 이완하는 특성을 구현해 내었고, 이를 통해 착용자의 신체 형상에 순응하며 사이즈가 자동으로 조절되는 옷감형 액추에이터를 개발했다.
또한 연구팀은 8개의 영역을 개별 수축 제어할 수 있도록 설계해 총 아홉 가지 방향과 타이밍에 대한 정보를 사용자에게 촉감 피드백으로 전달할 수 있게 제작했다.
예로 팔목에 착용 시, 사용자는 방향 및 타이밍에 관한 정보를 촉각적으로 인지할 수 있고, 반면 팔꿈치에 착용할 때는 옷감형 액추에이터의 가변강성 기능을 활용해 팔꿈치의 굽힘각도에 따른 피드백을 제공하는 멀티모달(두 가지 이상의 피드백 형태로 정보를 전달) 햅틱 인터페이스로서 개발했다.
이처럼 옷감형 액추에이터를 팔목에 착용한 사용자가 가상현실 속 모빌리티 로봇 주변의 위치정보를 파악하고, 시각과 청각 정보가 제한될 때 장애물을 피해 로봇을 안정적으로 주행하는 실증에도 성공했다.
오일권 교수는 이번 연구성과를 통한 실용화 시 활용에 대해 "착용형 햅틱 인터페이스는 촉각 정보를 활용한 로봇, 무인기 제어와 메타버스가 접목된 의료·교육 등에도 활용할 수 있다"고 말했다.
한편, 이번 연구는 과학기술정보통신부(장관 이종호)와 한국연구재단이 추진하는 리더연구자(창의연구) 지원 사업으로 수행됐다. 연구 성과는 첨단 소재 분야 국제학술지 <어드밴스드 머티리얼스(Advanced Materials)>에 9월 19일 게재됐고, 연구의 우수성을 인정받아 학술지 표지 논문으로 선정됐다. (논문명: Easy-To-Wear Auxetic SMA Knot-Architecture for Spatiotemporal and Multimodal Haptic Feedbacks)
2023.11.30
조회수 8528
-
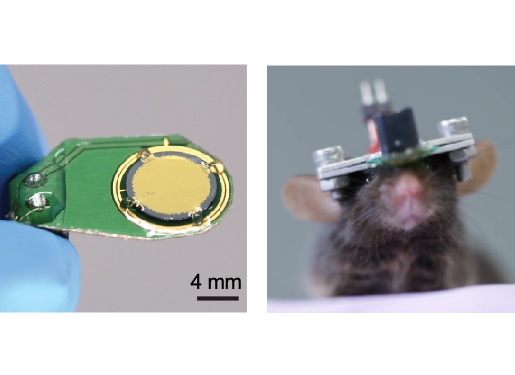 수면 및 단기 기억력 조절을 위한 초소형 초음파 자극·뇌파 측정 시스템 개발
우리 대학 전기및전자공학부 이현주 교수, 한국뇌연구원 김정연 박사 공동연구팀이 소형 동물에서 초음파 뇌 자극과 뇌파 측정이 동시에 가능한 초소형 시스템을 개발했다고 9일 밝혔다. 수면 상태에 따라 실시간으로 초음파 뇌 자극이 가능한 해당 기술을 이용해, 연구팀은 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 시 전전두엽(PFC, Prefrontal cortex)을 실시간으로 자극해 수면 및 단기 기억력 조절이 가능함을 밝혔다.
☞ 미세 전자 기계 시스템(Micro Electro Mechanical Systems, MEMS): 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품과 시스템을 설계·제작하고 응용하는 기술을 의미한다.
☞ 초음파: 사람이 들을 수 있는 청각 영역에서 벗어난 고주파수 내역의 음파(>20 kHz).
☞ 뇌파: 저주파수 대역의 뇌 전기신호. 비침습적으로 두개골이나 두피에서 전반적인 뇌 활동을 뇌파로 측정할 수 있다. 영문으로 EEG라고 부른다.
☞ 전전두엽: 전두엽에서 인간 고유의 정신 기능을 담당하는 앞부분이다. 행동을 주시하고, 감독하고, 이끌고, 지시하고, 집중시키는 일을 하는 부위다.
이번 연구에서 개발된 초소형 초음파 자극 및 뇌파 측정 시스템은 기존의 마취가 필요한 시스템과는 달리 자유롭게 행동하는 쥐에 장기간 동시 자극과 측정을 할 수 있다. 초음파 자극 소자는 미세 전자 기계 시스템(이하 MEMS, Micro Electro Mechanical Systems)의 실리콘 공정을 활용했기 때문에 매우 정밀하고 초소형으로 제작할 수 있으며 대량생산이 가능하다. 초경량의 해당 시스템을 향후 다양한 뇌 질환 동물 모델에 적용한다면, 여러 뇌 질환에 대한 초음파 뇌 자극의 효과를 평가할 수 있을 것으로 기대된다.
기존 신경 자극 기술과는 달리 초음파는 수술 없이 뇌 심부의 국소적인 작은 영역까지도 자극할 수 있어, 저강도 집속 초음파 치료 기술이 주목받고 있다. 최근 저강도 집속 초음파 기술의 치료 효과와 유효성에 관한 연구가 활발히 진행되고 있다. 초음파를 뇌 또는 인체에 조사했더니, 알츠하이머병, 파킨슨병, 간질, 비만, 관절염 등이 호전되는 연구들이 다수 발표되고 있다.
신경 자극의 효능을 확인하는 방법으로는 생체 내 신호 측정과 행동 관찰을 들 수 있다. 그러나 이를 질병 모델이 많이 존재하는 소형 동물에서 구현하기는 쉽지 않다. 기존의 초음파 자극 기술은 부피가 커서 움직이는 생쥐에 사용이 불가능하거나 작동할 때 생기는 잡음 신호로 동시 전기 생리 신호 측정이 어렵다. 특히, 생쥐처럼 작은 동물에서 장기간으로 초음파 자극을 주면서 생체 내 반응을 실시간으로 측정하는 시스템이 없었다. 따라서 소형 동물에 인가되는 초음파 자극 실험은 통상적으로 짧게 자극 후 즉각적인 반응을 보거나 마취 상태에서 여러 차례 자극을 인가하고 장기적인 반응을 보는 연구들이 주를 이루고 있다.
이현주 교수팀은 그간 이런 문제를 해결하기 위해 MEMS 기반의 초소형 초음파 소자(CMUT, Capacitive Micromachined Ultrasound Transducer) 연구를 지속해서 수행해왔는데, 이번 연구에서 뇌파 신호 측정 및 실시간 수면 분석 기술을 접목해, 뇌의 현재 상태에 따라 자극을 주는 맞춤형, 폐루프 자극 시스템을 개발했다. 폐루프 자극 알고리즘은 6초 단위로 수면 단계를 실시간으로 분석해 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 단계일 때 초음파 자극을 전달한다. 이 시스템은 잡음 신호 없이 자극과 측정이 동시에 가능하다. NREM 상태 시 10시간 동안 수면 박탈 쥐의 전전두엽을 자극한 결과, 단기 공간 기억력이 보호되고 급속 안구 운동(REM, Rapid-eye Movement) 수면량이 증가함을 보였다.
연구팀은 현재 이 신기술을 고도화하기 위해 뇌 단일 영역의 매우 작은 부위를 자극할 수 있는 후속 시스템을 개발하고 있다. 국소 부위 자극을 통해 향후 정밀한 수면 단계 조절이 가능하게 된다면, 수술 없이 비침습적으로 수면 질환, 알츠하이머병, 파킨슨병 등의 뇌 질환 치료의 길이 열릴 것으로 연구팀은 기대하고 있다.
이현주 교수는 "초음파는 태아 영상화에도 활용될 만큼 안전한 인체 조사 기술 중 하나인데, 인체 내부 깊숙이까지 전달되며 펴지지 않고 집중 조사가 가능해 치료를 위한 비수술적 인체 조사 기술로 매우 매력적인 기술이다ˮ라고 말했다. "하지만, 전임상 자극 시스템의 부재로 현재 초음파 자극의 효능 평가 연구가 부족한 상황이며, 이번에 개발한 시스템을 많은 뇌과학 연구팀들이 활용해 초음파의 다양한 치료 효과를 밝혀낼 수 있기를 바란다ˮ라고 전했다.
전기및전자공학부 이현주 교수 연구팀의 조예현 박사과정, 그리고 한국뇌연구원 김정연 박사 연구팀이 주도하고 기초과학연구원 김성기 단장, 한국과학기술연구원 이병철 박사, 우리 대학 생명과학과 서성배 교수가 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'誌 10월 19일 字에 게재됐으며 출판사 와일리(Wiley)의 리서치 헤드라인(Research Headline) 논문으로 선정돼 이현주 교수와 김정연 박사 인터뷰가 어드밴스드 사이언스 뉴스(Advanced Science News)에 11월 1일 실렸다. (논문명: General-purpose ultrasound neuromodulation system for chronic, closed-loop preclinical studies in freely behaving rodents)
한편, 이 연구는 과학기술정보통신부 한국연구재단 차세대지능형반도체 사업의 지원으로 수행됐다.
수면 및 단기 기억력 조절을 위한 초소형 초음파 자극·뇌파 측정 시스템 개발
우리 대학 전기및전자공학부 이현주 교수, 한국뇌연구원 김정연 박사 공동연구팀이 소형 동물에서 초음파 뇌 자극과 뇌파 측정이 동시에 가능한 초소형 시스템을 개발했다고 9일 밝혔다. 수면 상태에 따라 실시간으로 초음파 뇌 자극이 가능한 해당 기술을 이용해, 연구팀은 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 시 전전두엽(PFC, Prefrontal cortex)을 실시간으로 자극해 수면 및 단기 기억력 조절이 가능함을 밝혔다.
☞ 미세 전자 기계 시스템(Micro Electro Mechanical Systems, MEMS): 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품과 시스템을 설계·제작하고 응용하는 기술을 의미한다.
☞ 초음파: 사람이 들을 수 있는 청각 영역에서 벗어난 고주파수 내역의 음파(>20 kHz).
☞ 뇌파: 저주파수 대역의 뇌 전기신호. 비침습적으로 두개골이나 두피에서 전반적인 뇌 활동을 뇌파로 측정할 수 있다. 영문으로 EEG라고 부른다.
☞ 전전두엽: 전두엽에서 인간 고유의 정신 기능을 담당하는 앞부분이다. 행동을 주시하고, 감독하고, 이끌고, 지시하고, 집중시키는 일을 하는 부위다.
이번 연구에서 개발된 초소형 초음파 자극 및 뇌파 측정 시스템은 기존의 마취가 필요한 시스템과는 달리 자유롭게 행동하는 쥐에 장기간 동시 자극과 측정을 할 수 있다. 초음파 자극 소자는 미세 전자 기계 시스템(이하 MEMS, Micro Electro Mechanical Systems)의 실리콘 공정을 활용했기 때문에 매우 정밀하고 초소형으로 제작할 수 있으며 대량생산이 가능하다. 초경량의 해당 시스템을 향후 다양한 뇌 질환 동물 모델에 적용한다면, 여러 뇌 질환에 대한 초음파 뇌 자극의 효과를 평가할 수 있을 것으로 기대된다.
기존 신경 자극 기술과는 달리 초음파는 수술 없이 뇌 심부의 국소적인 작은 영역까지도 자극할 수 있어, 저강도 집속 초음파 치료 기술이 주목받고 있다. 최근 저강도 집속 초음파 기술의 치료 효과와 유효성에 관한 연구가 활발히 진행되고 있다. 초음파를 뇌 또는 인체에 조사했더니, 알츠하이머병, 파킨슨병, 간질, 비만, 관절염 등이 호전되는 연구들이 다수 발표되고 있다.
신경 자극의 효능을 확인하는 방법으로는 생체 내 신호 측정과 행동 관찰을 들 수 있다. 그러나 이를 질병 모델이 많이 존재하는 소형 동물에서 구현하기는 쉽지 않다. 기존의 초음파 자극 기술은 부피가 커서 움직이는 생쥐에 사용이 불가능하거나 작동할 때 생기는 잡음 신호로 동시 전기 생리 신호 측정이 어렵다. 특히, 생쥐처럼 작은 동물에서 장기간으로 초음파 자극을 주면서 생체 내 반응을 실시간으로 측정하는 시스템이 없었다. 따라서 소형 동물에 인가되는 초음파 자극 실험은 통상적으로 짧게 자극 후 즉각적인 반응을 보거나 마취 상태에서 여러 차례 자극을 인가하고 장기적인 반응을 보는 연구들이 주를 이루고 있다.
이현주 교수팀은 그간 이런 문제를 해결하기 위해 MEMS 기반의 초소형 초음파 소자(CMUT, Capacitive Micromachined Ultrasound Transducer) 연구를 지속해서 수행해왔는데, 이번 연구에서 뇌파 신호 측정 및 실시간 수면 분석 기술을 접목해, 뇌의 현재 상태에 따라 자극을 주는 맞춤형, 폐루프 자극 시스템을 개발했다. 폐루프 자극 알고리즘은 6초 단위로 수면 단계를 실시간으로 분석해 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 단계일 때 초음파 자극을 전달한다. 이 시스템은 잡음 신호 없이 자극과 측정이 동시에 가능하다. NREM 상태 시 10시간 동안 수면 박탈 쥐의 전전두엽을 자극한 결과, 단기 공간 기억력이 보호되고 급속 안구 운동(REM, Rapid-eye Movement) 수면량이 증가함을 보였다.
연구팀은 현재 이 신기술을 고도화하기 위해 뇌 단일 영역의 매우 작은 부위를 자극할 수 있는 후속 시스템을 개발하고 있다. 국소 부위 자극을 통해 향후 정밀한 수면 단계 조절이 가능하게 된다면, 수술 없이 비침습적으로 수면 질환, 알츠하이머병, 파킨슨병 등의 뇌 질환 치료의 길이 열릴 것으로 연구팀은 기대하고 있다.
이현주 교수는 "초음파는 태아 영상화에도 활용될 만큼 안전한 인체 조사 기술 중 하나인데, 인체 내부 깊숙이까지 전달되며 펴지지 않고 집중 조사가 가능해 치료를 위한 비수술적 인체 조사 기술로 매우 매력적인 기술이다ˮ라고 말했다. "하지만, 전임상 자극 시스템의 부재로 현재 초음파 자극의 효능 평가 연구가 부족한 상황이며, 이번에 개발한 시스템을 많은 뇌과학 연구팀들이 활용해 초음파의 다양한 치료 효과를 밝혀낼 수 있기를 바란다ˮ라고 전했다.
전기및전자공학부 이현주 교수 연구팀의 조예현 박사과정, 그리고 한국뇌연구원 김정연 박사 연구팀이 주도하고 기초과학연구원 김성기 단장, 한국과학기술연구원 이병철 박사, 우리 대학 생명과학과 서성배 교수가 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'誌 10월 19일 字에 게재됐으며 출판사 와일리(Wiley)의 리서치 헤드라인(Research Headline) 논문으로 선정돼 이현주 교수와 김정연 박사 인터뷰가 어드밴스드 사이언스 뉴스(Advanced Science News)에 11월 1일 실렸다. (논문명: General-purpose ultrasound neuromodulation system for chronic, closed-loop preclinical studies in freely behaving rodents)
한편, 이 연구는 과학기술정보통신부 한국연구재단 차세대지능형반도체 사업의 지원으로 수행됐다.
2022.11.09
조회수 12032
-
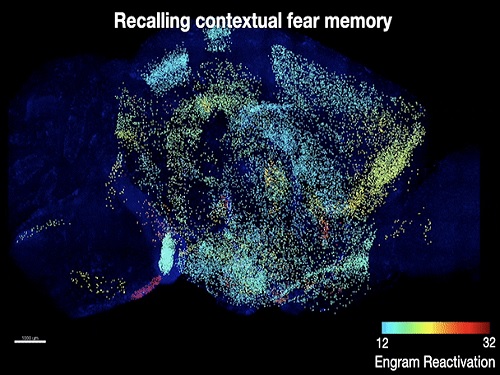 기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02
조회수 9345
-
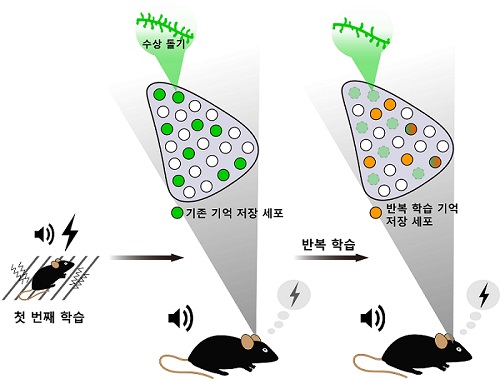 뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
2021.11.03
조회수 9468
-
 기억을 형성하는 원리 최초로 규명
우리 대학 생명과학과 한진희 교수 연구팀이 무수히 많은 뉴런과 이들 사이의 시냅스 연결로 구성된 복잡한 신경 네트워크에서 기억을 인코딩하는 뉴런이 선택되는 근본 원리를 규명했다고 13일 밝혔다.
우리 대학 생명과학과 정이레 박사가 제1 저자로 참여한 이번 연구는 네이처 출판 그룹의 오픈 액세스(Open-access) 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 24일 字로 게재됐다. (논문명: Synaptic plasticity-dependent competition rule influences memory formation)
과거의 경험은 기억이라는 형태로 뇌에 저장되고 나중에 불러오게 된다. 이러한 기억은 뇌 전체에 걸쳐 극히 적은 수의 뉴런들에 인코딩되고 저장된다고 알려져 있다. 하지만 이 뉴런들이 미리 정해져 있는 것인지, 아니면 어떤 원리에 의해 선택되는 것인지는 불확실하다. 이 질문을 해결하는 것은 신경과학의 미해결 난제 중 하나인 기억이 뇌에서 어떻게 형성되는지를 규명하는 것으로서 학문적으로 매우 중요할 뿐만 아니라, 치매를 치료할 수 있는 단서를 제공하기 때문에 막대한 사회, 경제적 파급 효과가 있다.
반세기 훨씬 이전에 캐나다의 신경심리학자 도널드 올딩 헤브(Donald O. Hebb)는 그의 유명한 저서인 ‘행동의 조직화(The Organization of Behavior)’ (1949) 에서 두 뉴런이 시간상으로 동시에 활성화되면 이 두 뉴런 사이의 시냅스 연결이 강화될 것이라는 시냅스 가소성(synaptic plasticity) 아이디어를 제시했고, 이후 실험을 통해 학습으로 특정 시냅스에서 실제로 장기 강화(long-term potentiation, 이하 LTP)가 일어난다는 것이 증명됐다.
이 발견 이후, LTP가 기억의 핵심 메커니즘으로 생각돼 왔다. 하지만, LTP가 기억을 인코딩하는 뉴런을 어떻게 결정하는지 지금까지 규명된 적이 없었다.
이번 연구에서는 이를 규명하기 위해 생쥐 뇌 편도체(amygdala) 부위에서 자연적인 학습 조건에서 LTP가 발생하지 않는 시냅스를 광유전학 기술을 이용해서 특정 패턴으로 자극함으로써 인위적으로 그 시냅스 연결을 강하게 만들거나 혹은 약하게 조작하고 이때 기억을 인코딩하는 뉴런이 달라지는지 연구팀은 조사했다.
먼저, 생쥐가 공포스러운 경험을 하기 전에 이 시냅스를 미리 자극해서 LTP가 일어나게 했을 때, 원래는 기억과 상관없었던 이 시냅스에 기억이 인코딩되고 LTP가 일어난 뉴런이 주변 다른 뉴런에 비해 매우 높은 확률로 선택적으로 기억 인코딩에 참여함을 발견했다.
하지만, 학습하고 난 바로 직후에 이 시냅스를 다시 광유전학 기술로 인위적으로 자극해서 이 시냅스 연결을 약하게 했을 때 더는 이 시냅스와 뉴런에 기억이 인코딩되지 않는 결과를 얻었다.
반대로, 정상적으로 생쥐가 공포스러운 경험을 하고 난 바로 직후에 LTP 자극을 통해 이 시냅스 연결을 인위적으로 강하게 했을 때 놀랍게도 LTP를 조작해준 이 시냅스에 공포 기억이 인코딩되고 주변 다른 뉴런들에 비해 LTP를 발생시킨 이 뉴런에 선택적으로 인코딩됨을 확인했다. 이러한 결과는 시냅스 강도를 인위적으로 조작했을 때 기억 자체는 변하지 않지만, 그 기억을 인코딩하는 뉴런이 변경됨을 증명한 것이다.
한진희 교수는 “LTP에 의해 뉴런들 사이에서 새로운 연결패턴이 만들어지고 이를 통해 경험과 연관된 특이적인 세포 집합체(cell assembly)가 뇌에서 새롭게 만들어진다”며 “이렇게 강하게 서로 연결된 뉴런들의 형성이 뇌에서 기억이 형성되는 원리임을 규명한 것”이라고 이번 연구 결과중요성을 설명했다.
한편, 이번 연구는 한국연구재단의 중견연구 사업 지원을 받아 수행되었으며 정이레 박사는 한국연구재단의 박사 후 국내 연수 사업의 지원을 받았다.
기억을 형성하는 원리 최초로 규명
우리 대학 생명과학과 한진희 교수 연구팀이 무수히 많은 뉴런과 이들 사이의 시냅스 연결로 구성된 복잡한 신경 네트워크에서 기억을 인코딩하는 뉴런이 선택되는 근본 원리를 규명했다고 13일 밝혔다.
우리 대학 생명과학과 정이레 박사가 제1 저자로 참여한 이번 연구는 네이처 출판 그룹의 오픈 액세스(Open-access) 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 24일 字로 게재됐다. (논문명: Synaptic plasticity-dependent competition rule influences memory formation)
과거의 경험은 기억이라는 형태로 뇌에 저장되고 나중에 불러오게 된다. 이러한 기억은 뇌 전체에 걸쳐 극히 적은 수의 뉴런들에 인코딩되고 저장된다고 알려져 있다. 하지만 이 뉴런들이 미리 정해져 있는 것인지, 아니면 어떤 원리에 의해 선택되는 것인지는 불확실하다. 이 질문을 해결하는 것은 신경과학의 미해결 난제 중 하나인 기억이 뇌에서 어떻게 형성되는지를 규명하는 것으로서 학문적으로 매우 중요할 뿐만 아니라, 치매를 치료할 수 있는 단서를 제공하기 때문에 막대한 사회, 경제적 파급 효과가 있다.
반세기 훨씬 이전에 캐나다의 신경심리학자 도널드 올딩 헤브(Donald O. Hebb)는 그의 유명한 저서인 ‘행동의 조직화(The Organization of Behavior)’ (1949) 에서 두 뉴런이 시간상으로 동시에 활성화되면 이 두 뉴런 사이의 시냅스 연결이 강화될 것이라는 시냅스 가소성(synaptic plasticity) 아이디어를 제시했고, 이후 실험을 통해 학습으로 특정 시냅스에서 실제로 장기 강화(long-term potentiation, 이하 LTP)가 일어난다는 것이 증명됐다.
이 발견 이후, LTP가 기억의 핵심 메커니즘으로 생각돼 왔다. 하지만, LTP가 기억을 인코딩하는 뉴런을 어떻게 결정하는지 지금까지 규명된 적이 없었다.
이번 연구에서는 이를 규명하기 위해 생쥐 뇌 편도체(amygdala) 부위에서 자연적인 학습 조건에서 LTP가 발생하지 않는 시냅스를 광유전학 기술을 이용해서 특정 패턴으로 자극함으로써 인위적으로 그 시냅스 연결을 강하게 만들거나 혹은 약하게 조작하고 이때 기억을 인코딩하는 뉴런이 달라지는지 연구팀은 조사했다.
먼저, 생쥐가 공포스러운 경험을 하기 전에 이 시냅스를 미리 자극해서 LTP가 일어나게 했을 때, 원래는 기억과 상관없었던 이 시냅스에 기억이 인코딩되고 LTP가 일어난 뉴런이 주변 다른 뉴런에 비해 매우 높은 확률로 선택적으로 기억 인코딩에 참여함을 발견했다.
하지만, 학습하고 난 바로 직후에 이 시냅스를 다시 광유전학 기술로 인위적으로 자극해서 이 시냅스 연결을 약하게 했을 때 더는 이 시냅스와 뉴런에 기억이 인코딩되지 않는 결과를 얻었다.
반대로, 정상적으로 생쥐가 공포스러운 경험을 하고 난 바로 직후에 LTP 자극을 통해 이 시냅스 연결을 인위적으로 강하게 했을 때 놀랍게도 LTP를 조작해준 이 시냅스에 공포 기억이 인코딩되고 주변 다른 뉴런들에 비해 LTP를 발생시킨 이 뉴런에 선택적으로 인코딩됨을 확인했다. 이러한 결과는 시냅스 강도를 인위적으로 조작했을 때 기억 자체는 변하지 않지만, 그 기억을 인코딩하는 뉴런이 변경됨을 증명한 것이다.
한진희 교수는 “LTP에 의해 뉴런들 사이에서 새로운 연결패턴이 만들어지고 이를 통해 경험과 연관된 특이적인 세포 집합체(cell assembly)가 뇌에서 새롭게 만들어진다”며 “이렇게 강하게 서로 연결된 뉴런들의 형성이 뇌에서 기억이 형성되는 원리임을 규명한 것”이라고 이번 연구 결과중요성을 설명했다.
한편, 이번 연구는 한국연구재단의 중견연구 사업 지원을 받아 수행되었으며 정이레 박사는 한국연구재단의 박사 후 국내 연수 사업의 지원을 받았다.
2021.07.13
조회수 18312
-
 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07
조회수 14840
-
 우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06
조회수 55897
-
 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11
조회수 19817
-
 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27
조회수 16212
-
 인류세 연구센터, 국제 심포지엄 개최
우리대학 인류세 연구센터(센터장 박범순 교수)가 이달 10일부터 11일까지 이틀간 국립민속박물관에서 `인류세의 재난을 말하다: 지식, 기억, 상상'을 주제로 국제 심포지엄을 개최했다.
지난해 6월 개소 이후 처음 이번 국제 심포지엄에는 `인류세' 개념을 발전시킨 대표적 지구시스템과학자 윌 스테픈(Will Steffen) 호주 국립대 교수와 고생물학 및 지질학자로 국제층서학회 인류세실무그룹에 소속된 마크 윌리엄스(Mark Williams) 영국 레스터 대학 교수 등 인류세 연구를 대표하는 해외 유수 학자 열두 명이 발표자로 참석해 인류세에 대한 심도 깊은 토론을 진행했다.
국내에서는 박범순 인류세연구센터장과 전치형 KAIST 과학기술정책대학원 교수 및 국립민속박물관 · 한국지질자원연구원 · 대한지질학회 · 한국문화인류학회·한국환경사회학회 · 한국공간환경학회 등 공동 주최 기관의 다양한 관계자들이 참여해 논의의 지평을 넓혔다.
최근 국내에서 인류세 분야의 논의가 활성화되면서 이를 주제로 한 학술 행사들이 열린 사례는 있지만, 해외 학자 십수 명이 참여하는 규모의 국제 심포지엄은 이번이 처음이다. 특히, 인류세를 새로운 지질 시대로 확정하자는 주장을 이끌어온 국제층서학회 인류세 실무그룹 소속 학자들이 다수 포함되어 있어 학계의 관심이 주목됐다.
인류세(Anthropocene)는 `인간의 시대'라는 의미를 담아 제안된 새로운 지질 시대의 이름이다. 지구 환경을 변화시키는 근본적인 원인이 인간 활동에서 비롯된다는 개념에서 출발한다.
인류세 개념은 당초 제안된 자연과학 분야를 넘어 인문학·사회과학·예술 등 다양한 분야의 연구 활동을 통해 전 지구적인 위기를 진단하고 이를 극복하기 위한 지식 생산과 실천을 추구하는 패러다임으로 부상하고 있다.
무엇보다 융합연구를 통해 인류가 직면한 생태·사회적 위기를 다각도로 이해하고 이를 헤쳐 나가기 위한 공동의 노력이 필요하다는 점을 중점적으로 강조하는 학문 분야다. 이번 심포지엄에서도 융합연구의 특성을 살려 지질학 · 지구시스템과학 · 과학기술학 · 사회학 · 역사학 · 지리학 · 인류학 · 문학 등 다양한 분야의 국내외 학자 40여명이 발표 및 토론자로 참석했다.
이틀간 `인류세의 재난'에 대해 이론적·실천적 논의를 전개한 국내·외 연구자들은 인류세에서 발생하는 재난을 이해하고 헤쳐 가는 다양한 방식들을 논의했다. 다학제적 관점에서 `인류세의 재난을 어떻게 정의하고 규명할 것인가?', `지역적 재난을 전 지구적인 관점에서 바라보고 동시에 전 지구적 위험을 지역적 경험을 통해 해석하는 방법에는 어떤 것들이 있는가?' 등의 구체적인 질문을 통해 인류세의 재난을 극복하기 위한 실천적 방안들도 논의됐다.
심포지엄에 앞서 한국을 방문한 참가자들은 9일 철원 지역 비무장지대(DMZ)를 방문하고, 한국적 인류세의 현장을 둘러보는 시간도 가졌다.
2018년 6월 설립된 KAIST 인류세연구센터에는 학내 여러 학과 및 인공위성연구소가 참여하고 있으며, 한국지질자원연구원과 인류세에 관심 있는 국내 대학 연구진들과 함께 연구 활동을 수행하고 있다.
인류세 현실 감지를 목표로 하는 `센싱(Sensing)' 그룹, 인류세에 대한 기술적이고 제도적인 적응과 실천에 관심을 두는 `인해비팅”(Inhabiting)' 그룹, 인류세에 적용할 대안 탐구를 목표로 하는 `이매니징'(Imagining)' 그룹 등 총 3개의 분야로 구성되어 있다.
이들은 한국적 인류세 공간으로서의 DMZ 연구·인공위성자료와 AI를 활용한 한반도 지표 변화 연구·손상된 지구에서 살아남기 위한 지속가능한 주거, 교통, 생활양식 전환 연구·인류세 게임과 예술작품 연구 등을 수행하고 있다.
나아가 인류세에 대한 인식을 확산하고 더 광범위한 사회 변화를 촉진하기 위해 인류세 교육 콘텐츠 구축 및 서울시립과학관과 함께 인류세 특별전시도 기획중이다. 인류세연구센터의 연구 및 활동 내용, 심포지엄 관련 정보는 인류세연구센터 홈페이지( https://anthropocenestudies.com )에서 찾아볼 수 있다.
[참고] 인류세 국제 심포지엄 참여 주요 해외 학자
윌 스테픈 (Will Steffen, 호주국립대) 지구시스템 과학자. 국제층서학회 인류세실무그룹 소속. 호주 기후 변화 자문회의 의장 및 스웨덴 스톡홀름 회복탄력성 센터 시니어 펠로우를 맡고 있다. 1998년부터 2004년까지 지구 환경 변화 연구를 위한 국제 연구 이니셔티브 IGBP (International Geosphere-Biosphere Programme)의 수석 디렉터로 활동했다. 주요 연구 분야는 기후변화를 중심으로 인간 활동이 지구시스템 변화에 끼친 영향 분석으로, IGBP의 지구시스템 과학자들과 함께 ‘행성적 경계(planetary boundaries)’ 등 인류세 연구의 핵심 개념을 고안했다.
마크 윌리엄스 (Mark Williams, 영국 레스터 대학) 고생물학자, 지질학자. 국제층서학회 인류세실무그룹 소속. 인류세의 생물권(biosphere)이 주요 연구 영역으로, 인류세실무그룹의 의장인 얀 잘라쉐비츠와 함께 지난 10여년간 지질학계의 인류세 논의를 발전시켜 왔다. 이번 심포지엄에서는 “인간에 의해 심대하게 변형된 생물권과 그것이 복지에 대해 갖는 함의”를 주제로 얀 잘라쉐비츠와의 공동 연구에 대해 발표한다.
줄리아 애드니 토머스 (Julia Adeney Thomas, 미국 노터데임 대학)
역사학자. 일본을 중심으로 자연 개념과 정치 이론 등을 연구해왔다. 주요 저서로는 , [공저] 등이 있다. 한국 DMZ에 대한 논문 “The Exquisite Corpses of Nature and History: The Case of the Korean DMZ(자연과 역사의 절묘한 시신: 한국 DMZ를 사례)”를 발표하기도 했다.
개브리엘 헥트 (Gabirelle Hecht, 미국 스탠퍼드 대학)
스탠퍼드 대학 역사학 교수이자 국제안전 및 협력 센터(Centre for International Security and Cooperation)의 핵 안전 분야 전문가로 활동하고 있다. 아프리카의 원자력 발전이 주요 연구 주제이며, 방사성 폐기물, 대기 오염 등을 중심으로 원자력 발전이 아프리카 인류세의 형성에 갖는 역할을 탐색하고 있다. 등의 저서가 있으며, 아프리카 인류세를 다룬 를 집필중이다.
제이미 로리머 (Jamie Lorimer, 영국 옥스퍼드 대학)
옥스퍼드 대 환경지리학과 교수. 아시아 코끼리 보전, 네덜란드 간척지 재야생화, 미생물, 유럽의 식물 기반 식단 등을 연구해왔다. 야생동물, 유해 동물, 미생물 등 ‘자연’을 이해하는 다양한 방식과 이것이 자연-인간 관계에 갖는 함의에 관심이 있다. (2015) 등을 집필했다. 이번 심포지엄에서는 “친생물적 행성: 인류세의 역풍과 가이아 과학의 부상”을 주제로 발표한다.
엘리자베스 들러그리(Elizabeth M. DeLoughrey, 미국 UCLA)
UCLA 환경과 지속가능성 센터 및 영문학과 교수. 카리브해와 태평양의 섬 문화권을 중심으로 문학, 식민주의와 환경이 교차하는 지점에 관심이 있다. 환경에 대한 인문사회적 접근을 다루는 국제 학술지 의 편집위원. 저서로 , 등이 있다.
스캇 개브리얼 노울즈 (Scott Gabriel Knowles, 미국 드렉셀 대학)
드렉셀 대학 역사학과 교수. 인류세의 재난이 주요 연구 분야다. 저서로 , [출간 예정]이 있다. 인류세의 재난이 주요 연구 분야로, 한국의 세월호 참사에 대해서도 관심을 갖고 연구를 수행했다. 이번 심포지엄에서는 “미국 걸프만의 느린 재난”을 주제로 발표한다.
인류세 연구센터, 국제 심포지엄 개최
우리대학 인류세 연구센터(센터장 박범순 교수)가 이달 10일부터 11일까지 이틀간 국립민속박물관에서 `인류세의 재난을 말하다: 지식, 기억, 상상'을 주제로 국제 심포지엄을 개최했다.
지난해 6월 개소 이후 처음 이번 국제 심포지엄에는 `인류세' 개념을 발전시킨 대표적 지구시스템과학자 윌 스테픈(Will Steffen) 호주 국립대 교수와 고생물학 및 지질학자로 국제층서학회 인류세실무그룹에 소속된 마크 윌리엄스(Mark Williams) 영국 레스터 대학 교수 등 인류세 연구를 대표하는 해외 유수 학자 열두 명이 발표자로 참석해 인류세에 대한 심도 깊은 토론을 진행했다.
국내에서는 박범순 인류세연구센터장과 전치형 KAIST 과학기술정책대학원 교수 및 국립민속박물관 · 한국지질자원연구원 · 대한지질학회 · 한국문화인류학회·한국환경사회학회 · 한국공간환경학회 등 공동 주최 기관의 다양한 관계자들이 참여해 논의의 지평을 넓혔다.
최근 국내에서 인류세 분야의 논의가 활성화되면서 이를 주제로 한 학술 행사들이 열린 사례는 있지만, 해외 학자 십수 명이 참여하는 규모의 국제 심포지엄은 이번이 처음이다. 특히, 인류세를 새로운 지질 시대로 확정하자는 주장을 이끌어온 국제층서학회 인류세 실무그룹 소속 학자들이 다수 포함되어 있어 학계의 관심이 주목됐다.
인류세(Anthropocene)는 `인간의 시대'라는 의미를 담아 제안된 새로운 지질 시대의 이름이다. 지구 환경을 변화시키는 근본적인 원인이 인간 활동에서 비롯된다는 개념에서 출발한다.
인류세 개념은 당초 제안된 자연과학 분야를 넘어 인문학·사회과학·예술 등 다양한 분야의 연구 활동을 통해 전 지구적인 위기를 진단하고 이를 극복하기 위한 지식 생산과 실천을 추구하는 패러다임으로 부상하고 있다.
무엇보다 융합연구를 통해 인류가 직면한 생태·사회적 위기를 다각도로 이해하고 이를 헤쳐 나가기 위한 공동의 노력이 필요하다는 점을 중점적으로 강조하는 학문 분야다. 이번 심포지엄에서도 융합연구의 특성을 살려 지질학 · 지구시스템과학 · 과학기술학 · 사회학 · 역사학 · 지리학 · 인류학 · 문학 등 다양한 분야의 국내외 학자 40여명이 발표 및 토론자로 참석했다.
이틀간 `인류세의 재난'에 대해 이론적·실천적 논의를 전개한 국내·외 연구자들은 인류세에서 발생하는 재난을 이해하고 헤쳐 가는 다양한 방식들을 논의했다. 다학제적 관점에서 `인류세의 재난을 어떻게 정의하고 규명할 것인가?', `지역적 재난을 전 지구적인 관점에서 바라보고 동시에 전 지구적 위험을 지역적 경험을 통해 해석하는 방법에는 어떤 것들이 있는가?' 등의 구체적인 질문을 통해 인류세의 재난을 극복하기 위한 실천적 방안들도 논의됐다.
심포지엄에 앞서 한국을 방문한 참가자들은 9일 철원 지역 비무장지대(DMZ)를 방문하고, 한국적 인류세의 현장을 둘러보는 시간도 가졌다.
2018년 6월 설립된 KAIST 인류세연구센터에는 학내 여러 학과 및 인공위성연구소가 참여하고 있으며, 한국지질자원연구원과 인류세에 관심 있는 국내 대학 연구진들과 함께 연구 활동을 수행하고 있다.
인류세 현실 감지를 목표로 하는 `센싱(Sensing)' 그룹, 인류세에 대한 기술적이고 제도적인 적응과 실천에 관심을 두는 `인해비팅”(Inhabiting)' 그룹, 인류세에 적용할 대안 탐구를 목표로 하는 `이매니징'(Imagining)' 그룹 등 총 3개의 분야로 구성되어 있다.
이들은 한국적 인류세 공간으로서의 DMZ 연구·인공위성자료와 AI를 활용한 한반도 지표 변화 연구·손상된 지구에서 살아남기 위한 지속가능한 주거, 교통, 생활양식 전환 연구·인류세 게임과 예술작품 연구 등을 수행하고 있다.
나아가 인류세에 대한 인식을 확산하고 더 광범위한 사회 변화를 촉진하기 위해 인류세 교육 콘텐츠 구축 및 서울시립과학관과 함께 인류세 특별전시도 기획중이다. 인류세연구센터의 연구 및 활동 내용, 심포지엄 관련 정보는 인류세연구센터 홈페이지( https://anthropocenestudies.com )에서 찾아볼 수 있다.
[참고] 인류세 국제 심포지엄 참여 주요 해외 학자
윌 스테픈 (Will Steffen, 호주국립대) 지구시스템 과학자. 국제층서학회 인류세실무그룹 소속. 호주 기후 변화 자문회의 의장 및 스웨덴 스톡홀름 회복탄력성 센터 시니어 펠로우를 맡고 있다. 1998년부터 2004년까지 지구 환경 변화 연구를 위한 국제 연구 이니셔티브 IGBP (International Geosphere-Biosphere Programme)의 수석 디렉터로 활동했다. 주요 연구 분야는 기후변화를 중심으로 인간 활동이 지구시스템 변화에 끼친 영향 분석으로, IGBP의 지구시스템 과학자들과 함께 ‘행성적 경계(planetary boundaries)’ 등 인류세 연구의 핵심 개념을 고안했다.
마크 윌리엄스 (Mark Williams, 영국 레스터 대학) 고생물학자, 지질학자. 국제층서학회 인류세실무그룹 소속. 인류세의 생물권(biosphere)이 주요 연구 영역으로, 인류세실무그룹의 의장인 얀 잘라쉐비츠와 함께 지난 10여년간 지질학계의 인류세 논의를 발전시켜 왔다. 이번 심포지엄에서는 “인간에 의해 심대하게 변형된 생물권과 그것이 복지에 대해 갖는 함의”를 주제로 얀 잘라쉐비츠와의 공동 연구에 대해 발표한다.
줄리아 애드니 토머스 (Julia Adeney Thomas, 미국 노터데임 대학)
역사학자. 일본을 중심으로 자연 개념과 정치 이론 등을 연구해왔다. 주요 저서로는 , [공저] 등이 있다. 한국 DMZ에 대한 논문 “The Exquisite Corpses of Nature and History: The Case of the Korean DMZ(자연과 역사의 절묘한 시신: 한국 DMZ를 사례)”를 발표하기도 했다.
개브리엘 헥트 (Gabirelle Hecht, 미국 스탠퍼드 대학)
스탠퍼드 대학 역사학 교수이자 국제안전 및 협력 센터(Centre for International Security and Cooperation)의 핵 안전 분야 전문가로 활동하고 있다. 아프리카의 원자력 발전이 주요 연구 주제이며, 방사성 폐기물, 대기 오염 등을 중심으로 원자력 발전이 아프리카 인류세의 형성에 갖는 역할을 탐색하고 있다. 등의 저서가 있으며, 아프리카 인류세를 다룬 를 집필중이다.
제이미 로리머 (Jamie Lorimer, 영국 옥스퍼드 대학)
옥스퍼드 대 환경지리학과 교수. 아시아 코끼리 보전, 네덜란드 간척지 재야생화, 미생물, 유럽의 식물 기반 식단 등을 연구해왔다. 야생동물, 유해 동물, 미생물 등 ‘자연’을 이해하는 다양한 방식과 이것이 자연-인간 관계에 갖는 함의에 관심이 있다. (2015) 등을 집필했다. 이번 심포지엄에서는 “친생물적 행성: 인류세의 역풍과 가이아 과학의 부상”을 주제로 발표한다.
엘리자베스 들러그리(Elizabeth M. DeLoughrey, 미국 UCLA)
UCLA 환경과 지속가능성 센터 및 영문학과 교수. 카리브해와 태평양의 섬 문화권을 중심으로 문학, 식민주의와 환경이 교차하는 지점에 관심이 있다. 환경에 대한 인문사회적 접근을 다루는 국제 학술지 의 편집위원. 저서로 , 등이 있다.
스캇 개브리얼 노울즈 (Scott Gabriel Knowles, 미국 드렉셀 대학)
드렉셀 대학 역사학과 교수. 인류세의 재난이 주요 연구 분야다. 저서로 , [출간 예정]이 있다. 인류세의 재난이 주요 연구 분야로, 한국의 세월호 참사에 대해서도 관심을 갖고 연구를 수행했다. 이번 심포지엄에서는 “미국 걸프만의 느린 재난”을 주제로 발표한다.
2019.12.18
조회수 19640
 심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
2025.05.15 조회수 3667
심리적 공포기억 조절 뇌 회로 최초 규명-트라우마 치료 새 전기
자연재해, 사고, 폭력 등 위협적인 상황은 뇌에 공포 기억을 남긴다. 하지만, 과도하거나 왜곡된 공포 기억 형성은 PTSD, 불안장애, 우울증 등 심각한 정신질환으로 이어질 수 있다. 그렇다면 신체적 고통을 직접 경험했을때의 공포와, 심리적 불안으로 겪은 고통의 기억은 뇌에서 어떻게 구분되며 조절될까? KAIST 연구진은 신체적 고통 없이 심리적 불안과 공포에 의한 공포 기억 형성에 특화된 뇌 회로를 세계 최초로 규명했으며, 이 회로를 타켓으로 한 맞춤형 트라우마 치료법 개발 가능성을 열었다.
우리 대학 생명과학과 한진희 교수 연구팀은 생쥐 모델을 이용한 실험을 통해, 감각적 고통 없이 심리적 위협만으로 유도되는 공포 기억의 형성을 조절하는 핵심 뇌 회로인 pIC-PBN회로*를 규명했다.
*pIC–PBN 회로: 후측 대뇌섬엽(pIC, posterior insular cortex)에서 외측 팔곁핵(PBN, parabrachial nucleus)으로 이어지는 하향 신경 경로로, 심리적 고통 정보를 전달하는 전용 회로임을 새롭게 밝혀냄
기존에는 뇌의 외측 팔곁핵(PBN)이 척수에서 통각 정보를 전달받는 통각 상행 경로의 일부로만 알려져 있었으나, 연구팀은 비통각적 위협 자극에 의해서도 PBN이 공포학습에 필수적으로 기능한다는 새로운 사실을 밝혔다.
이번 연구는 ‘정서적 고통’과 ‘신체적 고통’이 서로 다른 뇌 신경회로에 의해 처리된다는 사실을 세계 최초로 실험적으로 입증한 사례로 평가된다. 특히, 정서적 고통을 전달하는 데 특화된 신경 회로(pIC-PBN)를 명확히 제시함으로써, 신경과학 분야에서 큰 학술적 의의를 지닌다.
이번 연구의 제 1저자인 한준호 박사는 연구의 출발점을 이렇게 설명한다.
“저희 강아지 ‘레고’는 오토바이를 무서워한다. 실제로 부딪치진 않았지만 오토바이가 빠르게 다가온 경험 이후로 오토바이 소리만 들어도 겁을 먹는다. 사람도 마찬가지로. 사고를 실제로 겪지 않더라도, 사고가 날 뻔한 경험이나 자극적인 미디어 노출만으로도 공포 기억이 생기고, 결국 PTSD로 이어질 수 있다.”
이어 “지금까지 공포 기억에 관한 연구는 신체적 고통에 기반한 실험에 의존해 왔으나, 실제 인간의 공포 기억은 신체적 고통보다는 심리적 위협에 의해 형성되는 경우가 훨씬 많다. 그럼에도 불구하고 이러한 심리적 위협을 처리하는 뇌 회로에 대해서는 거의 알려진 바가 없었다.”
연구팀은 심리적 위협을 처리하는 뇌 회로를 알아보기 위하여 전기 자극이 아닌 시각적 위협 자극을 사용하는 새로운 공포 조건화 실험 모델을 개발했다.
생쥐는 포식자가 위에서 빠르게 접근하는 상황에서 본능적으로 공포 반응을 보이는데, 연구팀은 이를 활용해 천장 화면에 빠르게 커지는 그림자를 제시함으로써 생쥐가 포식자에게 공격당하는 듯한 위협을 경험하게 하였다. 이 실험을 통해, 통각 없이도 심리적 위협만으로 공포 기억이 형성될 수 있음을 입증했다.
이 새로운 행동 실험 모델과 함께, 연구팀은 신경세포의 활성을 정밀하게 조절하는 화학유전학 및 광유전학 기법을 활용하여, 외측 팔곁핵(PBN)이 시각적 위협만으로도 공포 기억이 형성된다는 사실을 규명하였고 나아가 연구팀은 PBN으로 정보를 전달하는 상위 뇌 영역을 분석했다. 이에 따라, 부정적 정서와 고통 처리에 중요한 역할을 하는 후측 대뇌섬엽(pIC)이 PBN과 직접 연결되어 있음이 밝혀졌다.
특히 시각적 위협 자극 이후, pIC에서 PBN으로 신호를 보내는 뉴런들이 활성화되며, 이 신호가 PBN 뉴런의 활성에 필수적인 역할을 한다는 사실도 확인되었다.
연구 결과, pIC–PBN 회로를 인위적으로 억제하면 시각적 위협에 따른 공포 기억 형성이 현저히 감소하지만, 선천적인 공포 반응이나 통각 기반의 공포 학습에는 영향을 주지 않는다는 점도 규명했다. 반대로 이 회로를 인위적으로 활성화하는 것만으로도 공포 기억이 유도되어, pIC–PBN 회로가 심리적 위협 정보를 처리하고 학습을 유도하는 핵심 경로임이 드러났다.
한진희 교수는“이번 연구는 PTSD, 공황장애, 불안장애 등 정서적 고통을 주 증상으로 하는 정신질환의 발병 메커니즘을 이해하고, 맞춤형 치료법을 개발하는 데 중요한 토대를 마련할 것”이라고 밝혔다.
생명과학과 한준호 박사 (제 1저자), 서보인 박사과정(제 2저자)이 수행한 논문은 국제 학술지 사이언스 어드밴시스(Science Advances)에 2025년 5월 9일 자 온라인 게재되었다.
※ 논문명 : Han, J., Suh, B., & Han, J. H. (2025). A top-down insular cortex circuit crucial for non-nociceptive fear learning. Science Advances (https://doi.org/10.1101/2024.10.14.618356)
※ 저자 정보 : Junho Han(KAIST, 제1저자), Boin Suh(KAIST, 제2저자), and Jin-Hee Han(KAIST, 교신저자)
본 연구는 과학기술정보통신부 뇌과학원천기술개발사업과 뇌기능규명조절기술개발사업의 지원을 받아 수행되었다.
2025.05.15 조회수 3667 빛으로 기억 조절해 정신질환 치료 가능성 열어
우리 뇌에 과도한 기억이 형성되면 극심한 공포와 관련된 기억이 제대로 소멸되지 않아 발생하는 PTSD 같은 정신질환의 원인이 된다고 한다. 우리 연구진이 빛으로 단백질의 활성을 조절하는 광유전학 기술을 개발하고 이를 통해 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성을 열어 화제다.
우리 대학 생명과학과 허원도 교수 연구팀이 뇌에서 기억 형성을 조절하는 새로운 메커니즘을 밝혀냈다. 연구팀은 다양한 뇌 신경전달물질들에 의해 활성화되는 대표적인 세포내 신호전달분자효소인 PLCβ1 단백질*에 집중했다. 이번 연구는 기억 형성과 소멸을 조절하는 데 중요한 역할을 하는 단백질(PLCβ1)의 기능을 규명하였으며, PTSD와 같은 과도한 기억 형성에 의한 정신질환의 새로운 분자적 기전을 밝히는데 기여했다.
*PLCβ1 단백질: 인산지질 가수분해효소 C 베타 1
우리 뇌는 매일 다양한 경험을 통해 새로운 기억을 형성하고 소멸시킨다. 기억 형성과정은 해마라는 뇌 부위에서 이루어지며, 여기서는 양성적 신호와 음성적 신호가 균형을 맞추어 최적의 기억 형성을 유지한다. 그러나 양성 조절 인자가 부족하면 기억 형성에 문제가 생기고, 음성 조절 인자가 손상되면 과도한 기억이 형성된다. 이러한 과도한 기억 형성은 PTSD와 같은 정신질환의 원인이 될 수 있다.
허원도 교수 연구팀은 세계 최초로 단백질(PLCβ1)이 해마에서 기억 억제자로 작용하여 과도한 기억 형성을 억제하는 중요한 역할을 하는 등 동 단백질이 해마에서 특히 중요한 역할을 한다는 것을 밝혔다.
연구팀은 단백질(PLCβ1)을 결핍시킨 마우스에서 과도한 기억 형성과 공포 반응이 증가하는 것을 발견하였고, 반대로 동 단백질이 과발현하거나 광유전학으로 활성화시키면 과도한 공포 반응이 억제되는 것을 확인하였다. 이는 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 하며, 적절한 기억 형성을 유도함을 의미한다.
연구팀은 빛으로 제어하는 광유전학 기술을 개발하여 단백질(PLCβ1)의 기능을 정밀하게 조절하였다. 이 기술은 빛을 이용해 특정 단백질을 활성화하거나 비활성화할 수 있어, 뇌의 특정 부위에서 일어나는 신경 활동을 정밀하게 제어할 수 있다. 이를 통해 연구팀은 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 입증하였다. 이는 광유전학 기술이 신경 과학 연구뿐만 아니라 PTSD와 같은 정신질환 원인 규명 및 치료에도 혁신적인 도구가 될 수 있음을 보여주는 결과이다.
단백질(PLCβ1) 결핍 마우스에서 나타난 과도한 공포 반응은 PTSD 환자의 증상과 유사하다. 연구팀은 동 단백질 활성화가 극심한 스트레스로 인해 과도한 공포 기억이 형성되는 마우스 모델에서 공포 반응을 감소시킬 수 있음을 확인하였다. 이는 동 단백질이 PTSD와 같은 정신질환의 원인에 중요한 역할을 하며 동 단백질을 조절함으로써 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성이 열린 것이다.
교신저자인 허원도 교수는 "이번 연구는 단백질(PLCβ1)이 해마에서 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 밝혀냈으며, 이는 PTSD와 같은 정신질환의 새로운 치료 가능성을 제시한다. 그리고 동 단백질의 기능을 정밀하게 조절함으로써 과도한 공포 기억 형성을 억제할 수 있는 방법을 개발할 수 있을 것으로 기대되며, 이는 정신질환 치료에 혁신적인 돌파구가 될 수 있을 것이다"고 말했다. 아울러 “실제 치료에 적용되거나 동 단백질 신호 억제가 다른 뇌 기능에 어떤 영향을 미치는지, 그리고 인간에게 적용 가능한지에 대한 임상 연구가 추가적으로 필요하다.” 고 첨언했다.
생명과학과 이진수 박사가 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘사이언스 어드밴스(Sciences Advances)’2024년 7월호 인쇄판에 게재될 예정이며, 2024년 6월 28일자로 온라인판에 게재됐다. (논문명: Phospholipase C beta 1 in the dentate gyrus gates fear memory formation through regulation of neuronal excitability). (Impact Factor: 13.6). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 과학기술정보통신부 중견연구사업, KAIST 글로벌특이점 사업의 지원을 받아 수행됐다.
2024.07.15 조회수 8261
빛으로 기억 조절해 정신질환 치료 가능성 열어
우리 뇌에 과도한 기억이 형성되면 극심한 공포와 관련된 기억이 제대로 소멸되지 않아 발생하는 PTSD 같은 정신질환의 원인이 된다고 한다. 우리 연구진이 빛으로 단백질의 활성을 조절하는 광유전학 기술을 개발하고 이를 통해 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성을 열어 화제다.
우리 대학 생명과학과 허원도 교수 연구팀이 뇌에서 기억 형성을 조절하는 새로운 메커니즘을 밝혀냈다. 연구팀은 다양한 뇌 신경전달물질들에 의해 활성화되는 대표적인 세포내 신호전달분자효소인 PLCβ1 단백질*에 집중했다. 이번 연구는 기억 형성과 소멸을 조절하는 데 중요한 역할을 하는 단백질(PLCβ1)의 기능을 규명하였으며, PTSD와 같은 과도한 기억 형성에 의한 정신질환의 새로운 분자적 기전을 밝히는데 기여했다.
*PLCβ1 단백질: 인산지질 가수분해효소 C 베타 1
우리 뇌는 매일 다양한 경험을 통해 새로운 기억을 형성하고 소멸시킨다. 기억 형성과정은 해마라는 뇌 부위에서 이루어지며, 여기서는 양성적 신호와 음성적 신호가 균형을 맞추어 최적의 기억 형성을 유지한다. 그러나 양성 조절 인자가 부족하면 기억 형성에 문제가 생기고, 음성 조절 인자가 손상되면 과도한 기억이 형성된다. 이러한 과도한 기억 형성은 PTSD와 같은 정신질환의 원인이 될 수 있다.
허원도 교수 연구팀은 세계 최초로 단백질(PLCβ1)이 해마에서 기억 억제자로 작용하여 과도한 기억 형성을 억제하는 중요한 역할을 하는 등 동 단백질이 해마에서 특히 중요한 역할을 한다는 것을 밝혔다.
연구팀은 단백질(PLCβ1)을 결핍시킨 마우스에서 과도한 기억 형성과 공포 반응이 증가하는 것을 발견하였고, 반대로 동 단백질이 과발현하거나 광유전학으로 활성화시키면 과도한 공포 반응이 억제되는 것을 확인하였다. 이는 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 하며, 적절한 기억 형성을 유도함을 의미한다.
연구팀은 빛으로 제어하는 광유전학 기술을 개발하여 단백질(PLCβ1)의 기능을 정밀하게 조절하였다. 이 기술은 빛을 이용해 특정 단백질을 활성화하거나 비활성화할 수 있어, 뇌의 특정 부위에서 일어나는 신경 활동을 정밀하게 제어할 수 있다. 이를 통해 연구팀은 동 단백질이 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 입증하였다. 이는 광유전학 기술이 신경 과학 연구뿐만 아니라 PTSD와 같은 정신질환 원인 규명 및 치료에도 혁신적인 도구가 될 수 있음을 보여주는 결과이다.
단백질(PLCβ1) 결핍 마우스에서 나타난 과도한 공포 반응은 PTSD 환자의 증상과 유사하다. 연구팀은 동 단백질 활성화가 극심한 스트레스로 인해 과도한 공포 기억이 형성되는 마우스 모델에서 공포 반응을 감소시킬 수 있음을 확인하였다. 이는 동 단백질이 PTSD와 같은 정신질환의 원인에 중요한 역할을 하며 동 단백질을 조절함으로써 과도한 기억 형성을 억제해 PTSD의 발생을 줄일 수 있는 가능성이 열린 것이다.
교신저자인 허원도 교수는 "이번 연구는 단백질(PLCβ1)이 해마에서 기억 형성 초기 단계에서 중요한 역할을 한다는 것을 밝혀냈으며, 이는 PTSD와 같은 정신질환의 새로운 치료 가능성을 제시한다. 그리고 동 단백질의 기능을 정밀하게 조절함으로써 과도한 공포 기억 형성을 억제할 수 있는 방법을 개발할 수 있을 것으로 기대되며, 이는 정신질환 치료에 혁신적인 돌파구가 될 수 있을 것이다"고 말했다. 아울러 “실제 치료에 적용되거나 동 단백질 신호 억제가 다른 뇌 기능에 어떤 영향을 미치는지, 그리고 인간에게 적용 가능한지에 대한 임상 연구가 추가적으로 필요하다.” 고 첨언했다.
생명과학과 이진수 박사가 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘사이언스 어드밴스(Sciences Advances)’2024년 7월호 인쇄판에 게재될 예정이며, 2024년 6월 28일자로 온라인판에 게재됐다. (논문명: Phospholipase C beta 1 in the dentate gyrus gates fear memory formation through regulation of neuronal excitability). (Impact Factor: 13.6). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 과학기술정보통신부 중견연구사업, KAIST 글로벌특이점 사업의 지원을 받아 수행됐다.
2024.07.15 조회수 8261 스파이더맨 슈트처럼 내 몸에 착 맞춰지는 옷감형 웨어러블 햅틱 개발
우리 대학 기계공학과 오일권 교수 연구팀이 형상기억합금 와이어를 오그제틱(auxetic) 메타구조로 매듭지어 형상 적응이 가능한 옷감 형태의 착용형 '햅틱(haptic) 인터페이스'를 개발했다고 28일 밝혔다.
착용형 햅틱 인터페이스 기술은 시·청각 기반의 플랫폼의 한계를 벗어나, 피부 표면으로 전해지는 직관적인 촉감으로 메타버스 속 상호작용 몰입도를 높이는 역할을 한다.
하지만 일반적인 햅틱 인터페이스는 피부에 부착하거나 별도의 고정 장치를 착용하는 착용(부착)형으로, 이러한 햅틱 인터페이스는 장시간 사용 시 피부 발진의 위험과 고정 방식은 일상 움직임에서 불편함을 초래할 수 있다. 또 수십 개의 촉각 전달 소자를 장착해 촉감을 모방하는 기존의 제작 방식 역시 장치의 무게·부피 증가로 이어지는 한계를 보이고 있다.
우선 연구팀은 가볍고 편하게 착용할 수 있는 햅틱 인터페이스 개발을 위해 형상기억합금 와이어를 핵심 소재로 선택했다. 형상기억합금 와이어란 상온에서 모양이 쉽게 변형되고, 특정 온도에 도달하면 미리 기억된 형태로 되돌아가는 특징을 갖는 형상기억합금을 철사처럼 가늘고 길게 제작한 것이다. 이러한 형상기억합금 와이어를 기존의 천 제작 방식을 활용해 매듭지어 옷감처럼 제작하는 방식을 활용하였다. 특히, 연구팀은 형상기억합금 와이어를 오그제틱(auxetic) 구조로 매듭지어, 일반 구조에서는 볼 수 없는 3D 방향으로 구조 전체가 동시에 수축 및 이완하는 특성을 구현해 내었고, 이를 통해 착용자의 신체 형상에 순응하며 사이즈가 자동으로 조절되는 옷감형 액추에이터를 개발했다.
또한 연구팀은 8개의 영역을 개별 수축 제어할 수 있도록 설계해 총 아홉 가지 방향과 타이밍에 대한 정보를 사용자에게 촉감 피드백으로 전달할 수 있게 제작했다.
예로 팔목에 착용 시, 사용자는 방향 및 타이밍에 관한 정보를 촉각적으로 인지할 수 있고, 반면 팔꿈치에 착용할 때는 옷감형 액추에이터의 가변강성 기능을 활용해 팔꿈치의 굽힘각도에 따른 피드백을 제공하는 멀티모달(두 가지 이상의 피드백 형태로 정보를 전달) 햅틱 인터페이스로서 개발했다.
이처럼 옷감형 액추에이터를 팔목에 착용한 사용자가 가상현실 속 모빌리티 로봇 주변의 위치정보를 파악하고, 시각과 청각 정보가 제한될 때 장애물을 피해 로봇을 안정적으로 주행하는 실증에도 성공했다.
오일권 교수는 이번 연구성과를 통한 실용화 시 활용에 대해 "착용형 햅틱 인터페이스는 촉각 정보를 활용한 로봇, 무인기 제어와 메타버스가 접목된 의료·교육 등에도 활용할 수 있다"고 말했다.
한편, 이번 연구는 과학기술정보통신부(장관 이종호)와 한국연구재단이 추진하는 리더연구자(창의연구) 지원 사업으로 수행됐다. 연구 성과는 첨단 소재 분야 국제학술지 <어드밴스드 머티리얼스(Advanced Materials)>에 9월 19일 게재됐고, 연구의 우수성을 인정받아 학술지 표지 논문으로 선정됐다. (논문명: Easy-To-Wear Auxetic SMA Knot-Architecture for Spatiotemporal and Multimodal Haptic Feedbacks)
2023.11.30 조회수 8528
스파이더맨 슈트처럼 내 몸에 착 맞춰지는 옷감형 웨어러블 햅틱 개발
우리 대학 기계공학과 오일권 교수 연구팀이 형상기억합금 와이어를 오그제틱(auxetic) 메타구조로 매듭지어 형상 적응이 가능한 옷감 형태의 착용형 '햅틱(haptic) 인터페이스'를 개발했다고 28일 밝혔다.
착용형 햅틱 인터페이스 기술은 시·청각 기반의 플랫폼의 한계를 벗어나, 피부 표면으로 전해지는 직관적인 촉감으로 메타버스 속 상호작용 몰입도를 높이는 역할을 한다.
하지만 일반적인 햅틱 인터페이스는 피부에 부착하거나 별도의 고정 장치를 착용하는 착용(부착)형으로, 이러한 햅틱 인터페이스는 장시간 사용 시 피부 발진의 위험과 고정 방식은 일상 움직임에서 불편함을 초래할 수 있다. 또 수십 개의 촉각 전달 소자를 장착해 촉감을 모방하는 기존의 제작 방식 역시 장치의 무게·부피 증가로 이어지는 한계를 보이고 있다.
우선 연구팀은 가볍고 편하게 착용할 수 있는 햅틱 인터페이스 개발을 위해 형상기억합금 와이어를 핵심 소재로 선택했다. 형상기억합금 와이어란 상온에서 모양이 쉽게 변형되고, 특정 온도에 도달하면 미리 기억된 형태로 되돌아가는 특징을 갖는 형상기억합금을 철사처럼 가늘고 길게 제작한 것이다. 이러한 형상기억합금 와이어를 기존의 천 제작 방식을 활용해 매듭지어 옷감처럼 제작하는 방식을 활용하였다. 특히, 연구팀은 형상기억합금 와이어를 오그제틱(auxetic) 구조로 매듭지어, 일반 구조에서는 볼 수 없는 3D 방향으로 구조 전체가 동시에 수축 및 이완하는 특성을 구현해 내었고, 이를 통해 착용자의 신체 형상에 순응하며 사이즈가 자동으로 조절되는 옷감형 액추에이터를 개발했다.
또한 연구팀은 8개의 영역을 개별 수축 제어할 수 있도록 설계해 총 아홉 가지 방향과 타이밍에 대한 정보를 사용자에게 촉감 피드백으로 전달할 수 있게 제작했다.
예로 팔목에 착용 시, 사용자는 방향 및 타이밍에 관한 정보를 촉각적으로 인지할 수 있고, 반면 팔꿈치에 착용할 때는 옷감형 액추에이터의 가변강성 기능을 활용해 팔꿈치의 굽힘각도에 따른 피드백을 제공하는 멀티모달(두 가지 이상의 피드백 형태로 정보를 전달) 햅틱 인터페이스로서 개발했다.
이처럼 옷감형 액추에이터를 팔목에 착용한 사용자가 가상현실 속 모빌리티 로봇 주변의 위치정보를 파악하고, 시각과 청각 정보가 제한될 때 장애물을 피해 로봇을 안정적으로 주행하는 실증에도 성공했다.
오일권 교수는 이번 연구성과를 통한 실용화 시 활용에 대해 "착용형 햅틱 인터페이스는 촉각 정보를 활용한 로봇, 무인기 제어와 메타버스가 접목된 의료·교육 등에도 활용할 수 있다"고 말했다.
한편, 이번 연구는 과학기술정보통신부(장관 이종호)와 한국연구재단이 추진하는 리더연구자(창의연구) 지원 사업으로 수행됐다. 연구 성과는 첨단 소재 분야 국제학술지 <어드밴스드 머티리얼스(Advanced Materials)>에 9월 19일 게재됐고, 연구의 우수성을 인정받아 학술지 표지 논문으로 선정됐다. (논문명: Easy-To-Wear Auxetic SMA Knot-Architecture for Spatiotemporal and Multimodal Haptic Feedbacks)
2023.11.30 조회수 8528 수면 및 단기 기억력 조절을 위한 초소형 초음파 자극·뇌파 측정 시스템 개발
우리 대학 전기및전자공학부 이현주 교수, 한국뇌연구원 김정연 박사 공동연구팀이 소형 동물에서 초음파 뇌 자극과 뇌파 측정이 동시에 가능한 초소형 시스템을 개발했다고 9일 밝혔다. 수면 상태에 따라 실시간으로 초음파 뇌 자극이 가능한 해당 기술을 이용해, 연구팀은 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 시 전전두엽(PFC, Prefrontal cortex)을 실시간으로 자극해 수면 및 단기 기억력 조절이 가능함을 밝혔다.
☞ 미세 전자 기계 시스템(Micro Electro Mechanical Systems, MEMS): 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품과 시스템을 설계·제작하고 응용하는 기술을 의미한다.
☞ 초음파: 사람이 들을 수 있는 청각 영역에서 벗어난 고주파수 내역의 음파(>20 kHz).
☞ 뇌파: 저주파수 대역의 뇌 전기신호. 비침습적으로 두개골이나 두피에서 전반적인 뇌 활동을 뇌파로 측정할 수 있다. 영문으로 EEG라고 부른다.
☞ 전전두엽: 전두엽에서 인간 고유의 정신 기능을 담당하는 앞부분이다. 행동을 주시하고, 감독하고, 이끌고, 지시하고, 집중시키는 일을 하는 부위다.
이번 연구에서 개발된 초소형 초음파 자극 및 뇌파 측정 시스템은 기존의 마취가 필요한 시스템과는 달리 자유롭게 행동하는 쥐에 장기간 동시 자극과 측정을 할 수 있다. 초음파 자극 소자는 미세 전자 기계 시스템(이하 MEMS, Micro Electro Mechanical Systems)의 실리콘 공정을 활용했기 때문에 매우 정밀하고 초소형으로 제작할 수 있으며 대량생산이 가능하다. 초경량의 해당 시스템을 향후 다양한 뇌 질환 동물 모델에 적용한다면, 여러 뇌 질환에 대한 초음파 뇌 자극의 효과를 평가할 수 있을 것으로 기대된다.
기존 신경 자극 기술과는 달리 초음파는 수술 없이 뇌 심부의 국소적인 작은 영역까지도 자극할 수 있어, 저강도 집속 초음파 치료 기술이 주목받고 있다. 최근 저강도 집속 초음파 기술의 치료 효과와 유효성에 관한 연구가 활발히 진행되고 있다. 초음파를 뇌 또는 인체에 조사했더니, 알츠하이머병, 파킨슨병, 간질, 비만, 관절염 등이 호전되는 연구들이 다수 발표되고 있다.
신경 자극의 효능을 확인하는 방법으로는 생체 내 신호 측정과 행동 관찰을 들 수 있다. 그러나 이를 질병 모델이 많이 존재하는 소형 동물에서 구현하기는 쉽지 않다. 기존의 초음파 자극 기술은 부피가 커서 움직이는 생쥐에 사용이 불가능하거나 작동할 때 생기는 잡음 신호로 동시 전기 생리 신호 측정이 어렵다. 특히, 생쥐처럼 작은 동물에서 장기간으로 초음파 자극을 주면서 생체 내 반응을 실시간으로 측정하는 시스템이 없었다. 따라서 소형 동물에 인가되는 초음파 자극 실험은 통상적으로 짧게 자극 후 즉각적인 반응을 보거나 마취 상태에서 여러 차례 자극을 인가하고 장기적인 반응을 보는 연구들이 주를 이루고 있다.
이현주 교수팀은 그간 이런 문제를 해결하기 위해 MEMS 기반의 초소형 초음파 소자(CMUT, Capacitive Micromachined Ultrasound Transducer) 연구를 지속해서 수행해왔는데, 이번 연구에서 뇌파 신호 측정 및 실시간 수면 분석 기술을 접목해, 뇌의 현재 상태에 따라 자극을 주는 맞춤형, 폐루프 자극 시스템을 개발했다. 폐루프 자극 알고리즘은 6초 단위로 수면 단계를 실시간으로 분석해 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 단계일 때 초음파 자극을 전달한다. 이 시스템은 잡음 신호 없이 자극과 측정이 동시에 가능하다. NREM 상태 시 10시간 동안 수면 박탈 쥐의 전전두엽을 자극한 결과, 단기 공간 기억력이 보호되고 급속 안구 운동(REM, Rapid-eye Movement) 수면량이 증가함을 보였다.
연구팀은 현재 이 신기술을 고도화하기 위해 뇌 단일 영역의 매우 작은 부위를 자극할 수 있는 후속 시스템을 개발하고 있다. 국소 부위 자극을 통해 향후 정밀한 수면 단계 조절이 가능하게 된다면, 수술 없이 비침습적으로 수면 질환, 알츠하이머병, 파킨슨병 등의 뇌 질환 치료의 길이 열릴 것으로 연구팀은 기대하고 있다.
이현주 교수는 "초음파는 태아 영상화에도 활용될 만큼 안전한 인체 조사 기술 중 하나인데, 인체 내부 깊숙이까지 전달되며 펴지지 않고 집중 조사가 가능해 치료를 위한 비수술적 인체 조사 기술로 매우 매력적인 기술이다ˮ라고 말했다. "하지만, 전임상 자극 시스템의 부재로 현재 초음파 자극의 효능 평가 연구가 부족한 상황이며, 이번에 개발한 시스템을 많은 뇌과학 연구팀들이 활용해 초음파의 다양한 치료 효과를 밝혀낼 수 있기를 바란다ˮ라고 전했다.
전기및전자공학부 이현주 교수 연구팀의 조예현 박사과정, 그리고 한국뇌연구원 김정연 박사 연구팀이 주도하고 기초과학연구원 김성기 단장, 한국과학기술연구원 이병철 박사, 우리 대학 생명과학과 서성배 교수가 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'誌 10월 19일 字에 게재됐으며 출판사 와일리(Wiley)의 리서치 헤드라인(Research Headline) 논문으로 선정돼 이현주 교수와 김정연 박사 인터뷰가 어드밴스드 사이언스 뉴스(Advanced Science News)에 11월 1일 실렸다. (논문명: General-purpose ultrasound neuromodulation system for chronic, closed-loop preclinical studies in freely behaving rodents)
한편, 이 연구는 과학기술정보통신부 한국연구재단 차세대지능형반도체 사업의 지원으로 수행됐다.
2022.11.09 조회수 12032
수면 및 단기 기억력 조절을 위한 초소형 초음파 자극·뇌파 측정 시스템 개발
우리 대학 전기및전자공학부 이현주 교수, 한국뇌연구원 김정연 박사 공동연구팀이 소형 동물에서 초음파 뇌 자극과 뇌파 측정이 동시에 가능한 초소형 시스템을 개발했다고 9일 밝혔다. 수면 상태에 따라 실시간으로 초음파 뇌 자극이 가능한 해당 기술을 이용해, 연구팀은 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 시 전전두엽(PFC, Prefrontal cortex)을 실시간으로 자극해 수면 및 단기 기억력 조절이 가능함을 밝혔다.
☞ 미세 전자 기계 시스템(Micro Electro Mechanical Systems, MEMS): 마이크로 단위의 기계적 구조물과 전자 회로가 결합된 초소형 정밀 기계 제작 기술. 전자(반도체) 기술·기계 기술·광 기술 등을 융합해 마이크로 단위의 작은 부품과 시스템을 설계·제작하고 응용하는 기술을 의미한다.
☞ 초음파: 사람이 들을 수 있는 청각 영역에서 벗어난 고주파수 내역의 음파(>20 kHz).
☞ 뇌파: 저주파수 대역의 뇌 전기신호. 비침습적으로 두개골이나 두피에서 전반적인 뇌 활동을 뇌파로 측정할 수 있다. 영문으로 EEG라고 부른다.
☞ 전전두엽: 전두엽에서 인간 고유의 정신 기능을 담당하는 앞부분이다. 행동을 주시하고, 감독하고, 이끌고, 지시하고, 집중시키는 일을 하는 부위다.
이번 연구에서 개발된 초소형 초음파 자극 및 뇌파 측정 시스템은 기존의 마취가 필요한 시스템과는 달리 자유롭게 행동하는 쥐에 장기간 동시 자극과 측정을 할 수 있다. 초음파 자극 소자는 미세 전자 기계 시스템(이하 MEMS, Micro Electro Mechanical Systems)의 실리콘 공정을 활용했기 때문에 매우 정밀하고 초소형으로 제작할 수 있으며 대량생산이 가능하다. 초경량의 해당 시스템을 향후 다양한 뇌 질환 동물 모델에 적용한다면, 여러 뇌 질환에 대한 초음파 뇌 자극의 효과를 평가할 수 있을 것으로 기대된다.
기존 신경 자극 기술과는 달리 초음파는 수술 없이 뇌 심부의 국소적인 작은 영역까지도 자극할 수 있어, 저강도 집속 초음파 치료 기술이 주목받고 있다. 최근 저강도 집속 초음파 기술의 치료 효과와 유효성에 관한 연구가 활발히 진행되고 있다. 초음파를 뇌 또는 인체에 조사했더니, 알츠하이머병, 파킨슨병, 간질, 비만, 관절염 등이 호전되는 연구들이 다수 발표되고 있다.
신경 자극의 효능을 확인하는 방법으로는 생체 내 신호 측정과 행동 관찰을 들 수 있다. 그러나 이를 질병 모델이 많이 존재하는 소형 동물에서 구현하기는 쉽지 않다. 기존의 초음파 자극 기술은 부피가 커서 움직이는 생쥐에 사용이 불가능하거나 작동할 때 생기는 잡음 신호로 동시 전기 생리 신호 측정이 어렵다. 특히, 생쥐처럼 작은 동물에서 장기간으로 초음파 자극을 주면서 생체 내 반응을 실시간으로 측정하는 시스템이 없었다. 따라서 소형 동물에 인가되는 초음파 자극 실험은 통상적으로 짧게 자극 후 즉각적인 반응을 보거나 마취 상태에서 여러 차례 자극을 인가하고 장기적인 반응을 보는 연구들이 주를 이루고 있다.
이현주 교수팀은 그간 이런 문제를 해결하기 위해 MEMS 기반의 초소형 초음파 소자(CMUT, Capacitive Micromachined Ultrasound Transducer) 연구를 지속해서 수행해왔는데, 이번 연구에서 뇌파 신호 측정 및 실시간 수면 분석 기술을 접목해, 뇌의 현재 상태에 따라 자극을 주는 맞춤형, 폐루프 자극 시스템을 개발했다. 폐루프 자극 알고리즘은 6초 단위로 수면 단계를 실시간으로 분석해 비 급속 안구 운동(NREM, Non-rapid-eye Movement) 수면 단계일 때 초음파 자극을 전달한다. 이 시스템은 잡음 신호 없이 자극과 측정이 동시에 가능하다. NREM 상태 시 10시간 동안 수면 박탈 쥐의 전전두엽을 자극한 결과, 단기 공간 기억력이 보호되고 급속 안구 운동(REM, Rapid-eye Movement) 수면량이 증가함을 보였다.
연구팀은 현재 이 신기술을 고도화하기 위해 뇌 단일 영역의 매우 작은 부위를 자극할 수 있는 후속 시스템을 개발하고 있다. 국소 부위 자극을 통해 향후 정밀한 수면 단계 조절이 가능하게 된다면, 수술 없이 비침습적으로 수면 질환, 알츠하이머병, 파킨슨병 등의 뇌 질환 치료의 길이 열릴 것으로 연구팀은 기대하고 있다.
이현주 교수는 "초음파는 태아 영상화에도 활용될 만큼 안전한 인체 조사 기술 중 하나인데, 인체 내부 깊숙이까지 전달되며 펴지지 않고 집중 조사가 가능해 치료를 위한 비수술적 인체 조사 기술로 매우 매력적인 기술이다ˮ라고 말했다. "하지만, 전임상 자극 시스템의 부재로 현재 초음파 자극의 효능 평가 연구가 부족한 상황이며, 이번에 개발한 시스템을 많은 뇌과학 연구팀들이 활용해 초음파의 다양한 치료 효과를 밝혀낼 수 있기를 바란다ˮ라고 전했다.
전기및전자공학부 이현주 교수 연구팀의 조예현 박사과정, 그리고 한국뇌연구원 김정연 박사 연구팀이 주도하고 기초과학연구원 김성기 단장, 한국과학기술연구원 이병철 박사, 우리 대학 생명과학과 서성배 교수가 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스(Advanced Science)'誌 10월 19일 字에 게재됐으며 출판사 와일리(Wiley)의 리서치 헤드라인(Research Headline) 논문으로 선정돼 이현주 교수와 김정연 박사 인터뷰가 어드밴스드 사이언스 뉴스(Advanced Science News)에 11월 1일 실렸다. (논문명: General-purpose ultrasound neuromodulation system for chronic, closed-loop preclinical studies in freely behaving rodents)
한편, 이 연구는 과학기술정보통신부 한국연구재단 차세대지능형반도체 사업의 지원으로 수행됐다.
2022.11.09 조회수 12032 기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 9345
기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 9345 뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
2021.11.03 조회수 9468
뉴런 교체에 의한 기억 저장 규명
우리 대학 생명과학과 한진희 교수 연구팀이 살아있는 생쥐 뇌에서 기억저장 뉴런(신경 세포)을 표지하고 추적, 관찰할 수 있는 기술을 이용해 같은 경험을 다시 할 때 원래 존재하던 오래된 기억 뉴런이 새로운 뉴런으로 교체됨을 규명했다고 3일 밝혔다.
연구팀은 `뉴런 스위칭'을 가능하게 하는 기작으로 기초과학연구원(IBS) 김은준 교수 연구팀과의 공동연구를 통해 이전에 경험했던 학습을 다시 하면 기존 기억 뉴런에서 시냅스 연결이 감소하는 반면, 새로 참여하는 뉴런에서는 시냅스 연결이 증가함을 규명했다.
이번 연구는 같은 기억은 같은 뉴런에 계속 저장됨으로써 경험이 누적될 수 있을 것이라는 기존의 통념과 달리, 같은 경험을 다시 할 때 뇌에서 오히려 뉴런들이 다이내믹하게 새로 교체됨을 처음으로 증명했다는 점에서 기존의 패러다임을 전환하는 중요한 학문적 의미가 있다.
뉴런 교체는 기억 업데이트의 중요한 기작으로 생각되며 노화, 퇴행성 뇌질환에서 기억상실을 해결할 수 있는 기술 개발에 대한 새로운 아이디어를 제시한다.
생명과학과 조혜연 박사가 제1 저자로 참여한 이번 연구는 셀 프레스(Cell Press) 그룹의 오픈 액세스(Open-access) 학술지 `커런트 바이올로지(Current Biology)'에 10월 22일 字 온라인판에 게재됐다. (논문명: Turnover of fear engram cells by repeated experience)
경험은 기억이라는 형태로 뇌에 저장되고 나중에 회상된다. 또 대부분의 기억은 반복적인 경험을 통해 뇌에서 유지되고 업데이트된다. 뇌에서 기억을 표상하는 물리적 단위가 존재하며 특정 신경 세포 집단(기억 엔그램) 이 기억을 인코딩한다는 사실이 많은 연구를 통해 밝혀졌다.
그렇다면 반복된 경험에 노출되었을 경우 기억을 저장하는 뉴런들에서 어떤 변화가 일어날까? 기존 연구를 통해 같은 학습의 반복으로 형성된 기억은 같은 신경 세포 집단을 통해 계속 저장되고 강화될 것으로 추측돼왔다. 하지만 실제로 신경 세포 수준에서 어떤 변화가 일어나는지 명확히 밝혀진 바가 없었다.
연구팀은 이번 연구에서 생쥐 뇌 편도체(amygdala) 영역에서 기억저장 세포를 표지하고 광유전학 기법으로 조절하는 기술을 이용해 기존의 통념과 달리 첫 학습 하루 후에 같은 학습을 반복했을 때 `같은' 기억이 전혀 다른 세포들을 통해 다시 저장되고 회상되는 현상을 발견했다. 반복 학습된 기억이 첫 번째 학습으로 형성된 기억 엔그램을 억제하는 동안에도 정상적으로 발현되는 것을 확인한 것이다.
반복 학습 후에 기존 엔그램에서 *시냅스 가소성이 감소한 것으로 보아, 경험이 반복되면 기존의 기억 엔그램이 기억 회로상에서 연결이 약해지기 때문에 기억 발현에 관여하지 않는다는 것을 알 수 있었다.
☞ 시냅스 가소성(Synaptic plasticity): 시냅스는 신경 세포 간의 정보가 전달되는 구조적인 장소를 말하는데, 시냅스는 그 활성 정도에 따라 구조와 기능이 지속적으로 변화 가능하며 이를 시냅스 가소성이라 부른다.
이처럼 기존 기억 엔그램이 반복 학습된 공포 기억에 필요하지는 않았지만 흥미롭게도 기존 기억 엔그램을 광유전학 기법으로 자극했을 땐 공포 반응이 나타났다. 기존 기억 엔그램의 연결이 약해졌음에도 불구하고 여전히 기억 정보를 간직한 채 `휴면 엔그램 (silent engram)'으로 존재한다는 것을 확인한 결과였다.
또한 연구팀은 반복 학습된 공포 기억이 두 번째 학습 때 활성화된 편도체 뉴런들에 새로 저장된다는 것을 보임으로써 같은 경험의 기억이 처음과 다른 세포 집단에 인코딩된다는 사실을 추가로 입증했다.
한진희 교수는 "이번 연구 결과는 기억은 고정돼 있는 것처럼 보이지만 뇌에서 그 기억을 저장하는 세포들은 다이내믹하게 스위칭 된다는 새로운 패러다임을 제시하는 중요한 발견이다ˮ며, "앞으로 기억 뉴런을 표적으로 해서 원하지 않는 기억 삭제 및 퇴행성 뇌질환에서 기억상실 억제, 복원을 가능하게 하는 미래 기억제어 기술 개발에 도움을 줄 것ˮ이라고 말했다.
한편, 이번 연구는 삼성미래기술육성재단의 지원을 받아 수행됐다.
2021.11.03 조회수 9468 기억을 형성하는 원리 최초로 규명
우리 대학 생명과학과 한진희 교수 연구팀이 무수히 많은 뉴런과 이들 사이의 시냅스 연결로 구성된 복잡한 신경 네트워크에서 기억을 인코딩하는 뉴런이 선택되는 근본 원리를 규명했다고 13일 밝혔다.
우리 대학 생명과학과 정이레 박사가 제1 저자로 참여한 이번 연구는 네이처 출판 그룹의 오픈 액세스(Open-access) 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 24일 字로 게재됐다. (논문명: Synaptic plasticity-dependent competition rule influences memory formation)
과거의 경험은 기억이라는 형태로 뇌에 저장되고 나중에 불러오게 된다. 이러한 기억은 뇌 전체에 걸쳐 극히 적은 수의 뉴런들에 인코딩되고 저장된다고 알려져 있다. 하지만 이 뉴런들이 미리 정해져 있는 것인지, 아니면 어떤 원리에 의해 선택되는 것인지는 불확실하다. 이 질문을 해결하는 것은 신경과학의 미해결 난제 중 하나인 기억이 뇌에서 어떻게 형성되는지를 규명하는 것으로서 학문적으로 매우 중요할 뿐만 아니라, 치매를 치료할 수 있는 단서를 제공하기 때문에 막대한 사회, 경제적 파급 효과가 있다.
반세기 훨씬 이전에 캐나다의 신경심리학자 도널드 올딩 헤브(Donald O. Hebb)는 그의 유명한 저서인 ‘행동의 조직화(The Organization of Behavior)’ (1949) 에서 두 뉴런이 시간상으로 동시에 활성화되면 이 두 뉴런 사이의 시냅스 연결이 강화될 것이라는 시냅스 가소성(synaptic plasticity) 아이디어를 제시했고, 이후 실험을 통해 학습으로 특정 시냅스에서 실제로 장기 강화(long-term potentiation, 이하 LTP)가 일어난다는 것이 증명됐다.
이 발견 이후, LTP가 기억의 핵심 메커니즘으로 생각돼 왔다. 하지만, LTP가 기억을 인코딩하는 뉴런을 어떻게 결정하는지 지금까지 규명된 적이 없었다.
이번 연구에서는 이를 규명하기 위해 생쥐 뇌 편도체(amygdala) 부위에서 자연적인 학습 조건에서 LTP가 발생하지 않는 시냅스를 광유전학 기술을 이용해서 특정 패턴으로 자극함으로써 인위적으로 그 시냅스 연결을 강하게 만들거나 혹은 약하게 조작하고 이때 기억을 인코딩하는 뉴런이 달라지는지 연구팀은 조사했다.
먼저, 생쥐가 공포스러운 경험을 하기 전에 이 시냅스를 미리 자극해서 LTP가 일어나게 했을 때, 원래는 기억과 상관없었던 이 시냅스에 기억이 인코딩되고 LTP가 일어난 뉴런이 주변 다른 뉴런에 비해 매우 높은 확률로 선택적으로 기억 인코딩에 참여함을 발견했다.
하지만, 학습하고 난 바로 직후에 이 시냅스를 다시 광유전학 기술로 인위적으로 자극해서 이 시냅스 연결을 약하게 했을 때 더는 이 시냅스와 뉴런에 기억이 인코딩되지 않는 결과를 얻었다.
반대로, 정상적으로 생쥐가 공포스러운 경험을 하고 난 바로 직후에 LTP 자극을 통해 이 시냅스 연결을 인위적으로 강하게 했을 때 놀랍게도 LTP를 조작해준 이 시냅스에 공포 기억이 인코딩되고 주변 다른 뉴런들에 비해 LTP를 발생시킨 이 뉴런에 선택적으로 인코딩됨을 확인했다. 이러한 결과는 시냅스 강도를 인위적으로 조작했을 때 기억 자체는 변하지 않지만, 그 기억을 인코딩하는 뉴런이 변경됨을 증명한 것이다.
한진희 교수는 “LTP에 의해 뉴런들 사이에서 새로운 연결패턴이 만들어지고 이를 통해 경험과 연관된 특이적인 세포 집합체(cell assembly)가 뇌에서 새롭게 만들어진다”며 “이렇게 강하게 서로 연결된 뉴런들의 형성이 뇌에서 기억이 형성되는 원리임을 규명한 것”이라고 이번 연구 결과중요성을 설명했다.
한편, 이번 연구는 한국연구재단의 중견연구 사업 지원을 받아 수행되었으며 정이레 박사는 한국연구재단의 박사 후 국내 연수 사업의 지원을 받았다.
2021.07.13 조회수 18312
기억을 형성하는 원리 최초로 규명
우리 대학 생명과학과 한진희 교수 연구팀이 무수히 많은 뉴런과 이들 사이의 시냅스 연결로 구성된 복잡한 신경 네트워크에서 기억을 인코딩하는 뉴런이 선택되는 근본 원리를 규명했다고 13일 밝혔다.
우리 대학 생명과학과 정이레 박사가 제1 저자로 참여한 이번 연구는 네이처 출판 그룹의 오픈 액세스(Open-access) 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 24일 字로 게재됐다. (논문명: Synaptic plasticity-dependent competition rule influences memory formation)
과거의 경험은 기억이라는 형태로 뇌에 저장되고 나중에 불러오게 된다. 이러한 기억은 뇌 전체에 걸쳐 극히 적은 수의 뉴런들에 인코딩되고 저장된다고 알려져 있다. 하지만 이 뉴런들이 미리 정해져 있는 것인지, 아니면 어떤 원리에 의해 선택되는 것인지는 불확실하다. 이 질문을 해결하는 것은 신경과학의 미해결 난제 중 하나인 기억이 뇌에서 어떻게 형성되는지를 규명하는 것으로서 학문적으로 매우 중요할 뿐만 아니라, 치매를 치료할 수 있는 단서를 제공하기 때문에 막대한 사회, 경제적 파급 효과가 있다.
반세기 훨씬 이전에 캐나다의 신경심리학자 도널드 올딩 헤브(Donald O. Hebb)는 그의 유명한 저서인 ‘행동의 조직화(The Organization of Behavior)’ (1949) 에서 두 뉴런이 시간상으로 동시에 활성화되면 이 두 뉴런 사이의 시냅스 연결이 강화될 것이라는 시냅스 가소성(synaptic plasticity) 아이디어를 제시했고, 이후 실험을 통해 학습으로 특정 시냅스에서 실제로 장기 강화(long-term potentiation, 이하 LTP)가 일어난다는 것이 증명됐다.
이 발견 이후, LTP가 기억의 핵심 메커니즘으로 생각돼 왔다. 하지만, LTP가 기억을 인코딩하는 뉴런을 어떻게 결정하는지 지금까지 규명된 적이 없었다.
이번 연구에서는 이를 규명하기 위해 생쥐 뇌 편도체(amygdala) 부위에서 자연적인 학습 조건에서 LTP가 발생하지 않는 시냅스를 광유전학 기술을 이용해서 특정 패턴으로 자극함으로써 인위적으로 그 시냅스 연결을 강하게 만들거나 혹은 약하게 조작하고 이때 기억을 인코딩하는 뉴런이 달라지는지 연구팀은 조사했다.
먼저, 생쥐가 공포스러운 경험을 하기 전에 이 시냅스를 미리 자극해서 LTP가 일어나게 했을 때, 원래는 기억과 상관없었던 이 시냅스에 기억이 인코딩되고 LTP가 일어난 뉴런이 주변 다른 뉴런에 비해 매우 높은 확률로 선택적으로 기억 인코딩에 참여함을 발견했다.
하지만, 학습하고 난 바로 직후에 이 시냅스를 다시 광유전학 기술로 인위적으로 자극해서 이 시냅스 연결을 약하게 했을 때 더는 이 시냅스와 뉴런에 기억이 인코딩되지 않는 결과를 얻었다.
반대로, 정상적으로 생쥐가 공포스러운 경험을 하고 난 바로 직후에 LTP 자극을 통해 이 시냅스 연결을 인위적으로 강하게 했을 때 놀랍게도 LTP를 조작해준 이 시냅스에 공포 기억이 인코딩되고 주변 다른 뉴런들에 비해 LTP를 발생시킨 이 뉴런에 선택적으로 인코딩됨을 확인했다. 이러한 결과는 시냅스 강도를 인위적으로 조작했을 때 기억 자체는 변하지 않지만, 그 기억을 인코딩하는 뉴런이 변경됨을 증명한 것이다.
한진희 교수는 “LTP에 의해 뉴런들 사이에서 새로운 연결패턴이 만들어지고 이를 통해 경험과 연관된 특이적인 세포 집합체(cell assembly)가 뇌에서 새롭게 만들어진다”며 “이렇게 강하게 서로 연결된 뉴런들의 형성이 뇌에서 기억이 형성되는 원리임을 규명한 것”이라고 이번 연구 결과중요성을 설명했다.
한편, 이번 연구는 한국연구재단의 중견연구 사업 지원을 받아 수행되었으며 정이레 박사는 한국연구재단의 박사 후 국내 연수 사업의 지원을 받았다.
2021.07.13 조회수 18312 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14840
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14840 우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06 조회수 55897
우리 뇌가 기억력을 유지하는 메커니즘 밝혀
우리 연구진이 성인의 뇌가 기억력을 유지하는 메커니즘을 밝혔다.
우리 대학 생명과학과 정원석 교수와 이준혁 박사과정 연구팀이 한국뇌연구원의 박형주 박사와 김지영 연구원 연구팀과 공동연구를 통해 이전까지 알려지지 않았던 새로운 뇌 항상성 유지 기전을 처음으로 밝혀 국제학술지 `네이처(Nature)'에 공개했다고 5일 밝혔다.
성인 *해마에서는 학습 및 기억 형성 중에 기존의 시냅스는 사라지고 새로운 *시냅스가 생기는 시냅스 재구성이 일어난다. 그러나 어떻게 시냅스가 사라지고 이러한 시냅스 제거가 학습과 기억 과정 중에 어떠한 역할을 맡는지는 여전히 알려지지 않았다.
☞ 해마(hippocampus): 뇌의 부위 중 하나로 학습, 기억 및 새로운 것의 인식 등의 역할을 한다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
공동연구팀은 중추 신경계에서 다양한 역할을 수행하는 신경교세포 중 가장 숫자가 많은 `별아교세포'가 뇌 발달 시기에 시냅스를 먹어서 없앤다는 정원석 교수의 선행 연구 결과(네이처(Nature), 2013년)에 착안해 연구를 진행하였다. 그 결과, 성체 뇌에서도 별아교세포가 불필요한 시냅스를 끊임없이 제거하고 있음을 발견했으며, 이 현상이 학습 및 기억에 중요한 해마 내 흥분성 시냅스의 회로 유지를 가능하게 한다는 사실을 증명했다.
이전에는 신경교세포의 시냅스 제거 현상을 전자 현미경 또는 시냅스 염색법을 사용해 확인했었다. 그러나 이러한 방법은 신경교세포에 의해 먹힌 시냅스가 세포 내 산성 소화기관에서 급속히 분해되기 때문에 잔여 시냅스를 표시하고 관찰하는 데 한계가 있었다.
이에 연구팀은 시냅스에 산성화 감지가 가능한 형광단백질 조합(mCherry 물질과 eGFP 물질)을 발현시키는 바이러스 기반 시냅스 포식 리포터를 개발했다. 이 형광단백질들은 일반적인 중성 pH 조건에서 원래의 형광 강도를 유지하지만, 세포 속 소화기관 같은 산성 환경에서는 eGFP 물질은 빠르게 분해되어 신호가 사라지고 mCherry 물질은 천천히 분해되어 신호가 유지된다는 특징이 있다. 이러한 원리를 활용해, 연구팀은 mCherry-eGFP를 바이러스를 통해 흥분성 및 억제성 시냅스에 각각 발현시켰고 이후 mCherry-eGFP로 표시된 시냅스들과는 달리 신경교세포에 의해 먹힌 시냅스는 mCherry 물질만의 단독 신호로 관찰됨을 확인했다.
연구팀은 새로 개발한 방법을 이용해, 기존의 방법으로는 관찰할 수 없었던 현상인 별아교세포가 성인 해마에서 시냅스를 지속적으로 제거하며 특히 흥분성 시냅스를 더 많이 제거하고 있음을 발견했다.
놀랍게도 연구팀은 뇌의 면역세포라 불리는 미세아교세포보다 별아교세포가 주도적으로 정상 해마의 흥분성 시냅스를 제거하고 있음을 확인하여 미세아교세포가 시냅스를 제거하는 주된 세포일 것이라는 기존의 학설을 뒤집었다.
미세아교세포를 인위적으로 제거했을 때는 시냅스의 수가 변하지 않았지만, 해마의 별아교세포가 시냅스를 먹지 못하도록 유전자 조작을 했을 때는 비정상적인 시냅스가 과도하게 급증가하고 정상적인 해마 신경 회로의 기능과 기억 형성 능력이 떨어진다는 것을 처음으로 관찰한 것이다.
게다가 연구진은 유전자 변형을 통해 별아교세포의 시냅스 제거 작용을 억제한 생쥐에서는, 해마 내 시냅스 연결 가소성과 기억 형성에 문제가 생김을 발견했다. 이는 불필요한 시냅스들을 별아교세포가 제거하지 않는다면 뇌의 정상적인 학습과 기억 능력이 유지될 수 없다는 것을 의미한다.
연구팀은 이번 연구성과를 통해 별아교세포에 의한 성인 뇌의 흥분성 시냅스 재구성이 정상적 신경 회로망 유지 및 기억 형성에 필수적인 기전이라 제시했다. 이 메커니즘은 향후 뇌 기능 및 관련 신경 회로의 항상성 유지에 관한 다양한 연구들에 활용될 수 있을 것으로 기대되고 있다.
또한 연구팀은 "비정상적인 수준의 시냅스 수 변화는 자폐 스펙트럼 장애, 조현병, 치매 및 여러 형태의 발작과 같은 다양한 신경질환의 유병률과 연관성이 높다ˮ며 "시냅스 수를 다시 정상으로 회복하기 위해 별아교세포가 시냅스를 먹는 현상을 조절하는 것이 이들 뇌 질환을 치료하는 새로운 전략이 될 수 있다ˮ고 말했다.
우리 대학 생명과학과 이준혁 박사과정과 뇌연구원 김지영 연구원이 공동 제1 저자로 참여하고, 정원석 교수와 박형주 박사가 공동 교신저자로 참여한 이번 연구는 뇌인지과학 연구분야에 새로운 돌파구를 마련한 것으로 인정받아 최상위 국제학술지 `네이처(Nature)'에 지난 12월 23일 字 공개됐다. (논문명: Astrocytes phagocytose adult hippocampal synapses for circuit homeostasis)
한편, 이번 연구는 삼성미래기술육성재단, 뇌원천기술개발사업, 한국뇌연구원 기관고유사업 등의 도움을 받아 진행됐다.
2021.01.06 조회수 55897 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19817
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19817 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 16212
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 16212 인류세 연구센터, 국제 심포지엄 개최
우리대학 인류세 연구센터(센터장 박범순 교수)가 이달 10일부터 11일까지 이틀간 국립민속박물관에서 `인류세의 재난을 말하다: 지식, 기억, 상상'을 주제로 국제 심포지엄을 개최했다.
지난해 6월 개소 이후 처음 이번 국제 심포지엄에는 `인류세' 개념을 발전시킨 대표적 지구시스템과학자 윌 스테픈(Will Steffen) 호주 국립대 교수와 고생물학 및 지질학자로 국제층서학회 인류세실무그룹에 소속된 마크 윌리엄스(Mark Williams) 영국 레스터 대학 교수 등 인류세 연구를 대표하는 해외 유수 학자 열두 명이 발표자로 참석해 인류세에 대한 심도 깊은 토론을 진행했다.
국내에서는 박범순 인류세연구센터장과 전치형 KAIST 과학기술정책대학원 교수 및 국립민속박물관 · 한국지질자원연구원 · 대한지질학회 · 한국문화인류학회·한국환경사회학회 · 한국공간환경학회 등 공동 주최 기관의 다양한 관계자들이 참여해 논의의 지평을 넓혔다.
최근 국내에서 인류세 분야의 논의가 활성화되면서 이를 주제로 한 학술 행사들이 열린 사례는 있지만, 해외 학자 십수 명이 참여하는 규모의 국제 심포지엄은 이번이 처음이다. 특히, 인류세를 새로운 지질 시대로 확정하자는 주장을 이끌어온 국제층서학회 인류세 실무그룹 소속 학자들이 다수 포함되어 있어 학계의 관심이 주목됐다.
인류세(Anthropocene)는 `인간의 시대'라는 의미를 담아 제안된 새로운 지질 시대의 이름이다. 지구 환경을 변화시키는 근본적인 원인이 인간 활동에서 비롯된다는 개념에서 출발한다.
인류세 개념은 당초 제안된 자연과학 분야를 넘어 인문학·사회과학·예술 등 다양한 분야의 연구 활동을 통해 전 지구적인 위기를 진단하고 이를 극복하기 위한 지식 생산과 실천을 추구하는 패러다임으로 부상하고 있다.
무엇보다 융합연구를 통해 인류가 직면한 생태·사회적 위기를 다각도로 이해하고 이를 헤쳐 나가기 위한 공동의 노력이 필요하다는 점을 중점적으로 강조하는 학문 분야다. 이번 심포지엄에서도 융합연구의 특성을 살려 지질학 · 지구시스템과학 · 과학기술학 · 사회학 · 역사학 · 지리학 · 인류학 · 문학 등 다양한 분야의 국내외 학자 40여명이 발표 및 토론자로 참석했다.
이틀간 `인류세의 재난'에 대해 이론적·실천적 논의를 전개한 국내·외 연구자들은 인류세에서 발생하는 재난을 이해하고 헤쳐 가는 다양한 방식들을 논의했다. 다학제적 관점에서 `인류세의 재난을 어떻게 정의하고 규명할 것인가?', `지역적 재난을 전 지구적인 관점에서 바라보고 동시에 전 지구적 위험을 지역적 경험을 통해 해석하는 방법에는 어떤 것들이 있는가?' 등의 구체적인 질문을 통해 인류세의 재난을 극복하기 위한 실천적 방안들도 논의됐다.
심포지엄에 앞서 한국을 방문한 참가자들은 9일 철원 지역 비무장지대(DMZ)를 방문하고, 한국적 인류세의 현장을 둘러보는 시간도 가졌다.
2018년 6월 설립된 KAIST 인류세연구센터에는 학내 여러 학과 및 인공위성연구소가 참여하고 있으며, 한국지질자원연구원과 인류세에 관심 있는 국내 대학 연구진들과 함께 연구 활동을 수행하고 있다.
인류세 현실 감지를 목표로 하는 `센싱(Sensing)' 그룹, 인류세에 대한 기술적이고 제도적인 적응과 실천에 관심을 두는 `인해비팅”(Inhabiting)' 그룹, 인류세에 적용할 대안 탐구를 목표로 하는 `이매니징'(Imagining)' 그룹 등 총 3개의 분야로 구성되어 있다.
이들은 한국적 인류세 공간으로서의 DMZ 연구·인공위성자료와 AI를 활용한 한반도 지표 변화 연구·손상된 지구에서 살아남기 위한 지속가능한 주거, 교통, 생활양식 전환 연구·인류세 게임과 예술작품 연구 등을 수행하고 있다.
나아가 인류세에 대한 인식을 확산하고 더 광범위한 사회 변화를 촉진하기 위해 인류세 교육 콘텐츠 구축 및 서울시립과학관과 함께 인류세 특별전시도 기획중이다. 인류세연구센터의 연구 및 활동 내용, 심포지엄 관련 정보는 인류세연구센터 홈페이지( https://anthropocenestudies.com )에서 찾아볼 수 있다.
[참고] 인류세 국제 심포지엄 참여 주요 해외 학자
윌 스테픈 (Will Steffen, 호주국립대) 지구시스템 과학자. 국제층서학회 인류세실무그룹 소속. 호주 기후 변화 자문회의 의장 및 스웨덴 스톡홀름 회복탄력성 센터 시니어 펠로우를 맡고 있다. 1998년부터 2004년까지 지구 환경 변화 연구를 위한 국제 연구 이니셔티브 IGBP (International Geosphere-Biosphere Programme)의 수석 디렉터로 활동했다. 주요 연구 분야는 기후변화를 중심으로 인간 활동이 지구시스템 변화에 끼친 영향 분석으로, IGBP의 지구시스템 과학자들과 함께 ‘행성적 경계(planetary boundaries)’ 등 인류세 연구의 핵심 개념을 고안했다.
마크 윌리엄스 (Mark Williams, 영국 레스터 대학) 고생물학자, 지질학자. 국제층서학회 인류세실무그룹 소속. 인류세의 생물권(biosphere)이 주요 연구 영역으로, 인류세실무그룹의 의장인 얀 잘라쉐비츠와 함께 지난 10여년간 지질학계의 인류세 논의를 발전시켜 왔다. 이번 심포지엄에서는 “인간에 의해 심대하게 변형된 생물권과 그것이 복지에 대해 갖는 함의”를 주제로 얀 잘라쉐비츠와의 공동 연구에 대해 발표한다.
줄리아 애드니 토머스 (Julia Adeney Thomas, 미국 노터데임 대학)
역사학자. 일본을 중심으로 자연 개념과 정치 이론 등을 연구해왔다. 주요 저서로는 , [공저] 등이 있다. 한국 DMZ에 대한 논문 “The Exquisite Corpses of Nature and History: The Case of the Korean DMZ(자연과 역사의 절묘한 시신: 한국 DMZ를 사례)”를 발표하기도 했다.
개브리엘 헥트 (Gabirelle Hecht, 미국 스탠퍼드 대학)
스탠퍼드 대학 역사학 교수이자 국제안전 및 협력 센터(Centre for International Security and Cooperation)의 핵 안전 분야 전문가로 활동하고 있다. 아프리카의 원자력 발전이 주요 연구 주제이며, 방사성 폐기물, 대기 오염 등을 중심으로 원자력 발전이 아프리카 인류세의 형성에 갖는 역할을 탐색하고 있다. 등의 저서가 있으며, 아프리카 인류세를 다룬 를 집필중이다.
제이미 로리머 (Jamie Lorimer, 영국 옥스퍼드 대학)
옥스퍼드 대 환경지리학과 교수. 아시아 코끼리 보전, 네덜란드 간척지 재야생화, 미생물, 유럽의 식물 기반 식단 등을 연구해왔다. 야생동물, 유해 동물, 미생물 등 ‘자연’을 이해하는 다양한 방식과 이것이 자연-인간 관계에 갖는 함의에 관심이 있다. (2015) 등을 집필했다. 이번 심포지엄에서는 “친생물적 행성: 인류세의 역풍과 가이아 과학의 부상”을 주제로 발표한다.
엘리자베스 들러그리(Elizabeth M. DeLoughrey, 미국 UCLA)
UCLA 환경과 지속가능성 센터 및 영문학과 교수. 카리브해와 태평양의 섬 문화권을 중심으로 문학, 식민주의와 환경이 교차하는 지점에 관심이 있다. 환경에 대한 인문사회적 접근을 다루는 국제 학술지 의 편집위원. 저서로 , 등이 있다.
스캇 개브리얼 노울즈 (Scott Gabriel Knowles, 미국 드렉셀 대학)
드렉셀 대학 역사학과 교수. 인류세의 재난이 주요 연구 분야다. 저서로 , [출간 예정]이 있다. 인류세의 재난이 주요 연구 분야로, 한국의 세월호 참사에 대해서도 관심을 갖고 연구를 수행했다. 이번 심포지엄에서는 “미국 걸프만의 느린 재난”을 주제로 발표한다.
2019.12.18 조회수 19640
인류세 연구센터, 국제 심포지엄 개최
우리대학 인류세 연구센터(센터장 박범순 교수)가 이달 10일부터 11일까지 이틀간 국립민속박물관에서 `인류세의 재난을 말하다: 지식, 기억, 상상'을 주제로 국제 심포지엄을 개최했다.
지난해 6월 개소 이후 처음 이번 국제 심포지엄에는 `인류세' 개념을 발전시킨 대표적 지구시스템과학자 윌 스테픈(Will Steffen) 호주 국립대 교수와 고생물학 및 지질학자로 국제층서학회 인류세실무그룹에 소속된 마크 윌리엄스(Mark Williams) 영국 레스터 대학 교수 등 인류세 연구를 대표하는 해외 유수 학자 열두 명이 발표자로 참석해 인류세에 대한 심도 깊은 토론을 진행했다.
국내에서는 박범순 인류세연구센터장과 전치형 KAIST 과학기술정책대학원 교수 및 국립민속박물관 · 한국지질자원연구원 · 대한지질학회 · 한국문화인류학회·한국환경사회학회 · 한국공간환경학회 등 공동 주최 기관의 다양한 관계자들이 참여해 논의의 지평을 넓혔다.
최근 국내에서 인류세 분야의 논의가 활성화되면서 이를 주제로 한 학술 행사들이 열린 사례는 있지만, 해외 학자 십수 명이 참여하는 규모의 국제 심포지엄은 이번이 처음이다. 특히, 인류세를 새로운 지질 시대로 확정하자는 주장을 이끌어온 국제층서학회 인류세 실무그룹 소속 학자들이 다수 포함되어 있어 학계의 관심이 주목됐다.
인류세(Anthropocene)는 `인간의 시대'라는 의미를 담아 제안된 새로운 지질 시대의 이름이다. 지구 환경을 변화시키는 근본적인 원인이 인간 활동에서 비롯된다는 개념에서 출발한다.
인류세 개념은 당초 제안된 자연과학 분야를 넘어 인문학·사회과학·예술 등 다양한 분야의 연구 활동을 통해 전 지구적인 위기를 진단하고 이를 극복하기 위한 지식 생산과 실천을 추구하는 패러다임으로 부상하고 있다.
무엇보다 융합연구를 통해 인류가 직면한 생태·사회적 위기를 다각도로 이해하고 이를 헤쳐 나가기 위한 공동의 노력이 필요하다는 점을 중점적으로 강조하는 학문 분야다. 이번 심포지엄에서도 융합연구의 특성을 살려 지질학 · 지구시스템과학 · 과학기술학 · 사회학 · 역사학 · 지리학 · 인류학 · 문학 등 다양한 분야의 국내외 학자 40여명이 발표 및 토론자로 참석했다.
이틀간 `인류세의 재난'에 대해 이론적·실천적 논의를 전개한 국내·외 연구자들은 인류세에서 발생하는 재난을 이해하고 헤쳐 가는 다양한 방식들을 논의했다. 다학제적 관점에서 `인류세의 재난을 어떻게 정의하고 규명할 것인가?', `지역적 재난을 전 지구적인 관점에서 바라보고 동시에 전 지구적 위험을 지역적 경험을 통해 해석하는 방법에는 어떤 것들이 있는가?' 등의 구체적인 질문을 통해 인류세의 재난을 극복하기 위한 실천적 방안들도 논의됐다.
심포지엄에 앞서 한국을 방문한 참가자들은 9일 철원 지역 비무장지대(DMZ)를 방문하고, 한국적 인류세의 현장을 둘러보는 시간도 가졌다.
2018년 6월 설립된 KAIST 인류세연구센터에는 학내 여러 학과 및 인공위성연구소가 참여하고 있으며, 한국지질자원연구원과 인류세에 관심 있는 국내 대학 연구진들과 함께 연구 활동을 수행하고 있다.
인류세 현실 감지를 목표로 하는 `센싱(Sensing)' 그룹, 인류세에 대한 기술적이고 제도적인 적응과 실천에 관심을 두는 `인해비팅”(Inhabiting)' 그룹, 인류세에 적용할 대안 탐구를 목표로 하는 `이매니징'(Imagining)' 그룹 등 총 3개의 분야로 구성되어 있다.
이들은 한국적 인류세 공간으로서의 DMZ 연구·인공위성자료와 AI를 활용한 한반도 지표 변화 연구·손상된 지구에서 살아남기 위한 지속가능한 주거, 교통, 생활양식 전환 연구·인류세 게임과 예술작품 연구 등을 수행하고 있다.
나아가 인류세에 대한 인식을 확산하고 더 광범위한 사회 변화를 촉진하기 위해 인류세 교육 콘텐츠 구축 및 서울시립과학관과 함께 인류세 특별전시도 기획중이다. 인류세연구센터의 연구 및 활동 내용, 심포지엄 관련 정보는 인류세연구센터 홈페이지( https://anthropocenestudies.com )에서 찾아볼 수 있다.
[참고] 인류세 국제 심포지엄 참여 주요 해외 학자
윌 스테픈 (Will Steffen, 호주국립대) 지구시스템 과학자. 국제층서학회 인류세실무그룹 소속. 호주 기후 변화 자문회의 의장 및 스웨덴 스톡홀름 회복탄력성 센터 시니어 펠로우를 맡고 있다. 1998년부터 2004년까지 지구 환경 변화 연구를 위한 국제 연구 이니셔티브 IGBP (International Geosphere-Biosphere Programme)의 수석 디렉터로 활동했다. 주요 연구 분야는 기후변화를 중심으로 인간 활동이 지구시스템 변화에 끼친 영향 분석으로, IGBP의 지구시스템 과학자들과 함께 ‘행성적 경계(planetary boundaries)’ 등 인류세 연구의 핵심 개념을 고안했다.
마크 윌리엄스 (Mark Williams, 영국 레스터 대학) 고생물학자, 지질학자. 국제층서학회 인류세실무그룹 소속. 인류세의 생물권(biosphere)이 주요 연구 영역으로, 인류세실무그룹의 의장인 얀 잘라쉐비츠와 함께 지난 10여년간 지질학계의 인류세 논의를 발전시켜 왔다. 이번 심포지엄에서는 “인간에 의해 심대하게 변형된 생물권과 그것이 복지에 대해 갖는 함의”를 주제로 얀 잘라쉐비츠와의 공동 연구에 대해 발표한다.
줄리아 애드니 토머스 (Julia Adeney Thomas, 미국 노터데임 대학)
역사학자. 일본을 중심으로 자연 개념과 정치 이론 등을 연구해왔다. 주요 저서로는 , [공저] 등이 있다. 한국 DMZ에 대한 논문 “The Exquisite Corpses of Nature and History: The Case of the Korean DMZ(자연과 역사의 절묘한 시신: 한국 DMZ를 사례)”를 발표하기도 했다.
개브리엘 헥트 (Gabirelle Hecht, 미국 스탠퍼드 대학)
스탠퍼드 대학 역사학 교수이자 국제안전 및 협력 센터(Centre for International Security and Cooperation)의 핵 안전 분야 전문가로 활동하고 있다. 아프리카의 원자력 발전이 주요 연구 주제이며, 방사성 폐기물, 대기 오염 등을 중심으로 원자력 발전이 아프리카 인류세의 형성에 갖는 역할을 탐색하고 있다. 등의 저서가 있으며, 아프리카 인류세를 다룬 를 집필중이다.
제이미 로리머 (Jamie Lorimer, 영국 옥스퍼드 대학)
옥스퍼드 대 환경지리학과 교수. 아시아 코끼리 보전, 네덜란드 간척지 재야생화, 미생물, 유럽의 식물 기반 식단 등을 연구해왔다. 야생동물, 유해 동물, 미생물 등 ‘자연’을 이해하는 다양한 방식과 이것이 자연-인간 관계에 갖는 함의에 관심이 있다. (2015) 등을 집필했다. 이번 심포지엄에서는 “친생물적 행성: 인류세의 역풍과 가이아 과학의 부상”을 주제로 발표한다.
엘리자베스 들러그리(Elizabeth M. DeLoughrey, 미국 UCLA)
UCLA 환경과 지속가능성 센터 및 영문학과 교수. 카리브해와 태평양의 섬 문화권을 중심으로 문학, 식민주의와 환경이 교차하는 지점에 관심이 있다. 환경에 대한 인문사회적 접근을 다루는 국제 학술지 의 편집위원. 저서로 , 등이 있다.
스캇 개브리얼 노울즈 (Scott Gabriel Knowles, 미국 드렉셀 대학)
드렉셀 대학 역사학과 교수. 인류세의 재난이 주요 연구 분야다. 저서로 , [출간 예정]이 있다. 인류세의 재난이 주요 연구 분야로, 한국의 세월호 참사에 대해서도 관심을 갖고 연구를 수행했다. 이번 심포지엄에서는 “미국 걸프만의 느린 재난”을 주제로 발표한다.
2019.12.18 조회수 19640