%EB%B0%94%EC%9D%B4%EC%98%A4%EB%B0%8F%EB%87%8C%EA%B3%B5%ED%95%99%EA%B3%BC
-
 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8283
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8283 -
 세탁에도 끄떡없는 체온측정 센서 개발
개인 맞춤형 건강 관리에 관심이 높아지면서 입을 수 있는 웨어러블 전자기기가 주목받고 있다. 특히 체온은 개인의 건강 상태를 반영하는 중요한 지표이므로, 이를 일상생활에서 불편감 없이 측정하려는 다양한 형태의 센서 개발이 이루어지고 있다.
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 열인발공정(Thermal Drawing Process, TDP)*을 이용한 수백 미터 길이의 섬유(파이버)형 온도 센서를 개발했다고 20일 밝혔다.
☞ 열인발공정 : 열을 이용하여 큰 구조체를 말랑말랑하게 만든 후, 빠른 속도로 당겨 복잡한 구조체와 같은 모양 및 기능의 파이버를 뽑아내는 일 또는 가공.
의복에 쉽게 적용되는 섬유/직물형 온도 센서는 편하게 온도를 측정할 수 있다는 편리성 때문에 주목받고 있으나, 기존 센서를 만드는 제작방법 (코팅, 스피닝 등)의 경우는 대량생산이 어렵고, 구조/재료가 단순할 수 밖에 없기 때문에 물리, 화학적 안정성을 높이기 위해서 여러 추가적인 과정을 거쳐야 한다는 문제점이 있었다.
박성준 교수 연구팀은 문제 해결을 위해 이번 연구에서‘고분자-나노물질 복합체’재료와‘열인발공정’방법을 이용했다. 열을 가하면 녹는 고분자와 온도가 바뀌면 저항이 바뀌는 나노입자를 혼합하여 복합체를 제작하고, 이를 유연하고 안정적인 폴리에틸렌 시트에 감싸 원기둥 모양의 구조체를 완성하였다. 이후 연구팀은 큰 구조체에 열을 가하면서 당기면 크기가 줄어들며 섬유 형태로 변하는 열인발공정을 이용해서, 얇고, 유연하며, 물리/화학적 안정성이 높은 섬유형 온도 센서를 수백 미터 길이로 대량 생산하는 데 성공했다.
제작된 섬유의 경우, 센서를 보호할 수 있는 얇은 보호층이 포함된 상태에서 한번에 인발된다. 보호층의 효과로 센서는 1,000회의 온도 자극과 굽힘 자극에도 성능이 변하지 않았으며, 다양한 화학물질과 습도에 노출 되어도 안정성을 유지했다. 심지어 100회의 세탁을 진행했을 때도 뛰어난 안정성을 가지고 있음이 확인되었다.
섬유형 온도 센서를 실제 직물에 직조해 착용 한 결과, 연구팀은 실제 온도와 일치하게 체온을 측정할 수 있었으며, 걷는 등의 활동에도 신호의 잡음 없이 온도를 잘 측정할 수 있음을 확인했다. 또한 연구팀은 장갑에 센서를 직조함으로써 접촉하는 물질 온도를 측정하는 전자 피부로서의 가능성도 보여줬다.
이번 연구 결과는 국제 학술지 `어드벤스드 파이버 머터리얼스(Advanced Fiber Materials, 직물(textile)분야 JCR 상위 1.92% 저널)'에 2023년 6월 12일 字로 출판됐다. (논문명: Thermally drawn multi-material fibers based on polymer nanocomposite for continuous temperature sensing)
박성준 교수는 "향후 온도뿐만 아니라 다양한 요소를 동시에 감지할 수 있는 열인발공정 기반 섬유/직물형 센서 개발이 기대된다ˮ며, "이는 스마트 의류 속에 결합함으로써 헬스케어 분야 뿐만 아니라 VR/AR, 메타버스, 실생활 통신 분야 등과 접목될 수 있을 것ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진후속중견연계사업 및 과학기술정보통신부 지능형반도체사업의 지원을 받아 수행됐다.
2023.06.20 조회수 7852
세탁에도 끄떡없는 체온측정 센서 개발
개인 맞춤형 건강 관리에 관심이 높아지면서 입을 수 있는 웨어러블 전자기기가 주목받고 있다. 특히 체온은 개인의 건강 상태를 반영하는 중요한 지표이므로, 이를 일상생활에서 불편감 없이 측정하려는 다양한 형태의 센서 개발이 이루어지고 있다.
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 열인발공정(Thermal Drawing Process, TDP)*을 이용한 수백 미터 길이의 섬유(파이버)형 온도 센서를 개발했다고 20일 밝혔다.
☞ 열인발공정 : 열을 이용하여 큰 구조체를 말랑말랑하게 만든 후, 빠른 속도로 당겨 복잡한 구조체와 같은 모양 및 기능의 파이버를 뽑아내는 일 또는 가공.
의복에 쉽게 적용되는 섬유/직물형 온도 센서는 편하게 온도를 측정할 수 있다는 편리성 때문에 주목받고 있으나, 기존 센서를 만드는 제작방법 (코팅, 스피닝 등)의 경우는 대량생산이 어렵고, 구조/재료가 단순할 수 밖에 없기 때문에 물리, 화학적 안정성을 높이기 위해서 여러 추가적인 과정을 거쳐야 한다는 문제점이 있었다.
박성준 교수 연구팀은 문제 해결을 위해 이번 연구에서‘고분자-나노물질 복합체’재료와‘열인발공정’방법을 이용했다. 열을 가하면 녹는 고분자와 온도가 바뀌면 저항이 바뀌는 나노입자를 혼합하여 복합체를 제작하고, 이를 유연하고 안정적인 폴리에틸렌 시트에 감싸 원기둥 모양의 구조체를 완성하였다. 이후 연구팀은 큰 구조체에 열을 가하면서 당기면 크기가 줄어들며 섬유 형태로 변하는 열인발공정을 이용해서, 얇고, 유연하며, 물리/화학적 안정성이 높은 섬유형 온도 센서를 수백 미터 길이로 대량 생산하는 데 성공했다.
제작된 섬유의 경우, 센서를 보호할 수 있는 얇은 보호층이 포함된 상태에서 한번에 인발된다. 보호층의 효과로 센서는 1,000회의 온도 자극과 굽힘 자극에도 성능이 변하지 않았으며, 다양한 화학물질과 습도에 노출 되어도 안정성을 유지했다. 심지어 100회의 세탁을 진행했을 때도 뛰어난 안정성을 가지고 있음이 확인되었다.
섬유형 온도 센서를 실제 직물에 직조해 착용 한 결과, 연구팀은 실제 온도와 일치하게 체온을 측정할 수 있었으며, 걷는 등의 활동에도 신호의 잡음 없이 온도를 잘 측정할 수 있음을 확인했다. 또한 연구팀은 장갑에 센서를 직조함으로써 접촉하는 물질 온도를 측정하는 전자 피부로서의 가능성도 보여줬다.
이번 연구 결과는 국제 학술지 `어드벤스드 파이버 머터리얼스(Advanced Fiber Materials, 직물(textile)분야 JCR 상위 1.92% 저널)'에 2023년 6월 12일 字로 출판됐다. (논문명: Thermally drawn multi-material fibers based on polymer nanocomposite for continuous temperature sensing)
박성준 교수는 "향후 온도뿐만 아니라 다양한 요소를 동시에 감지할 수 있는 열인발공정 기반 섬유/직물형 센서 개발이 기대된다ˮ며, "이는 스마트 의류 속에 결합함으로써 헬스케어 분야 뿐만 아니라 VR/AR, 메타버스, 실생활 통신 분야 등과 접목될 수 있을 것ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진후속중견연계사업 및 과학기술정보통신부 지능형반도체사업의 지원을 받아 수행됐다.
2023.06.20 조회수 7852 -
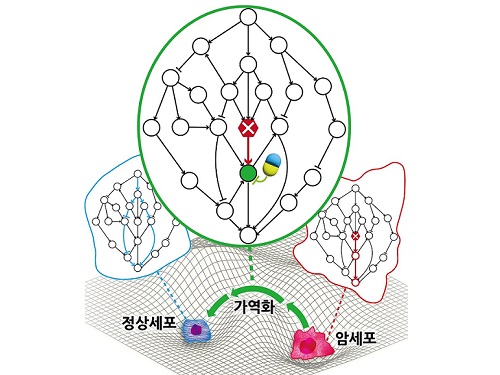 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10379
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10379 -
 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10233
항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10233 -
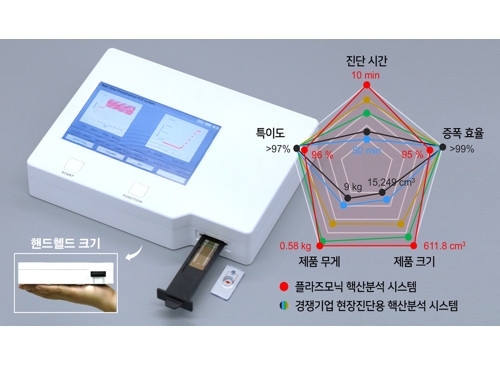 전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 10372
전염병 바이러스 10분 내 현장 진단 가능한 PCR 개발
전염성 높은 바이러스의 빠른 확산을 방지하기 위해서는 의료 현장에서 빠르고 정확하게 바이러스를 검출해 신속하게 진단하는 것이 매우 중요하다. 현재 현장 진단 검사는 신속 항원 검사에 국한되어 진단의 정확성이 낮은 문제점이 있다. 감염병 확진을 위해선 실시간 역전사 중합효소연쇄반응(Real-time reverse-transcription Polymerase Chain reaction, RT-qPCR) 검사가 필요하지만, 기술적인 한계로 인해 현장 진단 검사에는 매우 부적합한 실정이다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 나노종합기술원과 (주)오상헬스케어와의 공동연구로 개발하여 코로나-19 바이러스 검출 95% 정확도를 가진 현장 진단에 적합한 초고속 초소형 플라즈모닉 핵산 분석 시스템을 개발했다고 11일(화) 밝혔다.
연구팀이 개발한 시스템은 광열 나노소재 기반 초고속 플라즈모닉 열 순환기, 미세 유체 랩온어칩 기반 금속 박막 카트리지, 초박형 마이크로렌즈 어레이 형광 현미경 등 최첨단 마이크로 나노기술을 접목한 현장 진단형 플라즈모닉 핵산분석 시스템을 핸드헬드 크기로 개발했으며 코로나-19 RNA 바이러스를 10분 이내에 성공적으로 검출했다. 또한, 파일럿 제품의 성능평가를 위해 임상적 성능시험을 수행했으며, 임상 현장에서 정상인 시료로부터 코로나-19 환자의 시료를 95% 이상의 높은 정확도로 구분하는 데 성공했다.
`플라즈모닉 열 순환기'는 나노 및 마이크로공정기술을 통해 유리 나노 기둥 위 금나노섬 구조와 백금박막 저항 온도센서를 결합해 대면적으로 제작됐다. 해당 나노 구조는 가시광선 전 영역에서 광 흡수율이 매우 높아 백색광 다이오드(LED)의 빛을 빠르게 열로 치환해 온도 상승 속도를 대폭 향상했으며, 상단에 있는 박막 저항 온도 센서를 통해 실시간으로 표면 온도를 측정함으로써 초고속 열 순환 기능을 구현했다.
또한, 연구팀은 사출 성형된 플라스틱 미세 유체 칩과 알루미늄 박막을 결합해 `금속박막 카트리지'를 개발했으며, 이를 통해 값비싼 나노소재의 재사용률을 높이고 비용 효율을 극대화했다. 해당 금속 박막은 두께가 얇고 열전도율이 높으므로 열 순환기로부터 발생한 광열을 반응 용액에 효율적으로 전달해 온도상승 및 하강 속도를 개선했다. 또한, 금속 박막은 빛 반사율 또한 매우 높아 플라즈모닉 핵산 증폭 기술의 가장 큰 한계점인 광열 여기광원과 형광 검출 사이의 광학적 누화 현상을 완전히 해결했다.
연구팀은 미세 유체칩 내 실시간 정량화를 위해 마이크로공정기술을 활용해 곤충 눈을 모사한 `마이크로렌즈 어레이 형광 현미경'을 개발했다. 해당 기술은 초점거리의 한계를 극복해 10밀리미터(mm)의 초근접 거리에서 미세 유체 채널의 형광 이미지를 촬영할 수 있도록 제작됐고 전체 형광 시스템의 크기를 대폭 축소했다. 또한, 어레이 이미지의 병합 및 재구성을 통해 높은 동적범위 및 고대비 다중 형광 촬영이 가능하므로 플라즈모닉 핵산 증폭 동안 증가하는 유전자를 실시간으로 정량화할 수 있도록 개발했다.
정기훈 교수는 “플라즈모닉 핵산분석 시스템이 속도, 가격, 크기 측면에서 현장 진단에 매우 적합하여 진단 장비의 탈중앙화를 가능하게 할 뿐만 아니라 다중 이용 시설이나 지역 병원 등 방역 현장에서 바이러스 검출 목적으로 활용할 수 있을 것으로 기대된다” 라고 말했다.
우리 대학 바이오및뇌공학과 강병훈 박사과정이 주도한 이번 연구 결과는 국제 학술지 `에이씨에스 나노 (ACS Nano)'에 게재됐다. (논문명: 분자진단의 분산화를 위한 초고속 플라즈모닉 핵산 증폭 및 실시간 정량화, Ultrafast Plasmonic Nucleic Acid Amplification and Real-Time Quantification for Decentralized Molecular Diagnostics)
한편 이번 연구는 KAIST 코로나19대응 과학기술뉴딜사업과 과학기술정보통신부 나노소재기술개발사업으로 수행됐다.
2023.04.11 조회수 10372 -
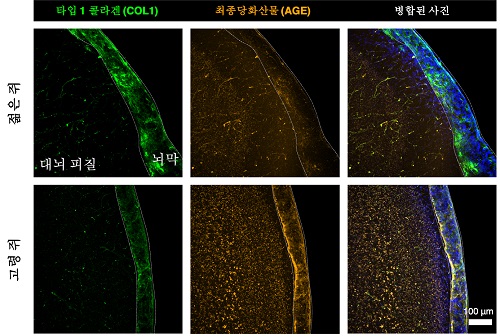 노화된 뇌막 속 쌓인 당이 장애 유발 최초 규명
평균연령 증가로 인해 심각한 뇌 질환을 동반하지 않은 일반적인 노화로 인한 뇌의 변화에 관한 연구 역시 필요한 추세다. 노화 연구와 관련하여 노화가 진행될수록 몸속에 ‘당’이 축적되고 이렇게 축적된 당은 노화-연관 염증, 혈관질환 등 다양한 질환의 원인 물질이 된다. 결국‘남아도는 당 분자’는 몸속 다양한 단백질에 붙어 단백질의 기능을 방해한다.
우리 대학 바이오및뇌공학과 김필남 교수, 정용 교수 공동연구팀이 뇌를 감싸고 있는 뇌막(혹은 뇌수막; brain meninges)이 노화에 따른 `당' 축적이 되면서 뇌 피질을 감싸고 있는 ‘최전선 방어벽'으로의 기능에 장애가 일어남을 확인했다고 15일 밝혔다.
김 교수 연구팀은 고령자의 뇌막에서 당 분자의 과도한 축적을 확인하고, 생쥐 모델에서도 나이에 따른 당의 축적이 이뤄짐을 확인하였다. 뇌막은 뇌를 감싸고 있는 얇은 막으로 뇌척수액과 피질의 경계에 존재하며 뇌를 보호하는 중요한 기능을 하고 있다. 이번 연구에서는 이러한 뇌막이 노화로 인해 생기는 기능이상이 뇌 속 ‘남아도는’ 당에 의해서 유도됨을 밝혔다. 특히, 노화에 의해서 뇌막이 얇아지고 끈적해지면서 뇌척수액과 뇌피질과의 물질교환이 감소하는 것에 대한 원리 규명에 새로운 패러다임을 제공하게 되었다.
이번 연구는 KAIST 바이오및뇌공학과 김효민 박사과정 학생과 김신흔 박사가 공동 제1 저자로 참여해 국제 학술지 `노화하는 세포(Aging Cell)'에 지난 2월 28일 자 온라인판으로 게재됐다. (논문명: Glycation mediated tissue level remodeling of brain meningeal membrane by aging)
뇌척수액과 직접 맞닿아 있는 뇌막은 주로 콜라겐 (collagen)이라는 세포외기질 (Extracellular Matrix, ECM) 단백질로 구성되어 있으며 이 단백질을 생산하는 세포인 섬유아세포 (fibroblast) 로 이루어져 있다. 당이 흡착된 콜라겐 단백질과 부착된 세포는 콜라겐의 생산기능이 떨어지는 반면, 콜라겐의 분해 효소의 발현이 높아지면서 뇌막은 지속적으로 얇아지고 붕괴된다.
지속적인 당 섭취로 인해서 초과된 당 분자가 뇌에 쌓이면서 신경세포의 변성과 뇌 질환 간의 연구는 지속적으로 진행되어 왔다. 하지만 뇌를 감싸고 있는 뇌막 자체에 초점을 두어 당 축적으로 인한 뇌막 변성 및 기능 장애를 확인한 것은 이번 연구에서 최초로 제시되었으며, 이는 뇌 질환 연구에서의 새로운 치료접근을 제시할 것을 기대할 수 있다.
제1 저자인 김효민 연구원은 “인간의 뇌에서 시작해서 생체모사 뇌막 모델과 동물모델을 활용한 융합적 접근으로 노화로 인한 뇌 장벽 변화에 대해 규명한 흥미로운 연구ˮ 라고 연구 결과를 소개했다.
김필남 교수 연구팀은 이러한 뇌막을 비롯한 인체 전반적으로 쌓이는 당을 제거하기 위한 연구개발을 진행하고 있다. 인체에서 단백질과 당이 만나서 형성되는 찌꺼기인 최종당화산물(Advanced glycation end product)는 대식세포에 의해서 일부 제거된다. 하지만, 콜라겐과 같은 세포외기질 단백질과 결합한 당화산물은 자연적으로는 제거되기 어렵다. 본 연구진은 KAIST-세라젬 연구센터를 통해서 ‘몸 속 당 찌꺼기’ 제거를 위한 헬스케어 의료기기를 개발하고 있다.
이번 연구는 한국연구재단 집단연구지원을 받아 수행됐다.
2023.03.15 조회수 7522
노화된 뇌막 속 쌓인 당이 장애 유발 최초 규명
평균연령 증가로 인해 심각한 뇌 질환을 동반하지 않은 일반적인 노화로 인한 뇌의 변화에 관한 연구 역시 필요한 추세다. 노화 연구와 관련하여 노화가 진행될수록 몸속에 ‘당’이 축적되고 이렇게 축적된 당은 노화-연관 염증, 혈관질환 등 다양한 질환의 원인 물질이 된다. 결국‘남아도는 당 분자’는 몸속 다양한 단백질에 붙어 단백질의 기능을 방해한다.
우리 대학 바이오및뇌공학과 김필남 교수, 정용 교수 공동연구팀이 뇌를 감싸고 있는 뇌막(혹은 뇌수막; brain meninges)이 노화에 따른 `당' 축적이 되면서 뇌 피질을 감싸고 있는 ‘최전선 방어벽'으로의 기능에 장애가 일어남을 확인했다고 15일 밝혔다.
김 교수 연구팀은 고령자의 뇌막에서 당 분자의 과도한 축적을 확인하고, 생쥐 모델에서도 나이에 따른 당의 축적이 이뤄짐을 확인하였다. 뇌막은 뇌를 감싸고 있는 얇은 막으로 뇌척수액과 피질의 경계에 존재하며 뇌를 보호하는 중요한 기능을 하고 있다. 이번 연구에서는 이러한 뇌막이 노화로 인해 생기는 기능이상이 뇌 속 ‘남아도는’ 당에 의해서 유도됨을 밝혔다. 특히, 노화에 의해서 뇌막이 얇아지고 끈적해지면서 뇌척수액과 뇌피질과의 물질교환이 감소하는 것에 대한 원리 규명에 새로운 패러다임을 제공하게 되었다.
이번 연구는 KAIST 바이오및뇌공학과 김효민 박사과정 학생과 김신흔 박사가 공동 제1 저자로 참여해 국제 학술지 `노화하는 세포(Aging Cell)'에 지난 2월 28일 자 온라인판으로 게재됐다. (논문명: Glycation mediated tissue level remodeling of brain meningeal membrane by aging)
뇌척수액과 직접 맞닿아 있는 뇌막은 주로 콜라겐 (collagen)이라는 세포외기질 (Extracellular Matrix, ECM) 단백질로 구성되어 있으며 이 단백질을 생산하는 세포인 섬유아세포 (fibroblast) 로 이루어져 있다. 당이 흡착된 콜라겐 단백질과 부착된 세포는 콜라겐의 생산기능이 떨어지는 반면, 콜라겐의 분해 효소의 발현이 높아지면서 뇌막은 지속적으로 얇아지고 붕괴된다.
지속적인 당 섭취로 인해서 초과된 당 분자가 뇌에 쌓이면서 신경세포의 변성과 뇌 질환 간의 연구는 지속적으로 진행되어 왔다. 하지만 뇌를 감싸고 있는 뇌막 자체에 초점을 두어 당 축적으로 인한 뇌막 변성 및 기능 장애를 확인한 것은 이번 연구에서 최초로 제시되었으며, 이는 뇌 질환 연구에서의 새로운 치료접근을 제시할 것을 기대할 수 있다.
제1 저자인 김효민 연구원은 “인간의 뇌에서 시작해서 생체모사 뇌막 모델과 동물모델을 활용한 융합적 접근으로 노화로 인한 뇌 장벽 변화에 대해 규명한 흥미로운 연구ˮ 라고 연구 결과를 소개했다.
김필남 교수 연구팀은 이러한 뇌막을 비롯한 인체 전반적으로 쌓이는 당을 제거하기 위한 연구개발을 진행하고 있다. 인체에서 단백질과 당이 만나서 형성되는 찌꺼기인 최종당화산물(Advanced glycation end product)는 대식세포에 의해서 일부 제거된다. 하지만, 콜라겐과 같은 세포외기질 단백질과 결합한 당화산물은 자연적으로는 제거되기 어렵다. 본 연구진은 KAIST-세라젬 연구센터를 통해서 ‘몸 속 당 찌꺼기’ 제거를 위한 헬스케어 의료기기를 개발하고 있다.
이번 연구는 한국연구재단 집단연구지원을 받아 수행됐다.
2023.03.15 조회수 7522 -
 암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 14201
암세포만 공략하는 스마트 면역세포 시스템 개발
우리 대학 바이오및뇌공학과 최정균 교수와 의과학대학원 박종은 교수 공동연구팀이 인공지능과 빅데이터 분석을 기반으로 스마트 면역세포를 통한 암 치료의 핵심 기술을 개발했다고 밝혔다. 이 기술은 키메라 항원 수용체(Chimeric antigen receptor, CAR)가 논리회로를 통해 작동하게 함으로써 정확하게 암세포만 공략할 수 있도록 하는 차세대 면역항암 치료법으로 기대가 모아진다. 이번 연구는 분당차병원 안희정 교수와 가톨릭의대 이혜옥 교수가 공동연구로 참여했다.
최정균 교수 연구팀은 수백만개의 세포에 대한 유전자 발현 데이터베이스를 구축하고 이를 이용해 종양세포와 정상세포 간의 유전자 발현 양상 차이를 논리회로 기반으로 찾아낼 수 있는 딥러닝 알고리즘을 개발하고 검증하는 데 성공했다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용없이 암세포만 정확하게 공략하는 것이 가능하다.
바이오및뇌공학과 권준하 박사, 의과학대학원 강준호 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 '네이처 바이오테크놀로지(Nature Biotechnology)'에 지난 2월 16일 출판됐다. (논문명: Single-cell mapping of combinatorial target antigens for CAR switches using logic gates)
최근의 암 연구에서 가장 많은 시도와 진전이 있었던 분야는 바로 면역항암치료이다. 암환자가 갖고 있는 면역체계를 활용하여 암을 극복하는 이 치료 분야에는 몇 가지 방법이 있는데, 면역관문억제제 및 암백신과 더불어 세포치료 또한 해당된다. 특히, 키메라 항원 수용체를 장착한 CAR-T 혹은 CAR-NK라고 하는 면역세포들은 암항원을 인식하여 암세포를 직접 파괴할 수 있다.
CAR 세포치료는 현재 혈액암에서의 성공을 시작으로 고형암으로 그 적용 범위를 넓히고자 하는 중인데, 혈액암과 달리 고형암에서는 부작용을 최소화하면서 효과적인 암 살상 능력을 보유하는 CAR 세포 개발에 어려움이 있었다. 이에 따라 최근에는 한 단계 진보된 CAR 엔지니어링 기술, 즉 AND, OR, NOT 과 같은 컴퓨터 연산 논리회로를 활용해 효과적으로 암세포를 공략할 수 있는 스마트 면역세포 개발이 활발히 진행되고 있다.
이러한 시점에서, 연구진은 세포 단위에서 정확히 암세포들에서만 발현하는 유전자들을 발굴하기 위해 대규모 암 및 정상 단일세포 데이터베이스를 구축했다. 이어서 연구진은 암세포들과 정상세포들을 가장 잘 구별할 수 있는 유전자 조합을 검색하는 인공지능 알고리즘을 개발했다. 특히 이 알고리즘은, 모든 유전자 조합에 대한 세포 단위 시뮬레이션을 통해 암세포만을 특이적으로 공략할 수 있는 논리회로를 찾아내는데 사용되었다. 이 방법론으로 찾아진 논리회로를 장착한 CAR 면역세포는 마치 컴퓨터처럼 암과 정상 세포를 구별하여 작동함으로써 부작용은 최소화하면서도 항암치료의 효과는 극대화시킬 수 있을 것으로 기대된다.
제1 저자인 권준하 박사는 "이번 연구는 이전에 시도된 적이 없는 방법론을 제시했는데, 특히 주목할 점은 수백만개의 개별 암세포 및 정상세포들에 대한 시뮬레이션을 통해 최적의 CAR 세포용 회로들을 찾아낸 과정이다ˮ라며 "인공지능과 컴퓨터 논리회로를 면역세포 엔지니어링에 적용하는 획기적인 기술로서 혈액암에서 성공적으로 사용되고 있는 CAR 세포치료가 고형암으로 확대되는데 중요한 역할을 할 것으로 기대된다"고 설명했다.ᅠ
이번 연구는 한국연구재단 원천기술개발사업-차세대응용오믹스사업의 지원을 받아 수행됐다.
2023.03.02 조회수 14201 -
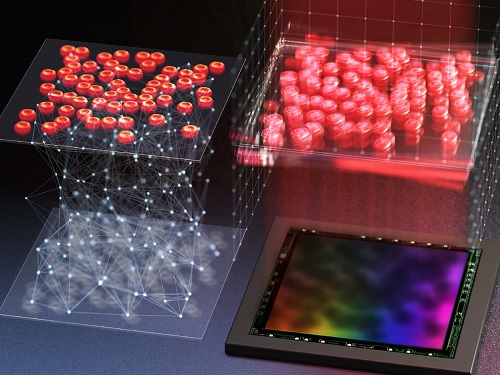 똑똑한 영상 복원 인공지능 기술 개발
딥러닝 기술은 영상 복원 속도가 기존 알고리즘 대비 수백 배 이상 빠를 뿐만 아니라 복원 정확도 역시 높다. 하지만, 주어진 학습 데이터에만 의존하는 딥러닝 기술은 영상 취득 환경상에 변화가 생기면 성능이 급격히 저하되는 치명적인 약점이 있다. 이는 알파고와 이세돌 九단과의 대국 시 `신의 한 수'에 의해 알파고의 성능이 급격하게 저하되었던 사례를 떠올리면 쉽게 이해할 수 있다. 즉, 인공지능이 학습하지 못했던 변수(학습 데이터상에 존재하지 않는 수)가 발생할 때 신뢰도가 급격히 낮아지는 인공지능 기술의 근본적인 문제이기도 하다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀과 김재철AI 대학원 예종철 교수 연구팀이 공동 연구를 통해 인공 지능의 신뢰도 문제를 해결할 수 있는 물리적 학습 기반의 영상 복원 딥러닝 기술을 개발했다고 6일 밝혔다.
연구팀은 영상 취득 환경에서 발생할 수 있는 변수 대부분이 물리적 법칙을 통해 수학적으로 기술 가능하다는 점에 착안해 물리적 법칙과 심층 신경망이 통합된 학습 기법을 제시했다.
모든 영상 기술은 물리적인 영상 기기를 통해 영상 정보를 취득한다. 연구팀은 이 정보 취득 과정에 대한 물리적인 통찰력을 인공지능에 학습시키는 방법을 개발했다. 예를 들면, `네가 도출한 복원 결과가 물리적으로 합당할까?' 혹은 `이 영상 기기는 물리적으로 이런 변수가 생길 수 있을 것 같은데?'라는 식의 질문을 통해 물리적 통찰력을 인공지능에 이식하는 방법을 제시한 것이다.
연구팀은 변화하는 영상 취득 환경에서도 신뢰도 높은 홀로그래피 영상* 을 복원하는데 성공했다. 홀로그래피 영상 기술은 의료 영상, 군용 감시, 자율 주행용 영상 등 다양한 정밀 영상 기술에 다양하게 활용될 수 있는데, 이번 연구는 의료 진단 분야의 활용성을 집중적으로 검증하였다.
*홀로그래피 영상: 물체의 그림자 패턴(회절 패턴)으로부터 물체의 형태를 복원하는 영상 기법, 일반적인 영상 기술과 달리 위상 변화에 의한 물체의 미세 구조를 감지할 수 있는 영상 기술
연구팀은 먼저 3차원 공간상에서 매우 빠르게 움직이는 적혈구의 회절 영상(확산된 그림자형상)으로부터 적혈구의 형태를 실시간으로 복원하는데 성공했다. 이러한 동적인 영상 환경에서 예상치 못한 변수로는 여러 개의 적혈구 덩어리가 복잡하게 겹쳐진다거나 적혈구가 예상하지 못했던 위치로 흘러가는 경우를 생각해 볼 수 있다. 여기서, 연구팀은 인공 지능이 생성한 영상이 합당한 결과인지 빛 전파 이론을 통해 검산하는 방식으로 물리적으로 유효한 복원 신뢰도를 구현하는데 성공하였다.
연구팀은 암 진단의 표준기술로 자리잡고 있는 생검 조직(생체에서 조직 일부를 메스나 바늘로 채취하는 것)의 영상 복원에도 성공했다. 주목할 점은 특정한 카메라 위치에서 측정된 회절 영상만을 학습했음에도 인공지능의 인지능력이 부가되어 다양한 카메라 위치에서도 물체를 인식하는데 성공했다는 점이다. 이번에 구현된 기술은 세포 염색 과정이나 수 천 만원에 달하는 현미경이 필요하지 않아 생검 조직 검사의 속도와 비용을 크게 개선할 수 있을 것으로 기대된다.
물리적 통찰력을 인공 지능에 이식하는 영상 복원 기술은 의료 진단 분야 뿐만 아니라 광범위한 영상 기술에 활용될 것으로 기대된다. 최근 영상 기술 산업계 (모바일 기기 카메라, 의료 진단용 MRI, CT, 광 기반 반도체 공정 불량 검출 등) 에선 인공지능 솔루션 탑재가 활발히 이루어지고 있다. 영상 취득에 사용되는 센서, 물체의 밝기, 물체까지의 거리와 같은 영상 취득 환경은 사용자마다 다를 수밖에 없어 적응 능력을 갖춘 인공 지능 솔루션에 대한 수요가 큰 상황이다. 현재 대부분의 인공 지능 기술은 적응 능력 부재로 신뢰도가 낮은 문제 때문에 실제 현장에서 활용성이 제한적인 상황이다.
바이오및뇌공학과 이찬석 연구원은 "데이터와 물리 법칙을 동시에 학습하는 적응형 인공지능 기술은 홀로그래피 영상뿐만 아니라 초고해상도 영상, 3차원 영상, 비시선 영상(장애물 뒷면을 보는 영상) 등 다양한 계산 영상 기술에 적용될 수 있을 것으로 기대된다ˮ고 밝혔다.
연구진은 "이번 연구를 통해 인공지능 학습에 있어서 학습 데이터에 대한 강한 의존성(신뢰도 문제)을 물리적 법칙을 결합해 해소했을 뿐만 아니라, 이미지 복원에 있어 매게 변수화된 전방 모델을 기반으로 했기 때문에 신뢰도와 적응성이 크게 향상됐다ˮ며, 이어 "이번 연구에서는 데이터의 다양한 특성 중에서 수학적 혹은 물리적으로 정확히 다룰 수 있는 측면에 집중했고, 향후 무작위적인 잡음이나 데이터의 형태에 대해서도 제약받지 않는 범용 복원 알고리즘을 개발하는 데 주력할 것이다ˮ라고 밝혔다.
바이오및뇌공학과 이찬석 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 머신 인텔리전스(Nature Machine Intelligence)'에 지난 1월 17일 字 출판됐다. (논문명: Deep learning based on parameterized physical forward model for adaptive holographic imaging with unpaired data)
한편 이번 연구는 삼성미래기술육성사업과 선도연구센터사업의 지원을 받아 수행됐다.
2023.02.06 조회수 8926
똑똑한 영상 복원 인공지능 기술 개발
딥러닝 기술은 영상 복원 속도가 기존 알고리즘 대비 수백 배 이상 빠를 뿐만 아니라 복원 정확도 역시 높다. 하지만, 주어진 학습 데이터에만 의존하는 딥러닝 기술은 영상 취득 환경상에 변화가 생기면 성능이 급격히 저하되는 치명적인 약점이 있다. 이는 알파고와 이세돌 九단과의 대국 시 `신의 한 수'에 의해 알파고의 성능이 급격하게 저하되었던 사례를 떠올리면 쉽게 이해할 수 있다. 즉, 인공지능이 학습하지 못했던 변수(학습 데이터상에 존재하지 않는 수)가 발생할 때 신뢰도가 급격히 낮아지는 인공지능 기술의 근본적인 문제이기도 하다.
우리 대학 바이오및뇌공학과 장무석 교수 연구팀과 김재철AI 대학원 예종철 교수 연구팀이 공동 연구를 통해 인공 지능의 신뢰도 문제를 해결할 수 있는 물리적 학습 기반의 영상 복원 딥러닝 기술을 개발했다고 6일 밝혔다.
연구팀은 영상 취득 환경에서 발생할 수 있는 변수 대부분이 물리적 법칙을 통해 수학적으로 기술 가능하다는 점에 착안해 물리적 법칙과 심층 신경망이 통합된 학습 기법을 제시했다.
모든 영상 기술은 물리적인 영상 기기를 통해 영상 정보를 취득한다. 연구팀은 이 정보 취득 과정에 대한 물리적인 통찰력을 인공지능에 학습시키는 방법을 개발했다. 예를 들면, `네가 도출한 복원 결과가 물리적으로 합당할까?' 혹은 `이 영상 기기는 물리적으로 이런 변수가 생길 수 있을 것 같은데?'라는 식의 질문을 통해 물리적 통찰력을 인공지능에 이식하는 방법을 제시한 것이다.
연구팀은 변화하는 영상 취득 환경에서도 신뢰도 높은 홀로그래피 영상* 을 복원하는데 성공했다. 홀로그래피 영상 기술은 의료 영상, 군용 감시, 자율 주행용 영상 등 다양한 정밀 영상 기술에 다양하게 활용될 수 있는데, 이번 연구는 의료 진단 분야의 활용성을 집중적으로 검증하였다.
*홀로그래피 영상: 물체의 그림자 패턴(회절 패턴)으로부터 물체의 형태를 복원하는 영상 기법, 일반적인 영상 기술과 달리 위상 변화에 의한 물체의 미세 구조를 감지할 수 있는 영상 기술
연구팀은 먼저 3차원 공간상에서 매우 빠르게 움직이는 적혈구의 회절 영상(확산된 그림자형상)으로부터 적혈구의 형태를 실시간으로 복원하는데 성공했다. 이러한 동적인 영상 환경에서 예상치 못한 변수로는 여러 개의 적혈구 덩어리가 복잡하게 겹쳐진다거나 적혈구가 예상하지 못했던 위치로 흘러가는 경우를 생각해 볼 수 있다. 여기서, 연구팀은 인공 지능이 생성한 영상이 합당한 결과인지 빛 전파 이론을 통해 검산하는 방식으로 물리적으로 유효한 복원 신뢰도를 구현하는데 성공하였다.
연구팀은 암 진단의 표준기술로 자리잡고 있는 생검 조직(생체에서 조직 일부를 메스나 바늘로 채취하는 것)의 영상 복원에도 성공했다. 주목할 점은 특정한 카메라 위치에서 측정된 회절 영상만을 학습했음에도 인공지능의 인지능력이 부가되어 다양한 카메라 위치에서도 물체를 인식하는데 성공했다는 점이다. 이번에 구현된 기술은 세포 염색 과정이나 수 천 만원에 달하는 현미경이 필요하지 않아 생검 조직 검사의 속도와 비용을 크게 개선할 수 있을 것으로 기대된다.
물리적 통찰력을 인공 지능에 이식하는 영상 복원 기술은 의료 진단 분야 뿐만 아니라 광범위한 영상 기술에 활용될 것으로 기대된다. 최근 영상 기술 산업계 (모바일 기기 카메라, 의료 진단용 MRI, CT, 광 기반 반도체 공정 불량 검출 등) 에선 인공지능 솔루션 탑재가 활발히 이루어지고 있다. 영상 취득에 사용되는 센서, 물체의 밝기, 물체까지의 거리와 같은 영상 취득 환경은 사용자마다 다를 수밖에 없어 적응 능력을 갖춘 인공 지능 솔루션에 대한 수요가 큰 상황이다. 현재 대부분의 인공 지능 기술은 적응 능력 부재로 신뢰도가 낮은 문제 때문에 실제 현장에서 활용성이 제한적인 상황이다.
바이오및뇌공학과 이찬석 연구원은 "데이터와 물리 법칙을 동시에 학습하는 적응형 인공지능 기술은 홀로그래피 영상뿐만 아니라 초고해상도 영상, 3차원 영상, 비시선 영상(장애물 뒷면을 보는 영상) 등 다양한 계산 영상 기술에 적용될 수 있을 것으로 기대된다ˮ고 밝혔다.
연구진은 "이번 연구를 통해 인공지능 학습에 있어서 학습 데이터에 대한 강한 의존성(신뢰도 문제)을 물리적 법칙을 결합해 해소했을 뿐만 아니라, 이미지 복원에 있어 매게 변수화된 전방 모델을 기반으로 했기 때문에 신뢰도와 적응성이 크게 향상됐다ˮ며, 이어 "이번 연구에서는 데이터의 다양한 특성 중에서 수학적 혹은 물리적으로 정확히 다룰 수 있는 측면에 집중했고, 향후 무작위적인 잡음이나 데이터의 형태에 대해서도 제약받지 않는 범용 복원 알고리즘을 개발하는 데 주력할 것이다ˮ라고 밝혔다.
바이오및뇌공학과 이찬석 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 머신 인텔리전스(Nature Machine Intelligence)'에 지난 1월 17일 字 출판됐다. (논문명: Deep learning based on parameterized physical forward model for adaptive holographic imaging with unpaired data)
한편 이번 연구는 삼성미래기술육성사업과 선도연구센터사업의 지원을 받아 수행됐다.
2023.02.06 조회수 8926 -
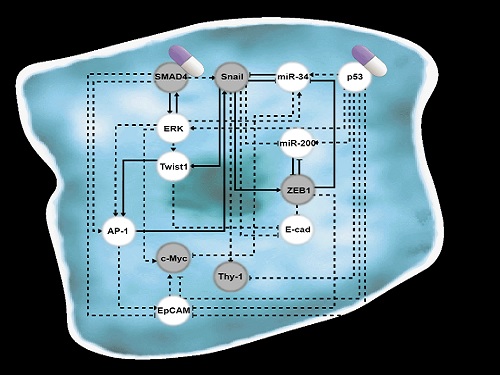 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11509
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11509 -
 바이오및뇌공학과 박영균 교수, 교육부-KERIS 대학 원격교육 우수사례 공모전 교육부장관상 수상
우리 대학 바이오및뇌공학과 박영균 교수가 교육부와 한국교육학술정보원(KERIS)에서 주최·주관한 ‘제2회 대학 원격교육 우수사례 공모전’에서 11월 4일(금) 개인 부문 최우수상(교육부 장관상)을 수상했다고 밝혔다. 해당 공모전은 전국 대학 및 전문대학의 원격교육 우수사례 발굴·전파를 통한 대학 원격교육 활성화 및 질 제고에 기여하고자 2021년에 시작되어 올해로 2회째를 맞는다.
생물실험교육은 생물실험의 특성상 디테일한 교육이 필요하고, 인큐베이터나 후드 등 값비싼 장비들이 기본적으로 필요하다. 따라서 과거에는 정해진 실험실에서 조교와 학생이 대면하여 상호작용하는 방식으로 교육되어왔다. 이러한 대면실험교육은 질 높은 교육을 제공할 수 있으나, 코로나와 같은 사회적 거리두기 상황하에 진행이 불가능하며, 소수 학생들에게만 교육을 제공할 수 있어 파급력이 떨어진다는 단점이 있다.
박 교수는 대면 생물실험교육시 조교로부터 학생에게 전달되는 풍부한 정보와 조교-학생 간 밀접한 상호작용을 증강현실 기술을 사용해 원격으로 구현함으로써, 원격 생물실험교육을 구현하였다. 즉, 학생이 증강현실 고글을 쓰고 실험실에 들어서면, 실험 과정과 단계에 대한 증강현실 콘텐츠가 적재적소에서 학생에게 보여지며, 이는 대면 교육 시 조교로부터 학생에게 전달되는 풍부한 시각 및 공간 정보를 대체하게 된다 (그림 1~2 참조). 나아가 학생은 필요 시 고글을 사용해 조교에게 전화를 걸어 본인의 실험 과정이나 결과를 실시간으로 보여줄 수 있고, 조교는 이에 대한 증강현실 주석을 달아 학생에게 공유함으로써, 대면상황에서 가능했던 밀접한 상호작용을 원격으로 대체할 수 있게 된다(그림 3 참조). 이러한 증강현실 컨텐츠와 원격 상호작용을 통해, 대면교육과 같은 질 높은 원격 생물실험교육이 가능하게 된다.
박 교수는 이러한 새로운 교육법을 활용해 ‘Bio and Brain Engineering Lab’(BiS425) 라는 과목을 개설하고, 원격 생물실험교육을 두 학기째 시도하고 있다. 나아가 해당 교육법이 학생이 원할 때 실험실에 와서 혼자 실험을 수행할 수 있기에 대면교육보다 더 다양한 종류의 생물실험을 가르칠 수 있다는 점을 활용하여, 다양한 생명수준(세포, 분자, 조직, 개체) 실험을 한 학기에 모두 수행하고 데이터를 통합하여 해석할 기회를 제공하는 ‘통합 생명실험교육’도 시도하고 있다.
박영균 교수는 "KAIST에 부임하면서 새로운 연구에 더해 새로운 교육을 시도해보고자 하는 마음이 있었는데, 이렇게 수상까지 하게 되어 영광이다ˮ면서 "이러한 시도를 물심양면으로 지원해주신 바이오및뇌공학과의 교수님들 및 직원분들과 해당 교육법 구현에 함께한 수업 조교들, 그리고 저희의 새로운 시도를 믿고 사업비를 후원해 주신 KAIST 교육학습혁신센터에 진심으로 감사드린다"며 소감을 밝혔다.
2022.12.09 조회수 6930
바이오및뇌공학과 박영균 교수, 교육부-KERIS 대학 원격교육 우수사례 공모전 교육부장관상 수상
우리 대학 바이오및뇌공학과 박영균 교수가 교육부와 한국교육학술정보원(KERIS)에서 주최·주관한 ‘제2회 대학 원격교육 우수사례 공모전’에서 11월 4일(금) 개인 부문 최우수상(교육부 장관상)을 수상했다고 밝혔다. 해당 공모전은 전국 대학 및 전문대학의 원격교육 우수사례 발굴·전파를 통한 대학 원격교육 활성화 및 질 제고에 기여하고자 2021년에 시작되어 올해로 2회째를 맞는다.
생물실험교육은 생물실험의 특성상 디테일한 교육이 필요하고, 인큐베이터나 후드 등 값비싼 장비들이 기본적으로 필요하다. 따라서 과거에는 정해진 실험실에서 조교와 학생이 대면하여 상호작용하는 방식으로 교육되어왔다. 이러한 대면실험교육은 질 높은 교육을 제공할 수 있으나, 코로나와 같은 사회적 거리두기 상황하에 진행이 불가능하며, 소수 학생들에게만 교육을 제공할 수 있어 파급력이 떨어진다는 단점이 있다.
박 교수는 대면 생물실험교육시 조교로부터 학생에게 전달되는 풍부한 정보와 조교-학생 간 밀접한 상호작용을 증강현실 기술을 사용해 원격으로 구현함으로써, 원격 생물실험교육을 구현하였다. 즉, 학생이 증강현실 고글을 쓰고 실험실에 들어서면, 실험 과정과 단계에 대한 증강현실 콘텐츠가 적재적소에서 학생에게 보여지며, 이는 대면 교육 시 조교로부터 학생에게 전달되는 풍부한 시각 및 공간 정보를 대체하게 된다 (그림 1~2 참조). 나아가 학생은 필요 시 고글을 사용해 조교에게 전화를 걸어 본인의 실험 과정이나 결과를 실시간으로 보여줄 수 있고, 조교는 이에 대한 증강현실 주석을 달아 학생에게 공유함으로써, 대면상황에서 가능했던 밀접한 상호작용을 원격으로 대체할 수 있게 된다(그림 3 참조). 이러한 증강현실 컨텐츠와 원격 상호작용을 통해, 대면교육과 같은 질 높은 원격 생물실험교육이 가능하게 된다.
박 교수는 이러한 새로운 교육법을 활용해 ‘Bio and Brain Engineering Lab’(BiS425) 라는 과목을 개설하고, 원격 생물실험교육을 두 학기째 시도하고 있다. 나아가 해당 교육법이 학생이 원할 때 실험실에 와서 혼자 실험을 수행할 수 있기에 대면교육보다 더 다양한 종류의 생물실험을 가르칠 수 있다는 점을 활용하여, 다양한 생명수준(세포, 분자, 조직, 개체) 실험을 한 학기에 모두 수행하고 데이터를 통합하여 해석할 기회를 제공하는 ‘통합 생명실험교육’도 시도하고 있다.
박영균 교수는 "KAIST에 부임하면서 새로운 연구에 더해 새로운 교육을 시도해보고자 하는 마음이 있었는데, 이렇게 수상까지 하게 되어 영광이다ˮ면서 "이러한 시도를 물심양면으로 지원해주신 바이오및뇌공학과의 교수님들 및 직원분들과 해당 교육법 구현에 함께한 수업 조교들, 그리고 저희의 새로운 시도를 믿고 사업비를 후원해 주신 KAIST 교육학습혁신센터에 진심으로 감사드린다"며 소감을 밝혔다.
2022.12.09 조회수 6930 -
 2022년 창의도전연구실 16개 선정 및 현판식 개최
우리 대학 연구처가 ‘2022년 창의도전연구실’ 16개를 선정하고 5월 30일(월) 오후 현판식을 개최했다. ‘창의도전연구사업 C2(Creative & Challenging) 프로젝트’란 학술적·사회적 의미가 크고 미래 사회 이슈로 대두될 가능성이 높은 문제를 선 발굴, 선 해결하는 연구를 지원하는 사업이다.
이는 우리 대학 이광형 총장이 미래 50년을 위해 제시한 ‘QAIST 신문화 전략’ 중 하나로, 연구자들이 실패를 두려워하지 않고 창의적인 아이디어로 과감하게 문제에 도전하는 연구 문화를 조성하고자 기획됐다.
연구처는 지난 3월 공고를 시행하고 창의성과 도전성을 기준으로 총 16개 과제를 선정했다. 5월 30일(월) 5시에 열린 `창의도전연구실(Creative&Challenging)' 현판식은 제안 주제 중 최고점을 받은 바이오및뇌공학과 박성준 교수 연구실에서 대표로 진행했다.
현판식에는 이광형 총장, 이상엽 연구부총장, 조광현 연구처장, 이동만 공과대학장, 정기훈 바이오및뇌공학과장, 성단근 명예교수와 박성준 교수(연구책임자)가 참석했다.
박성준 교수는 “창의도전연구실에 선정 되어 매우 기쁘다. 앞으로 ‘리버스 뇌 오가노이드-기계 인터페이스 개발’ 연구에 책임을 다하겠다. 본 연구 지원 사업을 통해 새로운 문제에 다양한 아이디어로 도전하며 개념검증을 시행할 것”이라고 소감을 전했다.
한편, 2022년 말까지 진행하는 본 사업에 선정된 16개 과제에는 각 5천만 원 이내의 연구비를 지원한다. 연구처는 향후 평가를 통해 선정된 과제에 대해 창의적 기초융합연구 관련하여 보다 중장기적으로 지원하는 ‘도약연구(UP) 사업’으로 연계하여 지속 지원할 예정이다.
또한, 연말 수행평가에서 문제해결과 검증을 탁월하게 제시한 우수 교원에게는 2023년 리서치데이에 ‘QAIST 창의도전 연구상’을 수여할 계획이다.
2022.06.09 조회수 12874
2022년 창의도전연구실 16개 선정 및 현판식 개최
우리 대학 연구처가 ‘2022년 창의도전연구실’ 16개를 선정하고 5월 30일(월) 오후 현판식을 개최했다. ‘창의도전연구사업 C2(Creative & Challenging) 프로젝트’란 학술적·사회적 의미가 크고 미래 사회 이슈로 대두될 가능성이 높은 문제를 선 발굴, 선 해결하는 연구를 지원하는 사업이다.
이는 우리 대학 이광형 총장이 미래 50년을 위해 제시한 ‘QAIST 신문화 전략’ 중 하나로, 연구자들이 실패를 두려워하지 않고 창의적인 아이디어로 과감하게 문제에 도전하는 연구 문화를 조성하고자 기획됐다.
연구처는 지난 3월 공고를 시행하고 창의성과 도전성을 기준으로 총 16개 과제를 선정했다. 5월 30일(월) 5시에 열린 `창의도전연구실(Creative&Challenging)' 현판식은 제안 주제 중 최고점을 받은 바이오및뇌공학과 박성준 교수 연구실에서 대표로 진행했다.
현판식에는 이광형 총장, 이상엽 연구부총장, 조광현 연구처장, 이동만 공과대학장, 정기훈 바이오및뇌공학과장, 성단근 명예교수와 박성준 교수(연구책임자)가 참석했다.
박성준 교수는 “창의도전연구실에 선정 되어 매우 기쁘다. 앞으로 ‘리버스 뇌 오가노이드-기계 인터페이스 개발’ 연구에 책임을 다하겠다. 본 연구 지원 사업을 통해 새로운 문제에 다양한 아이디어로 도전하며 개념검증을 시행할 것”이라고 소감을 전했다.
한편, 2022년 말까지 진행하는 본 사업에 선정된 16개 과제에는 각 5천만 원 이내의 연구비를 지원한다. 연구처는 향후 평가를 통해 선정된 과제에 대해 창의적 기초융합연구 관련하여 보다 중장기적으로 지원하는 ‘도약연구(UP) 사업’으로 연계하여 지속 지원할 예정이다.
또한, 연말 수행평가에서 문제해결과 검증을 탁월하게 제시한 우수 교원에게는 2023년 리서치데이에 ‘QAIST 창의도전 연구상’을 수여할 계획이다.
2022.06.09 조회수 12874 -
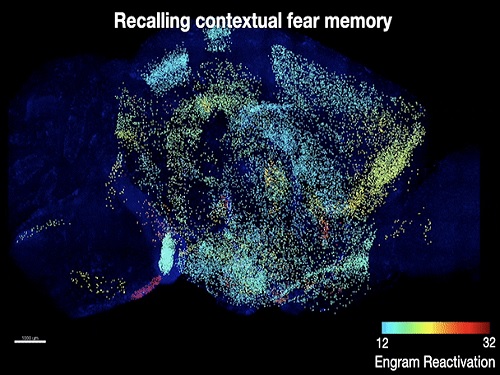 기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 8969
기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 8969