%EB%82%98%EB%85%B8%EC%9E%85%EC%9E%90
-
 비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 838
비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 838 -
 햇빛만으로 결빙 방지되는 필름 개발
열선, 스프레이 및 오일 주기적 도포, 기판 디자인 변경 등 없이도 금나노입자의 광열 효과를 산업현장에 적용할 수 있는 방빙/제빙 필름 코팅 기술이 개발되었다.
우리 대학 기계공학과 김형수 교수 연구팀(유체 및 계면 연구실)과 화학과 윤동기 교수 연구팀(연성 물질 나노조립 연구실)의 공동융합연구를 통해 단순 증발만으로 금 나노막대 입자를 사분면으로 균일하게 패터닝 할 수 있는 원천 기술을 확보하고, 이를 이용해 결빙 방지 및 제빙 표면을 개발했다고 3일 밝혔다.
최근 다양한 코팅 기법을 이용해 목표물 표면의 성질을 제어하려는 연구가 많이 진행되고 있으며, 특히, 기능성 나노 재료 패터닝을 통한 방식이 큰 주목을 받고 있다. 이 중에서도 금 나노 막대(GNR)는 생체 적합성, 화학적 안정성, 비교적 쉬운 합성, 표면 플라즈몬 공명이라는 안정적이면서도 독특한 특성으로 인해 유망한 나노물질 중 하나로 여겨지고 있다. 이때, 금 나노 막대의 성능을 극대화하려면 높은 수준의 증착 필름의 균일도와 금 나노 막대의 정렬도를 획득하는 것이 매우 중요하며, 현재 이를 구현하는 것은 여전히 해결해야 할 큰 문제다.
이를 해결하고자, 공동연구팀은 자연계에서 쉽게 추출이 가능한 차세대 기능성 나노 물질인 셀룰로오스 나노크리스탈(CNC)를 활용했다. 셀룰로오스 나노크리스탈 사분면 템플릿에 금 나노 막대를 공동 자가 조립해 균일하게 건조되면서 코팅 전체 면적에 환형으로 균일하게 정렬된 금 나노막대 필름을 개발하는 데 성공했다. 이번 연구에서 획득한 높은 균일도와 정렬도를 갖는 금 나노막대 필름은 기존 커피링 필름과 비교해 향상된 플라즈모닉 광학/광열 성능을 보였으며, 이는 가시광선 파장 영역대의 빛 조사만으로 방빙/제빙 역할을 해낼 수 있음을 연구팀은 실험적으로 증명했다.
기계공학과 김형수 교수는 “이 기술은 플라스틱 및 유연 표면 위에도 제작이 가능해 이를 외장재 및 필름에 활용하면 자체적으로 열에너지를 발생시킬 수 있어, 겨울철에 큰 문제가 되는 자동차 성에, 항공기 제빙, 주거/상용 공간의 유리창 등 다양한 분야에서 자발적 열에너지 하베스팅 효과를 통해 에너지 절약 효과를 가져다 줄 수 있을 것으로 기대한다”고 언급했다. 한편 화학과 윤동기 교수는 “필름화하기 힘들었던 나노셀룰로오스-금입자 복합체를 대면적에서 자유롭게 패터닝해 결빙 소재로 사용할 수 있고, 금의 플라즈모닉 성질을 이용한다면 마치 유리를 장식하는 스테인드 글래스처럼 사용할 수 있다는 점에서 의미가 있다”고 언급했다.
해당 연구 결과는 기계공학과 편정수 박사과정, 박순모 박사(KAIST졸업, 現 코넬 대학교 박사 후 연구원)가 공동 제1 저자로 참여했으며, 국제학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2023년 12월 8일 字 온라인판에 게재됐다. (논문명 : Plasmonic Metasurfaces of Cellulose Nanocrystal Matrices with Quadrants of Aligned Gold Nanorods for Photothermal Anti-Icing, https://doi.org/10.1038/s41467-023-43511-9) 그리고, 연구의 우수성을 인정받아 국제 저널‘재료과학과 화학(Materials Science and Chemistry)’ 과 ‘무기 물리화학(Inorganic and Physical Chemistry)’ 두 편집자 하이라이트(Editors’ Highlights) 페이지에 선정됐다.
이번 연구는 한국연구재단의 개인기초 중견 연구(MIST: 2021R1A2C2007835)와 멀티스케일 카이랄 구조체 연구센터 (MSIT: 2018R1A5A1025208) 지원을 받아 수행됐다.
2024.01.03 조회수 5002
햇빛만으로 결빙 방지되는 필름 개발
열선, 스프레이 및 오일 주기적 도포, 기판 디자인 변경 등 없이도 금나노입자의 광열 효과를 산업현장에 적용할 수 있는 방빙/제빙 필름 코팅 기술이 개발되었다.
우리 대학 기계공학과 김형수 교수 연구팀(유체 및 계면 연구실)과 화학과 윤동기 교수 연구팀(연성 물질 나노조립 연구실)의 공동융합연구를 통해 단순 증발만으로 금 나노막대 입자를 사분면으로 균일하게 패터닝 할 수 있는 원천 기술을 확보하고, 이를 이용해 결빙 방지 및 제빙 표면을 개발했다고 3일 밝혔다.
최근 다양한 코팅 기법을 이용해 목표물 표면의 성질을 제어하려는 연구가 많이 진행되고 있으며, 특히, 기능성 나노 재료 패터닝을 통한 방식이 큰 주목을 받고 있다. 이 중에서도 금 나노 막대(GNR)는 생체 적합성, 화학적 안정성, 비교적 쉬운 합성, 표면 플라즈몬 공명이라는 안정적이면서도 독특한 특성으로 인해 유망한 나노물질 중 하나로 여겨지고 있다. 이때, 금 나노 막대의 성능을 극대화하려면 높은 수준의 증착 필름의 균일도와 금 나노 막대의 정렬도를 획득하는 것이 매우 중요하며, 현재 이를 구현하는 것은 여전히 해결해야 할 큰 문제다.
이를 해결하고자, 공동연구팀은 자연계에서 쉽게 추출이 가능한 차세대 기능성 나노 물질인 셀룰로오스 나노크리스탈(CNC)를 활용했다. 셀룰로오스 나노크리스탈 사분면 템플릿에 금 나노 막대를 공동 자가 조립해 균일하게 건조되면서 코팅 전체 면적에 환형으로 균일하게 정렬된 금 나노막대 필름을 개발하는 데 성공했다. 이번 연구에서 획득한 높은 균일도와 정렬도를 갖는 금 나노막대 필름은 기존 커피링 필름과 비교해 향상된 플라즈모닉 광학/광열 성능을 보였으며, 이는 가시광선 파장 영역대의 빛 조사만으로 방빙/제빙 역할을 해낼 수 있음을 연구팀은 실험적으로 증명했다.
기계공학과 김형수 교수는 “이 기술은 플라스틱 및 유연 표면 위에도 제작이 가능해 이를 외장재 및 필름에 활용하면 자체적으로 열에너지를 발생시킬 수 있어, 겨울철에 큰 문제가 되는 자동차 성에, 항공기 제빙, 주거/상용 공간의 유리창 등 다양한 분야에서 자발적 열에너지 하베스팅 효과를 통해 에너지 절약 효과를 가져다 줄 수 있을 것으로 기대한다”고 언급했다. 한편 화학과 윤동기 교수는 “필름화하기 힘들었던 나노셀룰로오스-금입자 복합체를 대면적에서 자유롭게 패터닝해 결빙 소재로 사용할 수 있고, 금의 플라즈모닉 성질을 이용한다면 마치 유리를 장식하는 스테인드 글래스처럼 사용할 수 있다는 점에서 의미가 있다”고 언급했다.
해당 연구 결과는 기계공학과 편정수 박사과정, 박순모 박사(KAIST졸업, 現 코넬 대학교 박사 후 연구원)가 공동 제1 저자로 참여했으며, 국제학술지 `네이처 커뮤니케이션즈(Nature Communications)' 2023년 12월 8일 字 온라인판에 게재됐다. (논문명 : Plasmonic Metasurfaces of Cellulose Nanocrystal Matrices with Quadrants of Aligned Gold Nanorods for Photothermal Anti-Icing, https://doi.org/10.1038/s41467-023-43511-9) 그리고, 연구의 우수성을 인정받아 국제 저널‘재료과학과 화학(Materials Science and Chemistry)’ 과 ‘무기 물리화학(Inorganic and Physical Chemistry)’ 두 편집자 하이라이트(Editors’ Highlights) 페이지에 선정됐다.
이번 연구는 한국연구재단의 개인기초 중견 연구(MIST: 2021R1A2C2007835)와 멀티스케일 카이랄 구조체 연구센터 (MSIT: 2018R1A5A1025208) 지원을 받아 수행됐다.
2024.01.03 조회수 5002 -
 강한 빛에서 0.02초 내에 새로운 촉매를 합성하다
대면적의 빛을 활용하고 대기 중의 환경에서 0.02초 이내에 연료전지 등 차세대 에너지 저장 및 발전에 광범위하게 적용되는 고엔트로피 촉매 및 단일원자 촉매의 합성을 세계 최초로 구현했다.
우리 대학 전기및전자공학부 최성율 교수 연구팀과 신소재공학과 김일두 교수 연구팀이 공동연구를 통해 강한 빛을 다양한 탄소 기반 소재에 조사해, 0.02초 이내에 나노입자 촉매와 단일원자(single atom) 촉매를 진공 시설이 없는 대기 조건에서 합성하고 우수한 촉매 성능을 구현하는데 성공했다고 6일 밝혔다.
연구팀은 2022년 4월 제논 램프 빛을 조사해 금속산화물의 상(phase) 변화와 표면에 촉매 입자가 생성될 수 있음을 최초로 밝혔고 그 후속으로 소재의 광열효과를 유도하는 합성법에 대한 연구를 진행했다. 이에 초고온(1,800~3,000oC)과 빠른 승/하온 속도(105 oC/초)를 통해 기존의 합성법으로는 구현할 수 없는 촉매 입자를 합성하는 데 성공했다.
이번 기술은 대면적의 빛을 활용하고 대기 중의 환경에서 매우 빠른 시간(0.02초 이내)에 고엔트로피 촉매 및 단일원자 촉매의 합성을 세계 최초로 구현한 기술이다. 광열효과가 뛰어난 소재(탄소 나노섬유, 그래핀 산화물, 맥신(Mxene))에 다종 금속 염을 고르게 섞어주고 빛을 가하게 되면 초고온 및 매우 빠른 승/하온 속도를 기반으로 최대 9성분계의 합금 촉매를 합성할 수 있음을 밝혔다. 합금 촉매는 연료전지, 리튬-황전지, 공기 전지, 물 분해 수소 생산 등 저장 및 발전에 광범위하게 적용되며, 비싼 백금의 사용량을 획기적으로 줄이는데 유리하다.
연구팀은 광열효과를 통해 단일원자 촉매의 신규 합성법에도 성공했다. 그래핀 산화물에 멜라민 및 금속염을 동시에 혼합하여 빛을 조사하게 되면 단일원자 촉매가 결합된 질소 도핑 그래핀을 합성할 수 있음을 최초로 밝혔다. 백금, 코발트, 니켈 등의 다양한 단일원자 촉매가 고밀도로 결착되어 다양한 촉매 응용 분야에 활용할 수 있다.
최성율 교수와 김일두 교수는 "강한 빛을 소재에 짧게(0.02초 이내) 조사하는 간편한 합성기법을 통해 단일 원소 촉매부터 다성분계 금속 나노입자 촉매의 초고속, 대면적 합성을 가능하게 하는 새로운 촉매 합성 공정 플랫폼이 될 것으로 기대된다ˮ고 밝혔다. 특히, "매우 빠른 승/하온 속도를 기반으로 기존에 합성하기 어려웠던 고엔트로피 다성분계 촉매 입자를 대기 중 조건에서 균일하게 합성해 고성능 물 분해 촉매로 응용했다는 점에서 매우 의미있는 연구 결과이며, 응용 분야에 따라 촉매 원소의 크기와 조성을 자유롭게 조절해 제작할 수 있는 신개념 광 기반 복합 촉매 소재 합성 플랫폼을 구축했다ˮ고 밝혔다.
고엔트로피 촉매 제조 관련 연구는 공동 제1 저자인 차준회 박사(KAIST 전기및전자공학부, 現 SK하이닉스 미래기술연구원), 조수호 박사(KAIST 신소재, 現 나노펩 선임연구원), 김동하 박사(KAIST 신소재, 현 MIT 박사후 연구원, 한양대학교 ERICA 재료화학공학과 교수 임용)의 주도하에 진행됐으며, 최성율 교수(KAIST 전기및전자공학부), 김일두 교수(KAIST 신소재), 정지원 교수(KAIST 신소재, 現 울산대학교 신소재 교수)가 교신저자로 참여했다.
단일원자 촉매 제조 관련 연구는 공동 제1 저자인 김동하 박사와 차준회 박사의 주도하에 진행됐으며, 김일두 교수, 최성율 교수가 교신저자로 참여했다.
이번 연구 결과는 나노 분야의 권위적인 학술지인 `어드밴스드 매트리얼즈(Advanced Materials)' 11월호에 속표지 논문으로 선정되었으며, `에이씨에스 나노(ACS Nano)' 12월호에 속표지 논문으로 출간 예정이다.
한편 연구는 한국연구재단 중견연구자지원 사업, 과학기술정보통신부와 산업통상자원부 사업, 한국연구재단 미래소재디스커버리 사업의 지원, 과학기술정보통신부 반도체-이차전지 인터페이싱(InterFacing) 플랫폼 기술개발사업을 받아 수행됐다.
2023.12.06 조회수 2933
강한 빛에서 0.02초 내에 새로운 촉매를 합성하다
대면적의 빛을 활용하고 대기 중의 환경에서 0.02초 이내에 연료전지 등 차세대 에너지 저장 및 발전에 광범위하게 적용되는 고엔트로피 촉매 및 단일원자 촉매의 합성을 세계 최초로 구현했다.
우리 대학 전기및전자공학부 최성율 교수 연구팀과 신소재공학과 김일두 교수 연구팀이 공동연구를 통해 강한 빛을 다양한 탄소 기반 소재에 조사해, 0.02초 이내에 나노입자 촉매와 단일원자(single atom) 촉매를 진공 시설이 없는 대기 조건에서 합성하고 우수한 촉매 성능을 구현하는데 성공했다고 6일 밝혔다.
연구팀은 2022년 4월 제논 램프 빛을 조사해 금속산화물의 상(phase) 변화와 표면에 촉매 입자가 생성될 수 있음을 최초로 밝혔고 그 후속으로 소재의 광열효과를 유도하는 합성법에 대한 연구를 진행했다. 이에 초고온(1,800~3,000oC)과 빠른 승/하온 속도(105 oC/초)를 통해 기존의 합성법으로는 구현할 수 없는 촉매 입자를 합성하는 데 성공했다.
이번 기술은 대면적의 빛을 활용하고 대기 중의 환경에서 매우 빠른 시간(0.02초 이내)에 고엔트로피 촉매 및 단일원자 촉매의 합성을 세계 최초로 구현한 기술이다. 광열효과가 뛰어난 소재(탄소 나노섬유, 그래핀 산화물, 맥신(Mxene))에 다종 금속 염을 고르게 섞어주고 빛을 가하게 되면 초고온 및 매우 빠른 승/하온 속도를 기반으로 최대 9성분계의 합금 촉매를 합성할 수 있음을 밝혔다. 합금 촉매는 연료전지, 리튬-황전지, 공기 전지, 물 분해 수소 생산 등 저장 및 발전에 광범위하게 적용되며, 비싼 백금의 사용량을 획기적으로 줄이는데 유리하다.
연구팀은 광열효과를 통해 단일원자 촉매의 신규 합성법에도 성공했다. 그래핀 산화물에 멜라민 및 금속염을 동시에 혼합하여 빛을 조사하게 되면 단일원자 촉매가 결합된 질소 도핑 그래핀을 합성할 수 있음을 최초로 밝혔다. 백금, 코발트, 니켈 등의 다양한 단일원자 촉매가 고밀도로 결착되어 다양한 촉매 응용 분야에 활용할 수 있다.
최성율 교수와 김일두 교수는 "강한 빛을 소재에 짧게(0.02초 이내) 조사하는 간편한 합성기법을 통해 단일 원소 촉매부터 다성분계 금속 나노입자 촉매의 초고속, 대면적 합성을 가능하게 하는 새로운 촉매 합성 공정 플랫폼이 될 것으로 기대된다ˮ고 밝혔다. 특히, "매우 빠른 승/하온 속도를 기반으로 기존에 합성하기 어려웠던 고엔트로피 다성분계 촉매 입자를 대기 중 조건에서 균일하게 합성해 고성능 물 분해 촉매로 응용했다는 점에서 매우 의미있는 연구 결과이며, 응용 분야에 따라 촉매 원소의 크기와 조성을 자유롭게 조절해 제작할 수 있는 신개념 광 기반 복합 촉매 소재 합성 플랫폼을 구축했다ˮ고 밝혔다.
고엔트로피 촉매 제조 관련 연구는 공동 제1 저자인 차준회 박사(KAIST 전기및전자공학부, 現 SK하이닉스 미래기술연구원), 조수호 박사(KAIST 신소재, 現 나노펩 선임연구원), 김동하 박사(KAIST 신소재, 현 MIT 박사후 연구원, 한양대학교 ERICA 재료화학공학과 교수 임용)의 주도하에 진행됐으며, 최성율 교수(KAIST 전기및전자공학부), 김일두 교수(KAIST 신소재), 정지원 교수(KAIST 신소재, 現 울산대학교 신소재 교수)가 교신저자로 참여했다.
단일원자 촉매 제조 관련 연구는 공동 제1 저자인 김동하 박사와 차준회 박사의 주도하에 진행됐으며, 김일두 교수, 최성율 교수가 교신저자로 참여했다.
이번 연구 결과는 나노 분야의 권위적인 학술지인 `어드밴스드 매트리얼즈(Advanced Materials)' 11월호에 속표지 논문으로 선정되었으며, `에이씨에스 나노(ACS Nano)' 12월호에 속표지 논문으로 출간 예정이다.
한편 연구는 한국연구재단 중견연구자지원 사업, 과학기술정보통신부와 산업통상자원부 사업, 한국연구재단 미래소재디스커버리 사업의 지원, 과학기술정보통신부 반도체-이차전지 인터페이싱(InterFacing) 플랫폼 기술개발사업을 받아 수행됐다.
2023.12.06 조회수 2933 -
 탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 2330
탄수화물 나노입자로 염증성 장 질환 치료하다
위장관에 발병하는 만성적인 염증성 장 질환은 아직 뚜렷한 원인이 밝혀지지 않아 비스테로이드성 항염증제들과 주사용 항체 치료제들을 이용한 치료법이 일반적이지만 면역약화 등의 부작용들로 인해 치료에 어려움이 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 장 내 당질층을 모사한 탄수화물 나노입자에 생체 내에서 항산화 및 항염증 작용을 하는 빌리루빈을 결합해 ‘항염증 탄수화물 나노입자(Anti-inflammatory Glycocalyx-mimicking nanoparticles)‘ 수십 종을 합성하고 이를 염증성 장 질환 치료에 적용함으로써 탁월한 효능을 보이는 의약을 개발했다고 2일 밝혔다.
세포막은 다양한 형태의 당 사슬 집합체인 당질층(glycocalyx)으로 둘러싸여 있다. 염증성 장 질환이 있는 사람의 장 조직에서는 정상인들과 다른 당질층이 형성되어 있다. 이러한 당질층은 우리 몸이나 음식에 많이 존재하는 탄수화물을 이루는 구성 성분인 여러 가지 당들에 대해 선택적인 결합력을 보인다. 이에 착안해 연구팀은 자연에 존재하는 탄수화물을 구성하는 대표적인 다섯 가지의 당들을 조합해 수 십가지의 인공 탄수화물(glycopolymers) 후보군들을 합성하여 염증성 장 질환 조직에 형성된 당질층에 잘 결합하는 인공 탄수화물 후보군을 선별하고자 하였다. 합성된 수 십가지의 인공 탄수화물에 우리 몸속에서 항산화 및 항염증 작용을 하는 빌리루빈 생리활성 물질을 결합하여 최종적으로 당질층을 표적할 수 있는 ‘항염증 탄수화물 나노입자(anti-inflammatory glyconanoparticles)’후보군들을 구축하였다.
연구팀은 구축된 항염증 탄수화물 나노입자 후보군들을 염증성 장 질환 생쥐모델에서 직접 경구투여를 통해 치료효능이 가장 우수한 탄수화물 나노입자를 선별할 수 있었다. 선별된 항염증 탄수화물 나노입자가 어떻게 치료효능 및 작용기전을 나타냈는지도 조사하였고 치료 효능이 기존에 사용하던 저분자 합성의약보다 더 우수한 효능을 가질 수 있음을 확인했다.
우리 대학 생명과학과 유도현 박사 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 정상급 학술지인 `앙게반테 케미(Angewandte Chemie International Edition, ISSN: 1433-7851 print, 1521-3773 online, Impact Factor: 16.823)' 6월 13일 字 온라인판에 게재됐다.
(https://doi.org/10.1002/anie.202304815 논문명: Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation).
전상용 교수는 “본 연구를 통해 당질층 표적형 항염증 탄수화물 나노입자 플랫폼 기술은 염증성 장 질환 외에도 다양한 염증 질환들의 치료에 적용될 수 있을 것으로 기대한다” 라고 말했다.
이 논문은 해당 학술지에서 선정한 특별 언론홍보 대상으로 선정돼 해외 과학 전문 보도 매체인 ‘ScienceDaily’ 와 ‘ChemistryViews’ 등에도 소개된 바 있다.(ScienceDaily: https://www.sciencedaily.com, ChemistryViews: https://www.chemistryviews.org)
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2023.08.02 조회수 2330 -
 나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 2165
나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 2165 -
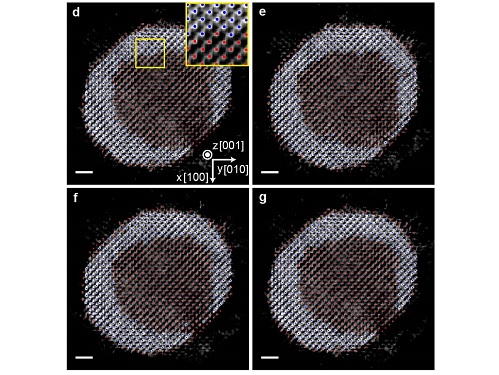 코어-쉘 나노입자의 원자 구조와 물성 규명 성공
우리 대학 물리학과 양용수 교수, 화학과 한상우 교수, 기계공학과 유승화 교수 공동연구팀이 한국기초과학지원연구원, 한국화학연구원과의 공동연구 및 미국 로런스 버클리 국립연구소(Lawrence Berkeley National Laboratory), 영국 버밍엄 대학교(University of Birmingham)와의 국제 협력 연구를 통해 팔라듐-백금 코어-쉘 구조 나노입자의 3차원 계면구조와 그 특성을 규명했다고 3일 밝혔다.
코어-쉘(core-shell) 구조 나노입자는 서로 다른 물질로 이루어진 코어(알맹이)와 쉘(껍데기)이 맞붙은 형태로 합성된 나노물질이다. 코어와 쉘 간의 경계면에서 코어를 이루는 물질과 쉘을 이루는 물질 간의 원자 간격 차이로 인해 원자 구조의 변형이 일어나며, 이 변형을 제어함으로써 나노입자의 광학적, 자기적, 촉매적 성질들을 변화시킬 수 있다.
특히 수소연료전지 제작에 필수적으로 사용되는 촉매에 값비싼 백금이 주로 사용되는데, 코어-쉘 구조를 최적화할 수 있다면 훨씬 적은 양의 백금을 이용해 더욱 높은 성능의 촉매를 제작 가능하다는 점 때문에 많은 연구자의 관심을 끌고 있다. 하지만 지금까지의 코어-쉘 나노입자의 계면 연구들은 대부분 2차원 분석이나 앙상블-평균(ensemble-averaged) 분석을 통해 이루어져 쉘 내부에 묻힌 3차원적인 코어-쉘 경계면의 구조와 그에 따른 특성을 정확히 파악하기 어려웠다는 한계가 있다.
연구팀은 자체 개발한 원자 분해능 전자토모그래피 기술을 이용해 팔라듐과 백금으로 이루어진 코어-쉘 구조 나노입자의 3차원 계면 원자 구조를 최초로 규명했다. 병원에서 인체 내부의 3차원적인 구조를 엑스레이 CT를 이용해 측정하는 것과 마찬가지로, 전자토모그래피는 투과전자현미경을 이용해 물질에 대한 초고분해능 CT를 촬영하는 기술이라고 볼 수 있다. 이는 다양한 각도에서 물질의 2차원적인 투과전자현미경 이미지들을 얻고, 이로부터 3차원적인 구조 정보를 재구성해내는 방식으로 작동한다. 연구팀은 전자토모그래피의 3차원 분해능을 끌어올려 물질 내부의 원자들을 하나하나 관찰 가능한 수준으로 재구성하고, 코어-쉘의 3차원 원자 구조를 약 24pm(피코미터)의 정밀도로 규명했다. 1pm(피코미터)는 1미터의 1조 분의 일에 해당하는 단위로, 24pm는 수소 원자 반지름의 약 1/2 정도에 해당하는 매우 높은 정밀도다.
얻어진 구조를 통해 연구팀은 나노입자 내부의 코어-쉘 경계면의 구조를 단일 원자 단위로 파악할 수 있었고, 계면구조로부터 파생되는 원자들의 변위와 구조 변형에 대한 단일 원자 수준의 3차원적인 지도를 작성해 정량적으로 해석했다. 이를 통해 팔라듐-백금의 코어-쉘 나노입자 표면에 분포하는 각각의 원자들의 촉매 활성도를 규명했으며, 적절한 변형이 가해질 경우 촉매 활성도를 크게 높일 수 있음을 밝혔다.
물리학과 조혜성 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 10월 10일 字 게재됐다. (논문명 : Direct strain correlations at the single-atom level in three-dimensional core-shell interface structures)
연구팀은 얻어진 3차원적 원자 변위와 구조 변형 지도에서 푸아송 효과(Poisson effect)로 알려진 탄성체 성질이 코어-쉘 나노입자 전체뿐만 아니라 단일 원자 수준에서도 일어난다는 것을 발견했다. 연구팀은 또한 이론적으로만 예측돼왔던 계면과 표면에서의 구조 변형도에 대한 상관성을 실험적으로 확인하고 이를 정량적으로 해석했다. 이러한 구조의 변형이 나노입자 전체에서 비슷하게 분포하는 것이 아니라 나노입자의 모양에 따라 위치별로 다르게 나타날 수 있음을 밝혔으며, 이러한 실험적인 발견은 분자 정역학(molecular statics) 시뮬레이션을 통해 이론적으로도 재확인됐다.
특히, 실험적으로 얻어진 3차원적인 원자 구조 정보는 양자역학적 계산을 통해 실제 물질의 물성과 직접적으로 연관될 수 있다는 점에서 그 의의가 크다. 이번 연구에서는 표면에서의 구조 변형도를 밀도범함수이론(density functional theory)의 양자역학적 계산 결과와 대응시킴으로써 표면에서의 촉매 활성도를 나타내는 표면의 산소 환원 반응(oxygen reduction reaction)을 각각의 표면 원자에 대해 계산했고, 이는 코어-쉘 구조와 촉매 특성 간의 관계를 단일 원자 수준에서 규명한 최초의 사례다.
연구를 주도한 양용수 교수는 "이번 연구는 그동안 2차원적인 분석, 또는 낮은 분해능에 국한되어 온 코어-쉘 구조 연구에서 벗어나 원자 하나하나까지 3차원적으로 들여다본다는 완전히 새로운 시각을 제시한다ˮ며 "이는 결과적으로 각각의 원자를 제어하는 사전적 설계를 통해 물질의 촉매 특성뿐만 아니라 구조와 연관된 모든 물성을 원하는 대로 최적화할 가능성을 보여준다ˮ라고 연구의 의의를 설명했다.
한편 이번 연구는 삼성미래기술육성재단 사업의 지원을 받아 수행됐다.
2022.11.03 조회수 5462
코어-쉘 나노입자의 원자 구조와 물성 규명 성공
우리 대학 물리학과 양용수 교수, 화학과 한상우 교수, 기계공학과 유승화 교수 공동연구팀이 한국기초과학지원연구원, 한국화학연구원과의 공동연구 및 미국 로런스 버클리 국립연구소(Lawrence Berkeley National Laboratory), 영국 버밍엄 대학교(University of Birmingham)와의 국제 협력 연구를 통해 팔라듐-백금 코어-쉘 구조 나노입자의 3차원 계면구조와 그 특성을 규명했다고 3일 밝혔다.
코어-쉘(core-shell) 구조 나노입자는 서로 다른 물질로 이루어진 코어(알맹이)와 쉘(껍데기)이 맞붙은 형태로 합성된 나노물질이다. 코어와 쉘 간의 경계면에서 코어를 이루는 물질과 쉘을 이루는 물질 간의 원자 간격 차이로 인해 원자 구조의 변형이 일어나며, 이 변형을 제어함으로써 나노입자의 광학적, 자기적, 촉매적 성질들을 변화시킬 수 있다.
특히 수소연료전지 제작에 필수적으로 사용되는 촉매에 값비싼 백금이 주로 사용되는데, 코어-쉘 구조를 최적화할 수 있다면 훨씬 적은 양의 백금을 이용해 더욱 높은 성능의 촉매를 제작 가능하다는 점 때문에 많은 연구자의 관심을 끌고 있다. 하지만 지금까지의 코어-쉘 나노입자의 계면 연구들은 대부분 2차원 분석이나 앙상블-평균(ensemble-averaged) 분석을 통해 이루어져 쉘 내부에 묻힌 3차원적인 코어-쉘 경계면의 구조와 그에 따른 특성을 정확히 파악하기 어려웠다는 한계가 있다.
연구팀은 자체 개발한 원자 분해능 전자토모그래피 기술을 이용해 팔라듐과 백금으로 이루어진 코어-쉘 구조 나노입자의 3차원 계면 원자 구조를 최초로 규명했다. 병원에서 인체 내부의 3차원적인 구조를 엑스레이 CT를 이용해 측정하는 것과 마찬가지로, 전자토모그래피는 투과전자현미경을 이용해 물질에 대한 초고분해능 CT를 촬영하는 기술이라고 볼 수 있다. 이는 다양한 각도에서 물질의 2차원적인 투과전자현미경 이미지들을 얻고, 이로부터 3차원적인 구조 정보를 재구성해내는 방식으로 작동한다. 연구팀은 전자토모그래피의 3차원 분해능을 끌어올려 물질 내부의 원자들을 하나하나 관찰 가능한 수준으로 재구성하고, 코어-쉘의 3차원 원자 구조를 약 24pm(피코미터)의 정밀도로 규명했다. 1pm(피코미터)는 1미터의 1조 분의 일에 해당하는 단위로, 24pm는 수소 원자 반지름의 약 1/2 정도에 해당하는 매우 높은 정밀도다.
얻어진 구조를 통해 연구팀은 나노입자 내부의 코어-쉘 경계면의 구조를 단일 원자 단위로 파악할 수 있었고, 계면구조로부터 파생되는 원자들의 변위와 구조 변형에 대한 단일 원자 수준의 3차원적인 지도를 작성해 정량적으로 해석했다. 이를 통해 팔라듐-백금의 코어-쉘 나노입자 표면에 분포하는 각각의 원자들의 촉매 활성도를 규명했으며, 적절한 변형이 가해질 경우 촉매 활성도를 크게 높일 수 있음을 밝혔다.
물리학과 조혜성 석박사통합과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 10월 10일 字 게재됐다. (논문명 : Direct strain correlations at the single-atom level in three-dimensional core-shell interface structures)
연구팀은 얻어진 3차원적 원자 변위와 구조 변형 지도에서 푸아송 효과(Poisson effect)로 알려진 탄성체 성질이 코어-쉘 나노입자 전체뿐만 아니라 단일 원자 수준에서도 일어난다는 것을 발견했다. 연구팀은 또한 이론적으로만 예측돼왔던 계면과 표면에서의 구조 변형도에 대한 상관성을 실험적으로 확인하고 이를 정량적으로 해석했다. 이러한 구조의 변형이 나노입자 전체에서 비슷하게 분포하는 것이 아니라 나노입자의 모양에 따라 위치별로 다르게 나타날 수 있음을 밝혔으며, 이러한 실험적인 발견은 분자 정역학(molecular statics) 시뮬레이션을 통해 이론적으로도 재확인됐다.
특히, 실험적으로 얻어진 3차원적인 원자 구조 정보는 양자역학적 계산을 통해 실제 물질의 물성과 직접적으로 연관될 수 있다는 점에서 그 의의가 크다. 이번 연구에서는 표면에서의 구조 변형도를 밀도범함수이론(density functional theory)의 양자역학적 계산 결과와 대응시킴으로써 표면에서의 촉매 활성도를 나타내는 표면의 산소 환원 반응(oxygen reduction reaction)을 각각의 표면 원자에 대해 계산했고, 이는 코어-쉘 구조와 촉매 특성 간의 관계를 단일 원자 수준에서 규명한 최초의 사례다.
연구를 주도한 양용수 교수는 "이번 연구는 그동안 2차원적인 분석, 또는 낮은 분해능에 국한되어 온 코어-쉘 구조 연구에서 벗어나 원자 하나하나까지 3차원적으로 들여다본다는 완전히 새로운 시각을 제시한다ˮ며 "이는 결과적으로 각각의 원자를 제어하는 사전적 설계를 통해 물질의 촉매 특성뿐만 아니라 구조와 연관된 모든 물성을 원하는 대로 최적화할 가능성을 보여준다ˮ라고 연구의 의의를 설명했다.
한편 이번 연구는 삼성미래기술육성재단 사업의 지원을 받아 수행됐다.
2022.11.03 조회수 5462 -
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 5615
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 5615 -
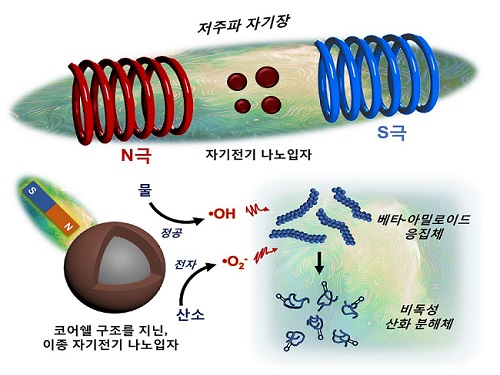 저주파 자기장 반응성 나노입자 개발해 알츠하이머 원인물질 분해 성공
우리 대학 신소재공학과 박찬범 교수 연구팀이 저주파 자기장 반응성 나노입자를 개발하는 데 성공했다고 16일 밝혔다. 연구팀은 이를 이용해 알츠하이머질환을 유발하는 베타-아밀로이드 펩타이드(아미노산 화합물) 응집체를 자기장으로 분해할 수 있다고 밝혔다.
신소재공학과 장진형 박사과정이 제1 저자로 참여한 이번 연구는 국제학술지 `사이언스 어드밴시스(Science Advances)' 5월 13일 字에 게재됐다. (논문명: Magnetoelectric dissociation of Alzheimer's β-amyloid aggregates)
자기 전기(Magnetoelectric) 소재는 자성과 전기성이 결합한 물성을 가지며 스핀트로닉스(Spintronics) 소자, 트랜스듀서(Transducer) 등 다양한 전자기기를 구성하는 핵심 물질이다. 그러나 자기 전기 소재는 원자 내 전자의 회전과 궤도 운동을 방해하는 양성자의 정전기적 상호작용(스핀-오빗 상호작용)으로 인해 성능 향상에 한계를 지닌다.
연구팀은 자기 전기 소재의 일종이며, 반도체 및 배터리 분야에 주로 쓰이는 코발트 페라이트(Cobalt ferrite)와 비스무스 페라이트(Bismuth ferrite)를 코어쉘(Core-shell) 구조로 접합시킴으로써 이종(Heterogeneous) 자기 전기 나노입자를 개발했다. 서로 다른 자기 전기 소재의 균일한 접합을 통해 이들의 경계면에서 저주파 자기장에 반응하는 자기-압전효과(Magneto-piezoelectric effect)를 일으킬 수 있었다.
특히, 나노입자가 저주파 자기장에 반응해 전하 운반체를 생성할 때 열을 방출하지 않는 현상에 연구팀은 주목했다. 자기장은 뇌 조직을 손상 없이 투과할 수 있으며 자기공명영상(MRI, Magnetic Resonance Imaging) 등에서 활용돼 의료적 안전성이 이미 검증된 바가 있다.
연구팀이 개발한 나노입자에 저주파 자기장을 쏘았을 때 베타-아밀로이드 펩타이드(Beta-amyloid peptide)를 산화시킴으로써 그 응집체의 결합력을 약화시켜 분해했고, 신경독성도 중화시킬 수 있음을 연구팀은 관찰했다.
아밀로이드 응집체는 알츠하이머병 등 다양한 퇴행성 신경질환들에서 공통적으로 관찰되며, 규칙적인 수소 결합을 통해 매우 안정적인 단백질 이차구조(Secondary structure)를 가져 분해가 어렵다고 알려져 왔다.
박찬범 교수는 "저주파 자기장 반응성 나노소재는 독성이 낮으며 자기장과 반응해 아밀로이드 응집체를 효율적으로 분해할 수 있기에 의료분야로 확장할 수 있는 잠재력이 있다ˮ면서, "이를 검증하기 위해 향후 알츠하이머 형질변환 마우스 등을 이용한 동물실험 등이 우선적으로 필요하다ˮ고 말했다.
한편 이번 연구는 한편 이번 연구는 과학기술정보통신부 리더연구자지원사업(창의연구)의 지원을 받아 수행됐다.
2022.05.16 조회수 4615
저주파 자기장 반응성 나노입자 개발해 알츠하이머 원인물질 분해 성공
우리 대학 신소재공학과 박찬범 교수 연구팀이 저주파 자기장 반응성 나노입자를 개발하는 데 성공했다고 16일 밝혔다. 연구팀은 이를 이용해 알츠하이머질환을 유발하는 베타-아밀로이드 펩타이드(아미노산 화합물) 응집체를 자기장으로 분해할 수 있다고 밝혔다.
신소재공학과 장진형 박사과정이 제1 저자로 참여한 이번 연구는 국제학술지 `사이언스 어드밴시스(Science Advances)' 5월 13일 字에 게재됐다. (논문명: Magnetoelectric dissociation of Alzheimer's β-amyloid aggregates)
자기 전기(Magnetoelectric) 소재는 자성과 전기성이 결합한 물성을 가지며 스핀트로닉스(Spintronics) 소자, 트랜스듀서(Transducer) 등 다양한 전자기기를 구성하는 핵심 물질이다. 그러나 자기 전기 소재는 원자 내 전자의 회전과 궤도 운동을 방해하는 양성자의 정전기적 상호작용(스핀-오빗 상호작용)으로 인해 성능 향상에 한계를 지닌다.
연구팀은 자기 전기 소재의 일종이며, 반도체 및 배터리 분야에 주로 쓰이는 코발트 페라이트(Cobalt ferrite)와 비스무스 페라이트(Bismuth ferrite)를 코어쉘(Core-shell) 구조로 접합시킴으로써 이종(Heterogeneous) 자기 전기 나노입자를 개발했다. 서로 다른 자기 전기 소재의 균일한 접합을 통해 이들의 경계면에서 저주파 자기장에 반응하는 자기-압전효과(Magneto-piezoelectric effect)를 일으킬 수 있었다.
특히, 나노입자가 저주파 자기장에 반응해 전하 운반체를 생성할 때 열을 방출하지 않는 현상에 연구팀은 주목했다. 자기장은 뇌 조직을 손상 없이 투과할 수 있으며 자기공명영상(MRI, Magnetic Resonance Imaging) 등에서 활용돼 의료적 안전성이 이미 검증된 바가 있다.
연구팀이 개발한 나노입자에 저주파 자기장을 쏘았을 때 베타-아밀로이드 펩타이드(Beta-amyloid peptide)를 산화시킴으로써 그 응집체의 결합력을 약화시켜 분해했고, 신경독성도 중화시킬 수 있음을 연구팀은 관찰했다.
아밀로이드 응집체는 알츠하이머병 등 다양한 퇴행성 신경질환들에서 공통적으로 관찰되며, 규칙적인 수소 결합을 통해 매우 안정적인 단백질 이차구조(Secondary structure)를 가져 분해가 어렵다고 알려져 왔다.
박찬범 교수는 "저주파 자기장 반응성 나노소재는 독성이 낮으며 자기장과 반응해 아밀로이드 응집체를 효율적으로 분해할 수 있기에 의료분야로 확장할 수 있는 잠재력이 있다ˮ면서, "이를 검증하기 위해 향후 알츠하이머 형질변환 마우스 등을 이용한 동물실험 등이 우선적으로 필요하다ˮ고 말했다.
한편 이번 연구는 한편 이번 연구는 과학기술정보통신부 리더연구자지원사업(창의연구)의 지원을 받아 수행됐다.
2022.05.16 조회수 4615 -
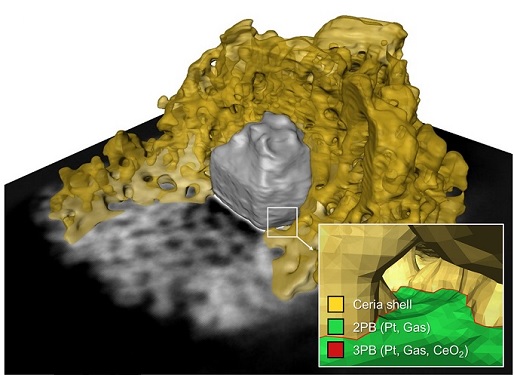 촉매 반응 활성도의 정량적 분석이 가능한 측정 플랫폼 개발
우리 대학 신소재공학과 정우철 교수, 기계공학과 이강택 교수와 충남대학교 김현유 교수 공동 연구팀이 촉매 반응점 탐색 및 각 지점의 활성을 정량적으로 측정할 수 있는 금속 나노입자 기반 분석 플랫폼 개발에 성공했다고 28일 밝혔다.
촉매란 반응 과정에서 소모되거나 변하지 않으면서 반응 속도를 빠르게 만드는 물질을 말하며, 반응에 참여하지만 소모되지 않기 때문에 소량만 있어도 반응 속도에 지속적으로 영향을 미칠 수 있는 물질이다. 반응을 빠르게 하는 촉매 반응은 더 적은 활성화 에너지를 필요로 하기 때문에 다양한 산업에 활용되고 있다. 백금 등을 이용해 화석 연료의 연소로 인해 발생하는 배기가스의 해로운 부산물을 분해하는 반응을 예로 들 수 있다.
연구팀은 균일한 크기의 금속 나노입자 합성 기술과 3차원 전자 단층촬영 기법을 활용해 촉매 핵심 반응점인 금속-가스-산화물 및 금속-가스상 접합 계면의 수를 정량적으로 분석했으며, 이 같은 결과를 측정된 촉매 반응성과 연계시키는 방식으로 촉매 반응 활성도의 정량적 분석이 가능한 측정 플랫폼을 설계했다. 이러한 기술은 특정 반응에 활용이 제한되지 않기 때문에 향후 여러 촉매 반응 분야에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
신소재공학과 이시원, 하현우 박사후연구원, 기계공학과 배경택 박사과정생 공동 제1 저자로 참여한 이번 연구는 재료화학분야 국제 학술지 `켐(Chem, IF=22.804)'에 12월 23일 자 온라인판에 게재됐다. (논문명 : A measure of active interfaces in supported catalysts for high-temperature reactions).
금속 나노입자 촉매는 매우 적은 양으로 우수한 촉매 활성을 보일 수 있다는 가능성으로 에너지·환경 등 여러 분야에서 큰 관심을 받고 있다.
하지만 나노입자로 구성된 촉매 소재는 높은 작동온도에서 서로 응집되는 특성이 있으며 이는 결과적으로 촉매 활성을 저해하는 한계로 작용한다. 그뿐만 아니라, 실제 반응 작동 환경에서 금속 입자 촉매의 구체적인 반응 활성 지점이 어디인지, 각 지점에서의 반응활성도는 얼마나 되는지 그 양을 정량적으로 비교·분석할 수 있는 기술이 없어 해당 분야 발전에 한계가 있었다.
연구팀은 문제 해결을 위해 균일한 크기로 금속 나노입자 촉매를 합성해 입자의 구조를 제어하는 데 성공했으며, 이를 산화물 막으로 감싸는 코팅기술을 적용해 고온에서 나노입자가 응집되는 현상을 해결했다. 여기에 3차원 전자 단층촬영 기법, 스케일링 관계식, 그리고 밀도범 함수 이론을 적용하고 이를 다양한 조건에서 측정한 반응성과 연계시킴으로써 구체적인 반응 지점 및 활성을 규명했다.
연구팀은 이번 연구에서 대표적 귀금속 촉매인 백금과 고온 촉매 반응인 메탄산화반응을 활용했으나, 이번 기술은 향후 소재 종류 및 반응 종류에 상관없이 다양한 분야에 폭넓게 응용 및 적용될 수 있다.
정우철 교수는 "이번 연구를 통해서 주어진 반응에 대한 금속 나노입자 촉매의 반응 특성을 정량적으로 분석할 수 있는 고신뢰성 측정 플랫폼을 구축했다ˮ며, "이는 앞으로 우수한 복합촉매 소재 선별 등 촉매설계 종합 솔루션을 제공하는 데 활용될 것으로 기대한다ˮ 라고 말했다.
우리 대학 물리학과 양용수 교수, GIST 김봉수 교수 연구팀에서도 공동으로 참여한 이번 연구는 한국연구재단 나노·소재원천기술개발사업의 지원을 받아 수행됐다.
2021.12.28 조회수 6268
촉매 반응 활성도의 정량적 분석이 가능한 측정 플랫폼 개발
우리 대학 신소재공학과 정우철 교수, 기계공학과 이강택 교수와 충남대학교 김현유 교수 공동 연구팀이 촉매 반응점 탐색 및 각 지점의 활성을 정량적으로 측정할 수 있는 금속 나노입자 기반 분석 플랫폼 개발에 성공했다고 28일 밝혔다.
촉매란 반응 과정에서 소모되거나 변하지 않으면서 반응 속도를 빠르게 만드는 물질을 말하며, 반응에 참여하지만 소모되지 않기 때문에 소량만 있어도 반응 속도에 지속적으로 영향을 미칠 수 있는 물질이다. 반응을 빠르게 하는 촉매 반응은 더 적은 활성화 에너지를 필요로 하기 때문에 다양한 산업에 활용되고 있다. 백금 등을 이용해 화석 연료의 연소로 인해 발생하는 배기가스의 해로운 부산물을 분해하는 반응을 예로 들 수 있다.
연구팀은 균일한 크기의 금속 나노입자 합성 기술과 3차원 전자 단층촬영 기법을 활용해 촉매 핵심 반응점인 금속-가스-산화물 및 금속-가스상 접합 계면의 수를 정량적으로 분석했으며, 이 같은 결과를 측정된 촉매 반응성과 연계시키는 방식으로 촉매 반응 활성도의 정량적 분석이 가능한 측정 플랫폼을 설계했다. 이러한 기술은 특정 반응에 활용이 제한되지 않기 때문에 향후 여러 촉매 반응 분야에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
신소재공학과 이시원, 하현우 박사후연구원, 기계공학과 배경택 박사과정생 공동 제1 저자로 참여한 이번 연구는 재료화학분야 국제 학술지 `켐(Chem, IF=22.804)'에 12월 23일 자 온라인판에 게재됐다. (논문명 : A measure of active interfaces in supported catalysts for high-temperature reactions).
금속 나노입자 촉매는 매우 적은 양으로 우수한 촉매 활성을 보일 수 있다는 가능성으로 에너지·환경 등 여러 분야에서 큰 관심을 받고 있다.
하지만 나노입자로 구성된 촉매 소재는 높은 작동온도에서 서로 응집되는 특성이 있으며 이는 결과적으로 촉매 활성을 저해하는 한계로 작용한다. 그뿐만 아니라, 실제 반응 작동 환경에서 금속 입자 촉매의 구체적인 반응 활성 지점이 어디인지, 각 지점에서의 반응활성도는 얼마나 되는지 그 양을 정량적으로 비교·분석할 수 있는 기술이 없어 해당 분야 발전에 한계가 있었다.
연구팀은 문제 해결을 위해 균일한 크기로 금속 나노입자 촉매를 합성해 입자의 구조를 제어하는 데 성공했으며, 이를 산화물 막으로 감싸는 코팅기술을 적용해 고온에서 나노입자가 응집되는 현상을 해결했다. 여기에 3차원 전자 단층촬영 기법, 스케일링 관계식, 그리고 밀도범 함수 이론을 적용하고 이를 다양한 조건에서 측정한 반응성과 연계시킴으로써 구체적인 반응 지점 및 활성을 규명했다.
연구팀은 이번 연구에서 대표적 귀금속 촉매인 백금과 고온 촉매 반응인 메탄산화반응을 활용했으나, 이번 기술은 향후 소재 종류 및 반응 종류에 상관없이 다양한 분야에 폭넓게 응용 및 적용될 수 있다.
정우철 교수는 "이번 연구를 통해서 주어진 반응에 대한 금속 나노입자 촉매의 반응 특성을 정량적으로 분석할 수 있는 고신뢰성 측정 플랫폼을 구축했다ˮ며, "이는 앞으로 우수한 복합촉매 소재 선별 등 촉매설계 종합 솔루션을 제공하는 데 활용될 것으로 기대한다ˮ 라고 말했다.
우리 대학 물리학과 양용수 교수, GIST 김봉수 교수 연구팀에서도 공동으로 참여한 이번 연구는 한국연구재단 나노·소재원천기술개발사업의 지원을 받아 수행됐다.
2021.12.28 조회수 6268 -
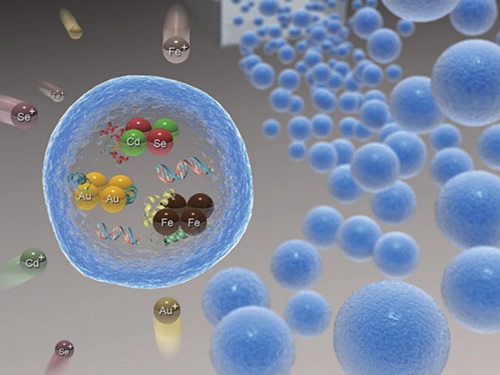 위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 9725
위치 영상화가 가능한 약물 전달체 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 중앙대 화학과 박태정 교수, 가천대 바이오나노학과 김문일 교수와의 공동 연구를 통해 중금속 흡착 단백질을 이용한 금속 나노입자 고효율 생합성 기술을 개발하고, 이를 이용해 위치 영상화가 가능한 약물 전달체를 개발했다고 7일 밝혔다.
우리 대학 생명화학공학과 졸업생 김문일 박사(現 가천대 교수), 중앙대 박찬영 박사가 공동 제1 저자로 참여한 이번 연구는 미국화학회가 발행하는 국제 학술지 ‘ACS 어플라이드 머터리얼즈 앤 인터페이시스(Applied Materials and Interfaces)’ 2021년도 13호 표지 논문으로 선정됐다. (논문명: In situ biosynthesis of a metal nanoparticle encapsulated in alginate gel for imageable drug-delivery system)
현재 금속 나노입자의 합성에 주로 사용되고 있는 물리화학적 방법은 독성이 있는 환원제, 계면활성제 및 유기 용매의 이용이 필요해 약물전달체 등 생체 내에 사용하기 어려운 단점을 가지고 있다. 이를 극복하기 위해 환원력이 우수한 단백질을 미생물 내에 과발현해 금속 나노입자를 생합성하는 기술이 개발됐으나, 이 방법은 미생물이 받아들일 수 있는 금속 전구체의 종류 및 농도가 제한된다는 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 대장균에 중금속 흡착 단백질을 발현하는 플라스미드를 형질 전환해 단백질을 과발현한 후 이를 알지네이트 젤에 포집해 그 활성을 안정화하는 기술을 개발했다. 중금속 흡착 단백질을 포집한 알지네이트 젤은 다양한 종류의 금속 이온을 30분 이내로 빠르게 고농도로 흡착 및 환원시켜 금, 은, 자성 및 양자점 나노입자 등 다양한 종류의 금속 나노입자를 알지네이트 젤 내부에 고농도로 생합성하는 데 효과적으로 활용됐다.
특히, 연구팀은 항암제 등 약물과 중금속 흡착 단백질을 알지네이트 젤에 동시에 포집한 후 높은 형광을 나타내는 양자점 나노입자를 젤 내부에 합성함으로써 형광을 통해 위치의 추적 및 영상화가 가능하고 약물의 서방형 방출이 가능한 다기능 약물 전달체를 개발하는 데 성공했다.
☞ 서방형(sustained release): 약물 등이 장시간에 걸쳐 서서히 방출되는 형태
연구팀은 항암제와 녹색 형광을 보이는 카드뮴 셀레나이드 (CdSe) 및 파란색 형광을 보이는 유로피움 셀레나이드 (EuSe)로 이루어진 양자점을 동시에 포집한 약물 전달체를 마우스에 경구로 주입한 후, 이 약물 전달체의 위치를 생체 내에서 추적 및 영상화할 수 있음을 확인했다.
박현규 교수는 “이번 연구에서 개발된 중금속 흡착 단백질을 포집한 알지네이트 젤은 독성 물질 없이, 고속·고농도로 다양한 금속 나노입자를 생합성할 수 있고 동시에 약물의 서방형 방출이 가능하기 때문에, 향후 위치 추적이 가능한 약물 전달체 등에 응용될 수 있다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업의 일환으로 수행됐다.
2021.09.07 조회수 9725 -
 원자 단층 촬영 기술로 나노입자 표면 리간드 분자의 3차원 분포 규명
우리 대학 신소재공학과 최벽파 교수 연구팀이 이화여자대학교 화학신소재공학과 이상헌 교수 연구팀과 공동연구를 통해 원자 단층 촬영 기술을 활용해 나노입자 표면에 존재하는 리간드 분자의 3차원 분포를 최초로 규명했다고 9일 밝혔다.
리간드(Capping ligand)는 금속 나노입자 합성 시 발생하는 유기 분자로서, 입자 간 응집을 방지할 뿐만 아니라 입자의 형태와 각종 특성까지 조절한다는 사실이 밝혀지며 나노입자의 합성 및 설계에 있어 그 중요성이 점점 더 커지고 있다.
신소재공학과 장규선 박사과정과 독일 막스 플랑크 연구소 김세호 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 커뮤니케이션즈(Nature Communications, IF: 14.919)' 7월 14일 字 온라인판에 게재됐다. (논문명: Three-dimensional atomic mapping of ligands on palladium nanoparticles by atom probe tomography)
복잡한 구조의 유기 분자로 이루어진 리간드의 공간적 분포를 분석하기 위해서는 원자단위의 공간 분해능과 경량 원소에 대한 높은 검출 민감도를 가지며 3차원 분석이 가능한 기술이 필요하다. 이러한 분석 기술의 부재로 인해 현재까지 나노입자 표면에 존재하는 리간드 분포를 3차원에서 관찰한 사례는 존재하지 않으며, 이로 인해 입자 합성과정에서 리간드의 거동은 상당 부분 미지의 영역으로 남아있다. 예를 들어, 할라이드 리간드인 브롬(Br) 이온의 경우 정육면체 형태의 금속 나노입자 형성을 촉진하는 것으로 알려져 있으나, 여러 논문에서 이와 다른 결과를 보고하고 있다.
최벽파 교수 연구팀은 원자 단층 촬영 현미경(Atom probe tomography)을 활용해 서로 다른 할라이드 리간드를 통해 합성된 두 종류의 팔라듐 나노입자 표면에 존재하는 세트리모늄 리간드(Cetrimonium chloride)의 3차원 분포를 원자단위에서 관찰하는 데 성공했다.
원자 단층 촬영 현미경은 아주 얇은 바늘 모양으로 가공된 시편 표면의 원자들을 고전압 또는 고에너지 펄스를 가해 차례차례 증발시켜 검출기에 충돌시키고, 검출기에 기록된 원자의 충돌 위치와 충돌 순서, 그리고 충돌 원자의 질량 대 전하 비를 이용해 시편의 3차원 원자 분포를 재구성하는 분석 기술이다.
이러한 원자 단층 촬영 기술은 3차원 원자단위 분석 및 화학적 정량 분석이 가능할 뿐 아니라, 옹스트롬(100억 분의 1미터) 단위의 공간 분해능과 모든 원소에 대해 동일한 ppm 단위의 우수한 검출 감도를 갖고 있어 최근 재료 분석 분야에서 큰 주목을 받고 있다.
연구팀은 리간드의 3차원 분포에 대한 단층 촬영 데이터로부터 각각의 나노입자 표면에 존재하는 세트리모늄 리간드의 밀도를 계산했다. 이를 통해 연구진은 세트리모늄 리간드와 할라이드 리간드 사이에 기존에 알려지지 않았던 상호작용이 존재하며, 이러한 서로 다른 리간드 사이의 상호작용이 나노입자의 최종 형태와 산화 저항 특성을 결정할 뿐 아니라 기존의 연구 결과들이 합치되지 않았던 원인이었음을 규명했다.
최벽파 교수는 "이번 연구는 기존에 상반됐던 연구 결과들을 모두 포용할 수 있는 실험적, 이론적 결과를 제시했다는 점에서 의의가 있다ˮ며, "해당 연구를 통해 얻은 결과는 나노입자 합성에 대한 근본적인 이해를 높이고, 우수한 특성을 가진 나노입자를 설계하는데 응용될 수 있으리라 기대한다ˮ고 밝혔다.
한편 이번 연구는 한국연구재단 과학기술분야 기초연구사업인 중견연구자지원사업의 지원을 통해 수행됐다.
2021.08.10 조회수 8317
원자 단층 촬영 기술로 나노입자 표면 리간드 분자의 3차원 분포 규명
우리 대학 신소재공학과 최벽파 교수 연구팀이 이화여자대학교 화학신소재공학과 이상헌 교수 연구팀과 공동연구를 통해 원자 단층 촬영 기술을 활용해 나노입자 표면에 존재하는 리간드 분자의 3차원 분포를 최초로 규명했다고 9일 밝혔다.
리간드(Capping ligand)는 금속 나노입자 합성 시 발생하는 유기 분자로서, 입자 간 응집을 방지할 뿐만 아니라 입자의 형태와 각종 특성까지 조절한다는 사실이 밝혀지며 나노입자의 합성 및 설계에 있어 그 중요성이 점점 더 커지고 있다.
신소재공학과 장규선 박사과정과 독일 막스 플랑크 연구소 김세호 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 커뮤니케이션즈(Nature Communications, IF: 14.919)' 7월 14일 字 온라인판에 게재됐다. (논문명: Three-dimensional atomic mapping of ligands on palladium nanoparticles by atom probe tomography)
복잡한 구조의 유기 분자로 이루어진 리간드의 공간적 분포를 분석하기 위해서는 원자단위의 공간 분해능과 경량 원소에 대한 높은 검출 민감도를 가지며 3차원 분석이 가능한 기술이 필요하다. 이러한 분석 기술의 부재로 인해 현재까지 나노입자 표면에 존재하는 리간드 분포를 3차원에서 관찰한 사례는 존재하지 않으며, 이로 인해 입자 합성과정에서 리간드의 거동은 상당 부분 미지의 영역으로 남아있다. 예를 들어, 할라이드 리간드인 브롬(Br) 이온의 경우 정육면체 형태의 금속 나노입자 형성을 촉진하는 것으로 알려져 있으나, 여러 논문에서 이와 다른 결과를 보고하고 있다.
최벽파 교수 연구팀은 원자 단층 촬영 현미경(Atom probe tomography)을 활용해 서로 다른 할라이드 리간드를 통해 합성된 두 종류의 팔라듐 나노입자 표면에 존재하는 세트리모늄 리간드(Cetrimonium chloride)의 3차원 분포를 원자단위에서 관찰하는 데 성공했다.
원자 단층 촬영 현미경은 아주 얇은 바늘 모양으로 가공된 시편 표면의 원자들을 고전압 또는 고에너지 펄스를 가해 차례차례 증발시켜 검출기에 충돌시키고, 검출기에 기록된 원자의 충돌 위치와 충돌 순서, 그리고 충돌 원자의 질량 대 전하 비를 이용해 시편의 3차원 원자 분포를 재구성하는 분석 기술이다.
이러한 원자 단층 촬영 기술은 3차원 원자단위 분석 및 화학적 정량 분석이 가능할 뿐 아니라, 옹스트롬(100억 분의 1미터) 단위의 공간 분해능과 모든 원소에 대해 동일한 ppm 단위의 우수한 검출 감도를 갖고 있어 최근 재료 분석 분야에서 큰 주목을 받고 있다.
연구팀은 리간드의 3차원 분포에 대한 단층 촬영 데이터로부터 각각의 나노입자 표면에 존재하는 세트리모늄 리간드의 밀도를 계산했다. 이를 통해 연구진은 세트리모늄 리간드와 할라이드 리간드 사이에 기존에 알려지지 않았던 상호작용이 존재하며, 이러한 서로 다른 리간드 사이의 상호작용이 나노입자의 최종 형태와 산화 저항 특성을 결정할 뿐 아니라 기존의 연구 결과들이 합치되지 않았던 원인이었음을 규명했다.
최벽파 교수는 "이번 연구는 기존에 상반됐던 연구 결과들을 모두 포용할 수 있는 실험적, 이론적 결과를 제시했다는 점에서 의의가 있다ˮ며, "해당 연구를 통해 얻은 결과는 나노입자 합성에 대한 근본적인 이해를 높이고, 우수한 특성을 가진 나노입자를 설계하는데 응용될 수 있으리라 기대한다ˮ고 밝혔다.
한편 이번 연구는 한국연구재단 과학기술분야 기초연구사업인 중견연구자지원사업의 지원을 통해 수행됐다.
2021.08.10 조회수 8317 -
 신경신호 모사를 통한 인공 감각 시스템 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 고려대학교 천성우 교수, 한양대학교 김종석 박사 공동 연구팀과 함께 인간 피부-신경 모사형 인공 감각 인터페이스 시스템을 개발했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 2021년 6월 3일 字로 출판됐다. (논문명: Artificial Neural Tactile Sensing System)
가상/증강 현실, 메타버스, 화상 환자를 위한 인공피부, 로봇형 의수/의족 등에 사용될 수 있는 인공 감각 시스템은, 구현해야 할 원리와 그 시스템의 복잡성 때문에 실제 감각기관처럼 만들기 어려운 상황이었다. 특히 사람은 다양한 유형의 촉각 수용기를 통해 (압력, 진동 등) 정보를 조합하여 촉각을 감지하므로, 완벽한 인공 감각 시스템의 구현은 더욱 어려울 수 밖에 없다.
연구팀은 문제 해결을 위해 나노입자 기반의 복합 촉각 센서를 제작하고, 이를 실제 신경 패턴에 기반한 신호 변환 시스템과 연결하는 방법을 사용하였다. 이 두 가지 기술의 조합을 통해 연구팀은 인간의 촉각 인식 프로세스를 최대로 모방하는 인공 감각 인터페이스 시스템을 구현하는데 성공했다.
연구팀은 우선 압전재료 및 압전 저항성 재료의 조합으로 이루어진 전자 피부를 제작했다. 이 센서는 나노입자의 적절한 조합을 통해 피부 내의 압력을 감지하는 늦은 순응 기계적 수용기(SA mechanoreceptor)와 진동을 감지하는 빠른 순응 기계적 수용기(FA mechanoreceptor)를 동시에 모사할 수 있다는 특징을 가지고 있다. 해당 센서를 통해 생성된 전위는, 연구팀이 제작한 회로 시스템을 통해 실제 감각 신호와 같은 형태의 패턴으로 변환된다. 이때 생체 내 상황을 최대한 모사하기 위해, 실제 감각신경을 추출, 다양한 감각에 의한 신호를 측정하여 함수화하는 방법이 사용됐다.
해당 시스템을 동물 모델에 적용한 결과, 연구팀은 인공 감각 시스템에서 발생한 신호가 생체 내에서 왜곡 없이 전달되며, 근육 반사 작용 등 생체 감각 관련 현상들을 구현할 수 있음을 확인했다. 또한 연구팀은 지문 구조로 만든 감각 시스템을 20여 종의 직물과 접촉함으로써, 딥 러닝 기법을 통해 직물의 질감을 99% 이상 분류할 수 있을 뿐만 아니라 학습된 신호를 기반으로 인간과 동일하게 예측할 수 있음을 보여줬다.
박성준 교수는 "이번 연구는 실제 신경 신호의 패턴 학습을 바탕으로 한 인간 모사형 감각 시스템을 세계 최초로 구현했다는 데 의의가 있다. 해당 연구를 통해 향후 더욱 현실적인 감각 구현이 가능할 뿐만 아니라, 연구에 사용된 생체신호 모사 기법이 인체 내 다양한 종류의 타 감각 시스템과 결합될 경우 더욱 큰 시너지를 낼 수 있으리라 기대한다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, KAIST 글로벌 이니셔티브 프로그램, Post-AI 프로젝트 사업의 지원을 받아 수행됐다.
2021.07.12 조회수 8872
신경신호 모사를 통한 인공 감각 시스템 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 고려대학교 천성우 교수, 한양대학교 김종석 박사 공동 연구팀과 함께 인간 피부-신경 모사형 인공 감각 인터페이스 시스템을 개발했다고 12일 밝혔다.
이번 연구 결과는 국제 학술지 `네이처 일렉트로닉스(Nature Electronics)'에 2021년 6월 3일 字로 출판됐다. (논문명: Artificial Neural Tactile Sensing System)
가상/증강 현실, 메타버스, 화상 환자를 위한 인공피부, 로봇형 의수/의족 등에 사용될 수 있는 인공 감각 시스템은, 구현해야 할 원리와 그 시스템의 복잡성 때문에 실제 감각기관처럼 만들기 어려운 상황이었다. 특히 사람은 다양한 유형의 촉각 수용기를 통해 (압력, 진동 등) 정보를 조합하여 촉각을 감지하므로, 완벽한 인공 감각 시스템의 구현은 더욱 어려울 수 밖에 없다.
연구팀은 문제 해결을 위해 나노입자 기반의 복합 촉각 센서를 제작하고, 이를 실제 신경 패턴에 기반한 신호 변환 시스템과 연결하는 방법을 사용하였다. 이 두 가지 기술의 조합을 통해 연구팀은 인간의 촉각 인식 프로세스를 최대로 모방하는 인공 감각 인터페이스 시스템을 구현하는데 성공했다.
연구팀은 우선 압전재료 및 압전 저항성 재료의 조합으로 이루어진 전자 피부를 제작했다. 이 센서는 나노입자의 적절한 조합을 통해 피부 내의 압력을 감지하는 늦은 순응 기계적 수용기(SA mechanoreceptor)와 진동을 감지하는 빠른 순응 기계적 수용기(FA mechanoreceptor)를 동시에 모사할 수 있다는 특징을 가지고 있다. 해당 센서를 통해 생성된 전위는, 연구팀이 제작한 회로 시스템을 통해 실제 감각 신호와 같은 형태의 패턴으로 변환된다. 이때 생체 내 상황을 최대한 모사하기 위해, 실제 감각신경을 추출, 다양한 감각에 의한 신호를 측정하여 함수화하는 방법이 사용됐다.
해당 시스템을 동물 모델에 적용한 결과, 연구팀은 인공 감각 시스템에서 발생한 신호가 생체 내에서 왜곡 없이 전달되며, 근육 반사 작용 등 생체 감각 관련 현상들을 구현할 수 있음을 확인했다. 또한 연구팀은 지문 구조로 만든 감각 시스템을 20여 종의 직물과 접촉함으로써, 딥 러닝 기법을 통해 직물의 질감을 99% 이상 분류할 수 있을 뿐만 아니라 학습된 신호를 기반으로 인간과 동일하게 예측할 수 있음을 보여줬다.
박성준 교수는 "이번 연구는 실제 신경 신호의 패턴 학습을 바탕으로 한 인간 모사형 감각 시스템을 세계 최초로 구현했다는 데 의의가 있다. 해당 연구를 통해 향후 더욱 현실적인 감각 구현이 가능할 뿐만 아니라, 연구에 사용된 생체신호 모사 기법이 인체 내 다양한 종류의 타 감각 시스템과 결합될 경우 더욱 큰 시너지를 낼 수 있으리라 기대한다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, KAIST 글로벌 이니셔티브 프로그램, Post-AI 프로젝트 사업의 지원을 받아 수행됐다.
2021.07.12 조회수 8872