-
 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06
조회수 1075
-
 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16
조회수 1802
-
 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24
조회수 2341
-
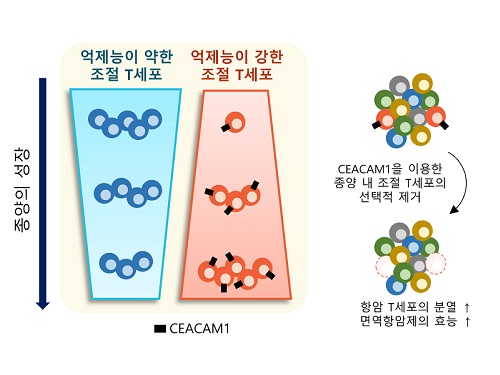 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06
조회수 3163
-
 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04
조회수 4690
-
 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26
조회수 4449
-
 의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16
조회수 75411
-
 난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10
조회수 39494
-
 이행기, 이정호 교수, 2019 국가연구개발 우수성과 100선 선정
〈 이행기 교수, 이정호 교수 〉
과학기술정보통신부와 한국과학기술기획평가원이 발표한 ´2019년 국가연구개발 우수성과 100선´에 우리 대학 이행기 교수, 이정호 교수가 선정됐다.
건설및환경공학과 이행기 교수는 기계·소재분야 우수성과에 선정됐다. 이 교수는 나노 및 바이오 기술을 융합한 차세대 건설재료를 개발한 연구 성과를 인정받았다.
의과학대학원 이정호 교수는 생명·해양 분야 우수성과에 선정됐다. 악성 뇌종양, 소아 뇌종양의 근본 원인을 규명하고 혁신적인 치료법을 개발한 공을 인정받았다.
우수성과로 선정된 성과는 과학기술정보통신부장관의 인증서와 현판이 수여된다.
선정된 교수에게는 국가연구개발 성과평가 유공포상(훈·포장, 대통령표창, 국무총리표창 등) 후보자로 추천되고, 신규 연구개발(R&D) 과제 선정에서 우대받게 된다.
이행기, 이정호 교수, 2019 국가연구개발 우수성과 100선 선정
〈 이행기 교수, 이정호 교수 〉
과학기술정보통신부와 한국과학기술기획평가원이 발표한 ´2019년 국가연구개발 우수성과 100선´에 우리 대학 이행기 교수, 이정호 교수가 선정됐다.
건설및환경공학과 이행기 교수는 기계·소재분야 우수성과에 선정됐다. 이 교수는 나노 및 바이오 기술을 융합한 차세대 건설재료를 개발한 연구 성과를 인정받았다.
의과학대학원 이정호 교수는 생명·해양 분야 우수성과에 선정됐다. 악성 뇌종양, 소아 뇌종양의 근본 원인을 규명하고 혁신적인 치료법을 개발한 공을 인정받았다.
우수성과로 선정된 성과는 과학기술정보통신부장관의 인증서와 현판이 수여된다.
선정된 교수에게는 국가연구개발 성과평가 유공포상(훈·포장, 대통령표창, 국무총리표창 등) 후보자로 추천되고, 신규 연구개발(R&D) 과제 선정에서 우대받게 된다.
2019.10.11
조회수 11004
-
 전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28
조회수 9850
-
 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18
조회수 9276
-
 이정호 교수, 이주호 박사, 악성 뇌종양의 근본적 원인 밝혀
〈 이 주 호 박사 〉
악성 뇌종양인 교모세포종은 미디어에서 주요 소재로 나올 만큼 인간에게 치명적인 질병으로 일반 대중에게 낯설지 않은 질병이다. 실제로 악성 뇌종양으로 인한 미국 암 관련 사망률은 4위에 달하며 미국의 에드워드 케네디, 존 매케인 상원의원 등이 이 질병으로 사망했거나 투병 중이다.
우리 대학 의과학대학원 이정호 교수 연구팀이 세브란스병원 신경외과 강석구 교수와의 공동 연구를 통해 악성 뇌종양인 교모세포종 돌연변이 발생이 암 부위가 아닌 암에서 멀리 떨어진 뇌실하영역에서 발생한다는 사실을 규명했다.
이는 교모세포종 발병의 원인이 암 발생 부위일 것이라는 기존의 학설을 뒤집는 연구 결과로, 악성도가 가장 높은 종양인 교모세포종의 치료법 개발에 새로운 방향을 제시할 것으로 기대된다.
또한 그동안 암 조직만을 대상으로 이뤄진 암 연구가 암의 기원이 되는 조직에 대한 연구로 발전하면서 교모세포종 뿐 아니라 다른 암에 대해서도 치료의 실마리를 찾을 수 있는 기반이 될 것으로 보인다.
의과학대학원 졸업생 이주호 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처(Nature)’ 8월 1일자 온라인 판에 게재됐다.
교모세포종은 가장 예후가 좋지 않은 종양이다. 암 발생의 근본적인 원인에 대한 이해가 부족해 수술을 하더라도 재발 가능성이 매우 높기 때문이다. 수술만으로 치료가 불가능해 항암치료, 방사선치료, 표적항암제 등을 병행하지만 아직도 그 치료법이 명확하지 않다.
이정호 교수 연구팀은 암 발생 부위가 아닌 종양과 떨어져 있는 뇌실하영역이라는 곳에 주목했다. 교모세포종이 수술 이후에도 재발률이 높다는 점에서 원인이 다른 곳에 있을 것이라고 판단한 것이다.
이 교수는“교모세포종은 종양을 떼어내도 1~2년 후에 재발률이 높다. 암은 돌연변이인데 돌연변이가 발생하는 곳이 종양이 아닌 다른 부위라고 생각했고 그곳이 바로 뇌실하영역(subventricular zone : SVZ)이라는 사실을 밝혀냈다”고 말했다.
연구팀은 2013년부터 2017년 사이에 수술을 한 뇌종양 환자 28명을 대상으로 종양조직 외에 수술 중 제거되는 종양조직, 정상조직, 뇌실주변의 조직 3가지를 조합해 분석했다. 딥 시퀀싱, 단일세포시퀀싱 등을 통해 교모세포종의 시작이 뇌실하영역에서 발생한 낮은 빈도의 종양을 유발하는 돌연변이에 의한 것임을 밝혔다.
특히 유전자 편집 동물 모델을 통해 뇌실하영역에서 돌연변이가 생기면 이 돌연변이를 가진 세포가 뇌실하영역을 떠나 뇌의 다른 부위로 이동해 교모세포종이 되는 사실 또한 확인했다. 돌연변이 세포가 마치 불꽃놀이처럼 곳곳으로 퍼진 뒤 시간이 지나자 다른 부위에서 종양으로 진화한 것이다.
연구팀은 KAIST 교원창업(소바젠, 대표 김병태)을 통해 이번 연구결과를 바탕으로 뇌실하영역의 세포가 교모세포종으로 진화되는 과정을 막기 위한 치료약 개발에 나설 예정이다.
1저자인 이주호 박사는 “암 중 예후가 가장 좋지 않은 교모세포종에 대한 발암의 비밀을 국내 연구진이 풀어냈다는 것에 큰 의미가 있다”며 “악성 뇌종양의 연구와 치료의 획기적 전환점을 최초로 증명하고 제시한 것이다”고 말했다.
이정호 교수는 “암 중 가장 예후가 좋지 않은 교모세포종의 원인을 파악하고 동물 모델 제작까지 성공했다는 점에서 큰 의미가 있다. 환자에게서 찾은 것을 동물에 그대로 반영했기 때문에 여기서 치료를 할 수 있다면 임상까지 가능할 것이다.”고 말했다.
이정호 교수 연구팀은 후천성 뇌 돌연변이에 의한 난치성 뇌전증의 원리와 치료법을 최초로 규명한 바 있다. 이를 토대로 글로벌 제약회사와 함께 임상 2상이 진행될 정도로 난치성 뇌질환의 진단 및 치료법 개발을 세계적으로 리드하고 있다.
이 교수는 한국인으로서는 처음으로 난치성 뇌전증의 유전 병리학적 진단 기준을 세우는 세계 뇌전증학회 핵심 위원으로 참여해 국제 기준을 제정 중이다.
이번 연구는 서경배과학재단, 보건복지부 세계선도의과학자육성사업, 한국연구재단, 보건산업진흥원 사업을 통해 수행됐다.
□ 그림 설명
그림1. 교모세포종의 발암의 시작을 불꽃놀이에 비유한 그림
그림2. 동물 실험을 통해 뇌실하영역이 발암의 시발점임을 증명
이정호 교수, 이주호 박사, 악성 뇌종양의 근본적 원인 밝혀
〈 이 주 호 박사 〉
악성 뇌종양인 교모세포종은 미디어에서 주요 소재로 나올 만큼 인간에게 치명적인 질병으로 일반 대중에게 낯설지 않은 질병이다. 실제로 악성 뇌종양으로 인한 미국 암 관련 사망률은 4위에 달하며 미국의 에드워드 케네디, 존 매케인 상원의원 등이 이 질병으로 사망했거나 투병 중이다.
우리 대학 의과학대학원 이정호 교수 연구팀이 세브란스병원 신경외과 강석구 교수와의 공동 연구를 통해 악성 뇌종양인 교모세포종 돌연변이 발생이 암 부위가 아닌 암에서 멀리 떨어진 뇌실하영역에서 발생한다는 사실을 규명했다.
이는 교모세포종 발병의 원인이 암 발생 부위일 것이라는 기존의 학설을 뒤집는 연구 결과로, 악성도가 가장 높은 종양인 교모세포종의 치료법 개발에 새로운 방향을 제시할 것으로 기대된다.
또한 그동안 암 조직만을 대상으로 이뤄진 암 연구가 암의 기원이 되는 조직에 대한 연구로 발전하면서 교모세포종 뿐 아니라 다른 암에 대해서도 치료의 실마리를 찾을 수 있는 기반이 될 것으로 보인다.
의과학대학원 졸업생 이주호 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처(Nature)’ 8월 1일자 온라인 판에 게재됐다.
교모세포종은 가장 예후가 좋지 않은 종양이다. 암 발생의 근본적인 원인에 대한 이해가 부족해 수술을 하더라도 재발 가능성이 매우 높기 때문이다. 수술만으로 치료가 불가능해 항암치료, 방사선치료, 표적항암제 등을 병행하지만 아직도 그 치료법이 명확하지 않다.
이정호 교수 연구팀은 암 발생 부위가 아닌 종양과 떨어져 있는 뇌실하영역이라는 곳에 주목했다. 교모세포종이 수술 이후에도 재발률이 높다는 점에서 원인이 다른 곳에 있을 것이라고 판단한 것이다.
이 교수는“교모세포종은 종양을 떼어내도 1~2년 후에 재발률이 높다. 암은 돌연변이인데 돌연변이가 발생하는 곳이 종양이 아닌 다른 부위라고 생각했고 그곳이 바로 뇌실하영역(subventricular zone : SVZ)이라는 사실을 밝혀냈다”고 말했다.
연구팀은 2013년부터 2017년 사이에 수술을 한 뇌종양 환자 28명을 대상으로 종양조직 외에 수술 중 제거되는 종양조직, 정상조직, 뇌실주변의 조직 3가지를 조합해 분석했다. 딥 시퀀싱, 단일세포시퀀싱 등을 통해 교모세포종의 시작이 뇌실하영역에서 발생한 낮은 빈도의 종양을 유발하는 돌연변이에 의한 것임을 밝혔다.
특히 유전자 편집 동물 모델을 통해 뇌실하영역에서 돌연변이가 생기면 이 돌연변이를 가진 세포가 뇌실하영역을 떠나 뇌의 다른 부위로 이동해 교모세포종이 되는 사실 또한 확인했다. 돌연변이 세포가 마치 불꽃놀이처럼 곳곳으로 퍼진 뒤 시간이 지나자 다른 부위에서 종양으로 진화한 것이다.
연구팀은 KAIST 교원창업(소바젠, 대표 김병태)을 통해 이번 연구결과를 바탕으로 뇌실하영역의 세포가 교모세포종으로 진화되는 과정을 막기 위한 치료약 개발에 나설 예정이다.
1저자인 이주호 박사는 “암 중 예후가 가장 좋지 않은 교모세포종에 대한 발암의 비밀을 국내 연구진이 풀어냈다는 것에 큰 의미가 있다”며 “악성 뇌종양의 연구와 치료의 획기적 전환점을 최초로 증명하고 제시한 것이다”고 말했다.
이정호 교수는 “암 중 가장 예후가 좋지 않은 교모세포종의 원인을 파악하고 동물 모델 제작까지 성공했다는 점에서 큰 의미가 있다. 환자에게서 찾은 것을 동물에 그대로 반영했기 때문에 여기서 치료를 할 수 있다면 임상까지 가능할 것이다.”고 말했다.
이정호 교수 연구팀은 후천성 뇌 돌연변이에 의한 난치성 뇌전증의 원리와 치료법을 최초로 규명한 바 있다. 이를 토대로 글로벌 제약회사와 함께 임상 2상이 진행될 정도로 난치성 뇌질환의 진단 및 치료법 개발을 세계적으로 리드하고 있다.
이 교수는 한국인으로서는 처음으로 난치성 뇌전증의 유전 병리학적 진단 기준을 세우는 세계 뇌전증학회 핵심 위원으로 참여해 국제 기준을 제정 중이다.
이번 연구는 서경배과학재단, 보건복지부 세계선도의과학자육성사업, 한국연구재단, 보건산업진흥원 사업을 통해 수행됐다.
□ 그림 설명
그림1. 교모세포종의 발암의 시작을 불꽃놀이에 비유한 그림
그림2. 동물 실험을 통해 뇌실하영역이 발암의 시발점임을 증명
2018.08.02
조회수 15445
 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 1075
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 1075 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 1802
뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다.
장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다.
이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌종양 내 면역세포 중 T 세포, 특히 CD4+ T 세포의 아형에서 세포독성 기능이 증대되는 것을 단일 세포 전사체 분석을 통해 확인했고, 더 나아가 암미세환경에서 탈진한 T 세포를 재활성화하는 면역관문억제제인 항 PD-1 항체와 복합처리시 탈진된 T세포 표면에 있는 단백질(PD-1)과 결합하여 T 세포 재활성을 유도하여 항암면역 치료의 효과를 더 증진함을 확인했다.
이러한 연구 결과는 기존 면역관문억제제의 효과가 미미했던 교모세포종에서 장내 미생물, 장내 미생물 유래 대사체, 또는 균주 유래 물질의 복합처리를 통해 항종양 면역기능을 향상하는 방식의 뇌종양 치료가 가능하다는 것을 보여주는 결과로, 추후 교모세포종에 항 PD-1 항체와 같은 면역관문억제제 치료를 적용하는데 응용될 수 있을 것으로 기대된다.
이번 연구를 주도한 KAIST 의과학대학원 김재호 박사는 "그동안 잘 알려지지 않은 장내 미생물 분석을 통해 뇌종양 성장을 억제할 수 있는 균주를 확보했으며 이러한 균주에 의한 항 뇌종양 면역조절 기전을 규명한 중요한 연구”라고 설명했다. 이흥규 교수는 “면역관문 치료제에 의한 뇌종양 치료 임상 시험 실패를 극복할 수 있는 대안으로 면역관문 치료제와 뇌종양 억제 유용 균주의 복합 치료를 통해 뇌종양 치료의 가능성을 보여준 동물실험 결과로 향후 장내 미생물을 이용한 항암 치료제 개발의 실마리를 제공할 것으로 기대한다ˮ 라고 연구 결과를 소개했다.
의과학대학원 김재호 박사(現, 미국 LA 소재 시티오브호프 암센터 방사선종양학과 박사후연구원)가 제1 저자로 참여한 이번 연구는 생명과학 분야 국제 학술지 `셀 리포트 (Cell Reports)'에 10월 6일 字 온라인판에 게재됐다. (논문명: Supplementation with a high-glucose drink stimulates anti-tumor immune responses to glioblastoma via gut microbiota modulation)
한편 이번 연구는 한국연구재단 바이오의료기술개발사업의 지원을 받아 수행됐다.
2023.10.16 조회수 1802 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 2341
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 2341 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3163
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3163 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 4690
악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다.
☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형
우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다.
☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구
☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용
교모세포종 환자는 진단 후 평균 생존 기간이 8개월에 불과하며 5년 이상 생존율은 6.8%로 매우 낮은 수준이다. 종양 치료를 위한 활발한 연구로 면역관문 치료제 등 다양한 치료법이 개발돼 지난 30년간 전체 암 환자의 생존율이 20% 가까이 증가했지만, 교모세포종 환자의 생존율 증가는 2%에 그쳤다.
종양 내 면역세포의 상당수를 차지하는 대식세포는 일반적으로 종양을 제거하는 대신 종양 환경에 적응해 종양세포의 성장 및 전이를 돕고 다른 면역세포들의 활성 및 작용을 억제해 항암 면역반응을 감소시킨다고 알려져 있다. 최근 흑색종 등에서 큰 효과를 나타내는 면역관문 치료제가 교모세포종 치료에서는 효과가 거의 없다는 것이 보고됐는데, 그 이유 중 하나로 손꼽히는 것이 이러한 면역 억제성 대식세포의 과다한 유입이다. 하지만 최근 보고된 연구 결과들은 종양 내 대식세포는 매우 다양한 표현형을 나타내는 여러 대식세포 아형으로 나눌 수 있으며, 이 세포들이 면역관문 치료제 등이 효과를 나타내는 데에 중요하다고 밝혔다.
이 교수 연구팀은 미국 국립암연구소(National Cancer Institute, NCI)와 국립인간유전체연구소(National Human Genome Research Institute, NHGRI)에서 운영하는 암 유전체 아틀라스(The Cancer Genome Atlas, TCGA)에 공개된 교모세포종 환자의 유전자 발현을 비교해 교모세포종 내에서 항암 면역반응을 증가시키는 대식세포의 마커로 CD169 유전자를 발굴하고, 마우스 교모세포종 모델을 사용해 CD169 단백질을 발현하는 대식세포가 없으면 항암 면역반응이 감소해 마우스의 생존이 감소하는 것을 밝혔다.
특히 연구팀은 CD169를 발현하는 대식세포가 세포독성 T 세포의 종양 내 유입에 중요한 CXCL10과 같은 *케모카인을 증가시켜 활성화된 T 세포의 종양 내 유입을 증가시킨다는 것을 밝혔다. 또한, CD169는 이 대식세포의 마커일 뿐 아니라 암세포에 대한 포식작용을 증가시키는 기능을 하며, CD169로 인해 포식작용이 증가한 대식세포는 암세포 특이적인 세포독성 T 세포의 활성을 직접 증가시키는 것을 밝혔다.
☞ 케모카인(chemokine): 백혈구 유주작용, 활성화 작용을 하는 단백질
이 교수는 "이번 연구 결과는 교모세포종에 대한 항암 면역반응에 중요한 대식세포의 마커를 발굴한 것뿐만 아니라, 이들 대식세포가 항암 면역반응을 증가시키는 기전을 확인해 면역관문 치료제의 효과를 높이는 복합치료제 개발에 실마리를 제공할 수 있을 것으로 기대한다ˮ고 밝혔다.
의과학대학원 연수연구원 김현진 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 10월 20일 字 온라인판에 게재됐다. (논문명: Blood monocyte-derived CD169⁺ macrophages contribute to antitumor immunity against glioblastoma)
한편 이번 연구는 삼성미래기술육성재단 및 한국연구재단의 지원을 받아 수행됐다.
2022.11.04 조회수 4690 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 4449
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 4449 의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16 조회수 75411
의과학대학원 이흥규 교수팀, 새로운 뇌종양 면역반응 규명
뇌종양 세포가 주변의 산소를 먹어 치우며 면역세포를 무력화시키는 과정이 밝혀졌다. 후천성 면역세포에 의해 인식될 표지도 만들지 않는 뇌종양 세포가 선천성 면역세포조차 회피하는 비결이 밝혀진 것이다.
우리 대학 의과학대학원 이흥규 교수 연구팀이 악성 뇌종양 세포의 과도한 산소소비로 인한 감마델타 T 세포의 면역반응 저하 과정을 규명했다고 16일 밝혔다.
이번 연구 결과로 왕성하게 증식하며 주변 산소를 빠르게 소비하는 뇌종양 세포로의 산소유입을 막는 방식이 면역항암치료제의 낮은 반응성을 보완할 실마리가 될 것으로 기대된다.
연구팀은 뇌종양의 악성도가 높을수록 감마델타 T 세포의 종양 내 유입이 적고 저산소 환경은 심한 것을 알아냈다. 반면 감마델타 T 세포가 많이 유입될수록 환자의 예후가 좋은 것으로 나타났다. 종양에 대항하는 면역세포로 잘 알려진 후천성 T 세포가 아닌 선천성 T 세포인 감마델타 T 세포의 활성에 주목하게 된 이유다.
이에 연구팀은 저산소 환경을 해소해 감마델타 T 세포에 적절한 산소를 공급, 세포의 생존을 도우면 면역반응이 정상화 될 것이라는 가설을 세웠다.
실제 감마델타 T 세포는 스트레스에 노출된 뇌종양 세포 표면에 많이 생기는 리간드(NKG2DL)를 직접 인식하는 수용체(NKG2D)가 있어 종양에 대항한 면역반응의 새로운 주체로 주목받았지만 기대만큼의 효과를 내지 못하고 있었다.
연구팀이 실제 뇌종양 생쥐모델에 뇌종양의 과도한 산소대사를 막을 화합물(메트포르민)을 감마델타 T 세포와 함께 투여하자, 면역세포의 종양조직 내 침투가 늘고 생존률이 향상됐다. 감마델타 T세포의 저산소 환경을 해소하자, 항종양 면역반응이 개선된 것이다.
한편 감마델타 T 세포의 항 뇌종양 면역반응 기전을 규명하고 감마델타 T 세포의 면역반응을 증대시킬 방안을 제시한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업(차세대바이오사업) 및 삼성미래기술육성재단의 지원으로 수행됐으며 면역학 분야 국제학술지 ‘네이처 이뮤놀로지(Nature Immunology)’ 2월 11일 자에 게재됐다.
2021.02.16 조회수 75411 난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10 조회수 39494
난치성 악성 위암의 분자병태생리 기전 최초 규명
우리 대학 바이오및뇌공학과 김필남 교수, 최정균 교수 연구팀은 연세대학교 세브란스 병원 정재호 교수 연구팀과 공동연구를 통해 종양 미세환경의 물리적 인자[세포기질의 강성도 증가]가 암세포의 악성화를 촉진하는 분자후성유전학적 원인을 최초로 규명함으로써 향후 새로운 항암치료전략 수립에 중요한 통찰과 방향을 제시했다.
지금까지 종양연구가 대부분 암세포 자체의 돌연변이나 내부 신호전달 경로에 집중되어 진행되었다면 이번 연구는 암세포가 위치한 종양의 미세환경적 요인이 악성화에 어떤 영향을 주는지를 규명해 종양학 연구의 새로운 패러다임을 제공하고 있다. 최근에 암면역치료의 임상적 성공에 힘입어 *종양미세환경의 면역세포에 대한 관심과 연구가 증가하고 있으나 종양미세환경의 물리적 요인이 암세포의 악성화 및 치료반응에 어떤 영향을 주는지에 대한 연구는 거의 없었다.
연구팀은 생체재료를 활용해 인간의 종양미세환경과 유사한 위암실험모델을 개발하고, 이를 이용하여 단단해진 미세환경에 의한 위암세포의 악성화 메커니즘을 규명했다. 암을 유발하는 단백질로 잘 알려진 YAP (Yes-associated protein)의 DNA 가 단단해진 조직내에서 후성유전학적 변화인 DNA 탈메틸화가 유도되어 악성화가 촉진됨을 밝혔다. 이와 더불어, 본 연구팀은 단단하게 변성된 미세환경을 다시 물렁한 조직으로 변화할 경우, 악성화된 위암 세포에서 역전현상이 일어나 악성화가 약화되고 항암제에 반응하는 세포로 변화함을 확인했다.
이번 연구 결과는 치료가 어려운 난치성 *미만형 위암의 악성화를 촉진하는 원인을 규명함으로써 임상적으로 가장 어려운 scirrhous cancer 의 새로운 치료 가능성을 제시하고, 위암 뿐만 아니라 다양한 암종의 유사한 표현형의 암에 대한 치료 확장성에 기여할 것으로 기대한다.
*종양미세환경: 종양내에 존재하는 암세포, 암의 형성 및 진행에 직/간접적으로 영향을 미치는 주변 조직세포 (면역세포, 섬유아세포, 혈관세포 등) 및 이를 구성하고 있는 *세포외기질물질(Extracellular Matrix) 를 총칭해서 종양미세환경이라고 한다.
*세포외기질: 세포와 세포사이를 연결하고 지탱해주는 지지체의 역할을 하는 물질로 콜라겐과 같은 단백질이 이에 속한다. 세포외기질은 단순한 지지체가 아니라, 이것의 물리적, 화학적 특성이 세포의 운명, 특성 등에 직접적으로 영향을 미친다. 특히, 병적요인으로 인해서 조직 섬유화와 같은 변성이 일어나고 이러한 변성이 암과 같은 질병의 악화의 원인이 된다고 알려져 있다.
*미만성 위암: 위암은 조직학적으로 크게 장형암과 미만 위암으로 분류된다. 장형암의 경우 헬리코박터 감염이나 만성 위축성 위염에 속발하는 위암으로 일반적으로 미만성에 비해 양호한 예후를 보인다. 미만성 위암은 장형암에 비해 암 덩어리를 잘 형성하지 않으며 작은 악성 세포들이 위벽에 퍼져서 침윤과 전이를 잘하며 조기 발견도 어렵다. 40세 미만에서 호발하며 악성도가 매우 높아 치료가 어려운 암으로 알려져 있다.
바이오및뇌공학과 장민정 박사가 제1 저자로 참여한 이번 연구는 국제학술지인 `네이처 바이오메디컬엔지니어링’ 12월 7일 字 온라인 판에 실렸다. (논문명: Matrix stiffness epigenetically regulates the oncogenic activation of the Yes-associated protein in gastric cancer)
이번 연구성과는 한국연구재단 과학기술 분야 기초연구사업인 중견연구자지원사업 및 보건복지부 연구중심병원 R&D 사업의 지원을 통해 수행됐다.
2020.12.10 조회수 39494 이행기, 이정호 교수, 2019 국가연구개발 우수성과 100선 선정
〈 이행기 교수, 이정호 교수 〉
과학기술정보통신부와 한국과학기술기획평가원이 발표한 ´2019년 국가연구개발 우수성과 100선´에 우리 대학 이행기 교수, 이정호 교수가 선정됐다.
건설및환경공학과 이행기 교수는 기계·소재분야 우수성과에 선정됐다. 이 교수는 나노 및 바이오 기술을 융합한 차세대 건설재료를 개발한 연구 성과를 인정받았다.
의과학대학원 이정호 교수는 생명·해양 분야 우수성과에 선정됐다. 악성 뇌종양, 소아 뇌종양의 근본 원인을 규명하고 혁신적인 치료법을 개발한 공을 인정받았다.
우수성과로 선정된 성과는 과학기술정보통신부장관의 인증서와 현판이 수여된다.
선정된 교수에게는 국가연구개발 성과평가 유공포상(훈·포장, 대통령표창, 국무총리표창 등) 후보자로 추천되고, 신규 연구개발(R&D) 과제 선정에서 우대받게 된다.
2019.10.11 조회수 11004
이행기, 이정호 교수, 2019 국가연구개발 우수성과 100선 선정
〈 이행기 교수, 이정호 교수 〉
과학기술정보통신부와 한국과학기술기획평가원이 발표한 ´2019년 국가연구개발 우수성과 100선´에 우리 대학 이행기 교수, 이정호 교수가 선정됐다.
건설및환경공학과 이행기 교수는 기계·소재분야 우수성과에 선정됐다. 이 교수는 나노 및 바이오 기술을 융합한 차세대 건설재료를 개발한 연구 성과를 인정받았다.
의과학대학원 이정호 교수는 생명·해양 분야 우수성과에 선정됐다. 악성 뇌종양, 소아 뇌종양의 근본 원인을 규명하고 혁신적인 치료법을 개발한 공을 인정받았다.
우수성과로 선정된 성과는 과학기술정보통신부장관의 인증서와 현판이 수여된다.
선정된 교수에게는 국가연구개발 성과평가 유공포상(훈·포장, 대통령표창, 국무총리표창 등) 후보자로 추천되고, 신규 연구개발(R&D) 과제 선정에서 우대받게 된다.
2019.10.11 조회수 11004 전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 9850
전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 9850 고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 9276
고현용 연구원, 뇌전증 동반하는 소아 뇌종양 근본원인 밝혀
〈 고 현 용 연구원 〉
우리 대학 의과학대학원 고현용 연구원(지도교수 : 이정호 교수)이 난치성 뇌전증(간질 발작)을 일으키는 소아 뇌종양의 근본 원인과 뇌전증 발생의 원리를 규명해 새로운 치료법을 제시했다.
이번 연구 결과를 통해 수술 치료에 어려움이 있는 소아 뇌종양 기반의 난치성 뇌전증 치료에 큰 기여를 할 수 있을 것으로 기대된다.
고현용 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 9월 17일자 온라인 판에 게재됐다. (논문명: 비라프 체성 돌연변이가 소아뇌종양의 본질적 뇌전증 발생에 기여함; BRAF somatic mutation contributes to intrinsic epileptogenicity in pediatric brain tumors)
소아 뇌종양은 성인 뇌종양에 비해 난치성 뇌전증이 빈번하게 동반되는 특징을 갖고 있다. 그러나 소아 뇌종양에서 특이적으로 난치성 뇌전증이 발생하는 원인에 대해서는 밝혀진 바가 없으며 현존하는 항 뇌전증 약물에 반응하지 않기 때문에 환자의 치료에 많은 어려움을 겪고 있다.
연구팀은 소아 뇌종양 환지 뇌 조직 및 동물 모델의 분자 유전학적 분석을 통해 태아의 뇌 발달과정 중 신경 줄기 세포에 ‘비라프 (BRAF V600E)’라는 돌연변이가 발생하면서 난치성 뇌전증이 동반된 소아 뇌종양이 발생하는 것을 규명했다.
연구팀은 뇌전증이 동반된 소아 뇌종양 중 하나인 신경절 교세포종 환자의 종양 조직을 분자 유전학적으로 분석한 결과 비라프 유전변이가 태아 뇌 발달 과정 중 발생함을 확인했다.
이 변이를 동물 모델에서 구현해 신경절 교세포종의 병리 양상을 재현하고 발작을 관찰해 소아 뇌종양 기반의 뇌전증 치료용 동물 모델을 최초로 확립했다.
이를 이용해 면역 염색 분석과 전사체 분석을 실시했다. 소아 뇌종양에서 발생하는 난치성 뇌전증이 신경세포에 존재하는 비라프 변이로 인해 발생하고, 교세포에 존재하는 변이는 종양 덩어리를 형성하는데 중요한 역할을 하는 것을 확인했다.
특히 현재 임상에서 항암제로 사용되고 있는 비라프의 저해제를 동물 모델에 주입해 난치성 뇌전증 치료 효과를 확인했다.
1저자인 고현용 연구원은 “소아 뇌종양 환자의 경 줄기 세포에서 발생한 특정 돌연변이가 난치성 뇌전증 발생에 핵심적 역할을 한다는 것을 국내 연구진이 최초로 발견해냈다는 것에 큰 의미가 있다”며 “소아 뇌종양으로 인해 발생한 난치성 뇌전증의 근본 원인을 규명해 과적 치료의 가능성을 처음으로 보여준 것이다”고 말했다.
연구팀은 교원창업기업(소바젠, 대표 김병태)을 통해 소아 뇌종양 기반의 난치성 뇌전증 치료약 개발에 나설 예정이다.
이번 연구는 연세대학교 의과대학 세브란스 병원 김동석, 김세훈, 강훈철 교수 연구팀과 공동 연구 및 서경배과학재단, 보건복지부 세계선도과학자육성사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 수술전 (PreOP) 과 수술후 (PostOP) 의 신경절 교세포종의 MRI사진과 이형성이 동반된 신경세포가 있는 병리 조직 사진
그림2. BRAF V600E 돌연변이가 발생하여 뇌전증 동반 소아 뇌종양을 유발하는 과정 모식도
2018.09.18 조회수 9276 이정호 교수, 이주호 박사, 악성 뇌종양의 근본적 원인 밝혀
〈 이 주 호 박사 〉
악성 뇌종양인 교모세포종은 미디어에서 주요 소재로 나올 만큼 인간에게 치명적인 질병으로 일반 대중에게 낯설지 않은 질병이다. 실제로 악성 뇌종양으로 인한 미국 암 관련 사망률은 4위에 달하며 미국의 에드워드 케네디, 존 매케인 상원의원 등이 이 질병으로 사망했거나 투병 중이다.
우리 대학 의과학대학원 이정호 교수 연구팀이 세브란스병원 신경외과 강석구 교수와의 공동 연구를 통해 악성 뇌종양인 교모세포종 돌연변이 발생이 암 부위가 아닌 암에서 멀리 떨어진 뇌실하영역에서 발생한다는 사실을 규명했다.
이는 교모세포종 발병의 원인이 암 발생 부위일 것이라는 기존의 학설을 뒤집는 연구 결과로, 악성도가 가장 높은 종양인 교모세포종의 치료법 개발에 새로운 방향을 제시할 것으로 기대된다.
또한 그동안 암 조직만을 대상으로 이뤄진 암 연구가 암의 기원이 되는 조직에 대한 연구로 발전하면서 교모세포종 뿐 아니라 다른 암에 대해서도 치료의 실마리를 찾을 수 있는 기반이 될 것으로 보인다.
의과학대학원 졸업생 이주호 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처(Nature)’ 8월 1일자 온라인 판에 게재됐다.
교모세포종은 가장 예후가 좋지 않은 종양이다. 암 발생의 근본적인 원인에 대한 이해가 부족해 수술을 하더라도 재발 가능성이 매우 높기 때문이다. 수술만으로 치료가 불가능해 항암치료, 방사선치료, 표적항암제 등을 병행하지만 아직도 그 치료법이 명확하지 않다.
이정호 교수 연구팀은 암 발생 부위가 아닌 종양과 떨어져 있는 뇌실하영역이라는 곳에 주목했다. 교모세포종이 수술 이후에도 재발률이 높다는 점에서 원인이 다른 곳에 있을 것이라고 판단한 것이다.
이 교수는“교모세포종은 종양을 떼어내도 1~2년 후에 재발률이 높다. 암은 돌연변이인데 돌연변이가 발생하는 곳이 종양이 아닌 다른 부위라고 생각했고 그곳이 바로 뇌실하영역(subventricular zone : SVZ)이라는 사실을 밝혀냈다”고 말했다.
연구팀은 2013년부터 2017년 사이에 수술을 한 뇌종양 환자 28명을 대상으로 종양조직 외에 수술 중 제거되는 종양조직, 정상조직, 뇌실주변의 조직 3가지를 조합해 분석했다. 딥 시퀀싱, 단일세포시퀀싱 등을 통해 교모세포종의 시작이 뇌실하영역에서 발생한 낮은 빈도의 종양을 유발하는 돌연변이에 의한 것임을 밝혔다.
특히 유전자 편집 동물 모델을 통해 뇌실하영역에서 돌연변이가 생기면 이 돌연변이를 가진 세포가 뇌실하영역을 떠나 뇌의 다른 부위로 이동해 교모세포종이 되는 사실 또한 확인했다. 돌연변이 세포가 마치 불꽃놀이처럼 곳곳으로 퍼진 뒤 시간이 지나자 다른 부위에서 종양으로 진화한 것이다.
연구팀은 KAIST 교원창업(소바젠, 대표 김병태)을 통해 이번 연구결과를 바탕으로 뇌실하영역의 세포가 교모세포종으로 진화되는 과정을 막기 위한 치료약 개발에 나설 예정이다.
1저자인 이주호 박사는 “암 중 예후가 가장 좋지 않은 교모세포종에 대한 발암의 비밀을 국내 연구진이 풀어냈다는 것에 큰 의미가 있다”며 “악성 뇌종양의 연구와 치료의 획기적 전환점을 최초로 증명하고 제시한 것이다”고 말했다.
이정호 교수는 “암 중 가장 예후가 좋지 않은 교모세포종의 원인을 파악하고 동물 모델 제작까지 성공했다는 점에서 큰 의미가 있다. 환자에게서 찾은 것을 동물에 그대로 반영했기 때문에 여기서 치료를 할 수 있다면 임상까지 가능할 것이다.”고 말했다.
이정호 교수 연구팀은 후천성 뇌 돌연변이에 의한 난치성 뇌전증의 원리와 치료법을 최초로 규명한 바 있다. 이를 토대로 글로벌 제약회사와 함께 임상 2상이 진행될 정도로 난치성 뇌질환의 진단 및 치료법 개발을 세계적으로 리드하고 있다.
이 교수는 한국인으로서는 처음으로 난치성 뇌전증의 유전 병리학적 진단 기준을 세우는 세계 뇌전증학회 핵심 위원으로 참여해 국제 기준을 제정 중이다.
이번 연구는 서경배과학재단, 보건복지부 세계선도의과학자육성사업, 한국연구재단, 보건산업진흥원 사업을 통해 수행됐다.
□ 그림 설명
그림1. 교모세포종의 발암의 시작을 불꽃놀이에 비유한 그림
그림2. 동물 실험을 통해 뇌실하영역이 발암의 시발점임을 증명
2018.08.02 조회수 15445
이정호 교수, 이주호 박사, 악성 뇌종양의 근본적 원인 밝혀
〈 이 주 호 박사 〉
악성 뇌종양인 교모세포종은 미디어에서 주요 소재로 나올 만큼 인간에게 치명적인 질병으로 일반 대중에게 낯설지 않은 질병이다. 실제로 악성 뇌종양으로 인한 미국 암 관련 사망률은 4위에 달하며 미국의 에드워드 케네디, 존 매케인 상원의원 등이 이 질병으로 사망했거나 투병 중이다.
우리 대학 의과학대학원 이정호 교수 연구팀이 세브란스병원 신경외과 강석구 교수와의 공동 연구를 통해 악성 뇌종양인 교모세포종 돌연변이 발생이 암 부위가 아닌 암에서 멀리 떨어진 뇌실하영역에서 발생한다는 사실을 규명했다.
이는 교모세포종 발병의 원인이 암 발생 부위일 것이라는 기존의 학설을 뒤집는 연구 결과로, 악성도가 가장 높은 종양인 교모세포종의 치료법 개발에 새로운 방향을 제시할 것으로 기대된다.
또한 그동안 암 조직만을 대상으로 이뤄진 암 연구가 암의 기원이 되는 조직에 대한 연구로 발전하면서 교모세포종 뿐 아니라 다른 암에 대해서도 치료의 실마리를 찾을 수 있는 기반이 될 것으로 보인다.
의과학대학원 졸업생 이주호 박사가 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처(Nature)’ 8월 1일자 온라인 판에 게재됐다.
교모세포종은 가장 예후가 좋지 않은 종양이다. 암 발생의 근본적인 원인에 대한 이해가 부족해 수술을 하더라도 재발 가능성이 매우 높기 때문이다. 수술만으로 치료가 불가능해 항암치료, 방사선치료, 표적항암제 등을 병행하지만 아직도 그 치료법이 명확하지 않다.
이정호 교수 연구팀은 암 발생 부위가 아닌 종양과 떨어져 있는 뇌실하영역이라는 곳에 주목했다. 교모세포종이 수술 이후에도 재발률이 높다는 점에서 원인이 다른 곳에 있을 것이라고 판단한 것이다.
이 교수는“교모세포종은 종양을 떼어내도 1~2년 후에 재발률이 높다. 암은 돌연변이인데 돌연변이가 발생하는 곳이 종양이 아닌 다른 부위라고 생각했고 그곳이 바로 뇌실하영역(subventricular zone : SVZ)이라는 사실을 밝혀냈다”고 말했다.
연구팀은 2013년부터 2017년 사이에 수술을 한 뇌종양 환자 28명을 대상으로 종양조직 외에 수술 중 제거되는 종양조직, 정상조직, 뇌실주변의 조직 3가지를 조합해 분석했다. 딥 시퀀싱, 단일세포시퀀싱 등을 통해 교모세포종의 시작이 뇌실하영역에서 발생한 낮은 빈도의 종양을 유발하는 돌연변이에 의한 것임을 밝혔다.
특히 유전자 편집 동물 모델을 통해 뇌실하영역에서 돌연변이가 생기면 이 돌연변이를 가진 세포가 뇌실하영역을 떠나 뇌의 다른 부위로 이동해 교모세포종이 되는 사실 또한 확인했다. 돌연변이 세포가 마치 불꽃놀이처럼 곳곳으로 퍼진 뒤 시간이 지나자 다른 부위에서 종양으로 진화한 것이다.
연구팀은 KAIST 교원창업(소바젠, 대표 김병태)을 통해 이번 연구결과를 바탕으로 뇌실하영역의 세포가 교모세포종으로 진화되는 과정을 막기 위한 치료약 개발에 나설 예정이다.
1저자인 이주호 박사는 “암 중 예후가 가장 좋지 않은 교모세포종에 대한 발암의 비밀을 국내 연구진이 풀어냈다는 것에 큰 의미가 있다”며 “악성 뇌종양의 연구와 치료의 획기적 전환점을 최초로 증명하고 제시한 것이다”고 말했다.
이정호 교수는 “암 중 가장 예후가 좋지 않은 교모세포종의 원인을 파악하고 동물 모델 제작까지 성공했다는 점에서 큰 의미가 있다. 환자에게서 찾은 것을 동물에 그대로 반영했기 때문에 여기서 치료를 할 수 있다면 임상까지 가능할 것이다.”고 말했다.
이정호 교수 연구팀은 후천성 뇌 돌연변이에 의한 난치성 뇌전증의 원리와 치료법을 최초로 규명한 바 있다. 이를 토대로 글로벌 제약회사와 함께 임상 2상이 진행될 정도로 난치성 뇌질환의 진단 및 치료법 개발을 세계적으로 리드하고 있다.
이 교수는 한국인으로서는 처음으로 난치성 뇌전증의 유전 병리학적 진단 기준을 세우는 세계 뇌전증학회 핵심 위원으로 참여해 국제 기준을 제정 중이다.
이번 연구는 서경배과학재단, 보건복지부 세계선도의과학자육성사업, 한국연구재단, 보건산업진흥원 사업을 통해 수행됐다.
□ 그림 설명
그림1. 교모세포종의 발암의 시작을 불꽃놀이에 비유한 그림
그림2. 동물 실험을 통해 뇌실하영역이 발암의 시발점임을 증명
2018.08.02 조회수 15445