연구

〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.

〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
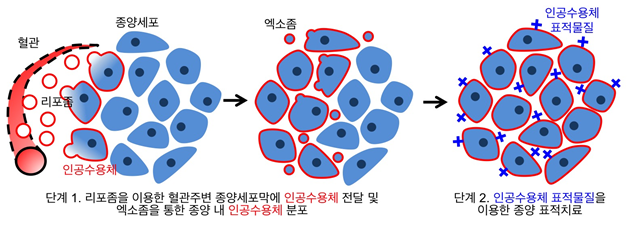
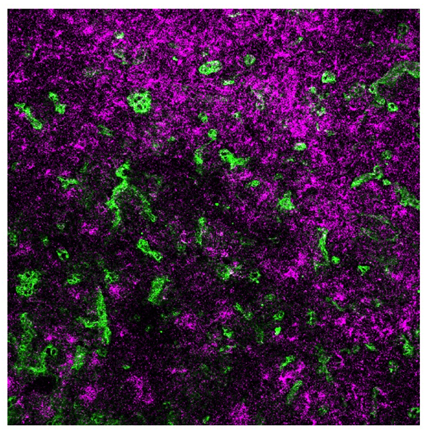
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
-
연구 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다. 우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다. 인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다. 연구팀은 질환 특이적으로
2024-02-06 -
연구 뇌종양 면역치료를 고 포도당 음료로?
뇌에서 발생하는 가장 흔한 악성 뇌종양인 교모세포종은 현재 수술, 항암화학요법, 그리고 방사선치료로 대표되는 암치료요법을 모두 동원해도 평균 생존 기간이 평균 15개월 정도밖에 되지 않는 치료가 매우 힘든 암종이다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 실험 쥐 모델에서 고 포도당 음료 보충을 통해 뇌종양의 성장이 억제되는 현상을 관측했고 이에 더해 이러한 억제 효과가 장내 미생물의 특정 균주 변화를 통해 암세포 증식을 억제하는 항종양 면역반응을 증진한 작용원리를 규명했다고 16일 밝혔다. 장내 미생물은 우리 몸과 긴밀한 관련이 있으며, 악성종양에 대한 항종양 면역반응을 조절하는 데 중요한 역할을 하는 것으로 최근 연구에서 알려졌다. 하지만 대다수의 연구가 항종양 면역반응이 활성화된 흑색종과 같은 암종에서 연구가 이뤄졌으며, 뇌종양에 미치는 영향에 대해서는 거의 알려진 바가 없었다. 이번 연구에서 연구팀은 고 포도당 음료와 특정 균주의 복합처리가 뇌
2023-10-16 -
연구 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다. 우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다. 1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enh
2023-07-24 -
연구 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다. 우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다. 이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다. 암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치
2023-03-06 -
연구 악성 뇌종양 탐지 대식세포 발견 및 기능 규명
뇌에서 발생하는 악성 종양인 교모세포종은 미국에서만 매년 1만 명 이상의 환자가 발생하지만 최근 주목받는 면역치료제도 유의미한 효과를 보지 못한, 치료가 매우 어려운 암 중 하나다. 국내 연구진은 이러한 교모세포종에 대한 면역반응을 증가시키는 *대식세포와 그 작용 기전을 밝혀 새로운 면역치료법의 가능성을 열었다. ☞ 대식세포: 세포 찌꺼기, 이물질, 미생물, 암세포 등을 집어삼켜서 분해하는 식세포작용을 하는 백혈구의 한 유형 우리 대학 의과학대학원 이흥규 교수 연구팀이 교모세포종 내에서 항암 면역반응에 중요한 대식세포를 찾고, 이 세포가 *세포독성 T 세포를 활성화하고 *포식작용으로 암세포를 제거할 수 있다는 것을 발견했다고 4일 밝혔다. ☞ 세포독성 T 세포: 바이러스에 감염된 체세포나 종양 세포를 파괴하는, 흉선에서 유래한 림프구 ☞ 포식작용: 세균이나 죽은 세포 등 체내의 이물질을 섭취하여 제거하는 작용 교모세포종 환자는 진단 후 평균 생존 기간이 8개월에
2022-11-04