-
 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07
조회수 1549
-
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03
조회수 2793
-
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02
조회수 5619
-
 고정확도 실시간 학습 가능한 모바일 인공지능 반도체 칩 세계 최초 개발
우리 대학 전기및전자공학부 유회준 교수 연구팀이 인공지능의 실시간 학습을 모바일 기기에서 구현, 고정확도 인공지능(AI: Artificial Intelligent) 반도체*를 세계 최초로 개발했다고 23일 밝혔다.
* 인공지능 반도체 : 인식·추론·학습·판단 등 인공지능 처리 기능을 탑재하고, 초지능·초저전력·초신뢰 기반의 최적화된 기술로 구현한 반도체
연구팀이 개발한 인공지능 반도체는 저비트 학습과 저지연 학습 방식을 적용해, 모바일 기기에서도 학습할 수 있다. 특히 이번 반도체 칩은 인공지능의 예상치 못한 성능 저하를 막을 수 있는 실시간 학습 기술을 성공적으로 구현했다.
전기및전자공학부 한동현 박사과정이 제1 저자로 참여한 이번 연구는 지난 6월 12일부터 15일까지 인천 연수구 송도 컨벤시아에서 개최된 국제 인공지능 회로 및 시스템 학술대회(AICAS)에서 발표됐으며 응용 예시를 현장에서 시연했고, 최우수 논문상과 최우수 데모상을 모두 석권해 그 우수성을 널리 알렸다. (논문명 : A 0.95 mJ/frame DNN Training Processor for Robust Object Detection with Real-World Environmental Adaptation (저자: 한동현, 임동석, 박광태, 김영우, 송석찬, 이주형, 유회준))
인공지능 (AI) 반도체 기술을 망라하는 국제 학술 대회 ‘AICAS 2022’는 인공지능 반도체 분야 세계 최고 권위를 가진 IEEE(미국 전기 전자 기술자 협회)학회로 평가받으며, 삼성, SK를 필두로, 한국전자통신연구원(ETRI), 엔비디아(NVIDIA), 케이던스(Cadence) 등 국내외 저명한 기업과 기관 등이 참석해 인공지능 반도체 회로와 시스템 전 분야, 인공지능 반도체와 관련된 연구성과를 공유하는 행사다.
기존 인공지능은 사전에 학습된 지능만으로 추론을 진행했기 때문에 학습하지 않은 새로운 환경 혹은 물체에 대해서는 물체 검출이 어려웠다. 하지만 유회준 교수 연구팀이 개발한 실시간 학습은 추론만 수행하던 기존 모바일 인공지능 반도체에 학습 기능을 부여함으로써, 인공지능의 지능 수준을 크게 끌어올렸다.
유 교수팀의 새로운 인공지능 반도체는 사전에 학습한 지식과 애플리케이션 수행 중에 학습한 지식을 함께 활용해 고정확도 물체검출 성능을 보였다. 특히 유회준 교수 연구팀은 렌즈가 깨지거나, 기계 오류로 인한 인공지능의 예상치 못한 정확도 감소도 자동으로 인지하고 이를 실시간 학습을 통해 보정, 기존 인공지능의 문제점을 해결했다.
유 교수팀은 실시간 학습 기능에 더해, 모바일 기기에서 저전력으로 학습이 가능할 수 있도록, 저비트 인공지능 학습 방법, 직접 오류 전사 기반 저지연 학습 방식을 제안, 이를 최적화할 수 있는 반도체(HNPU) 와 응용 시스템을 모두 개발했다.
저전력, 실시간 학습을 수행할 수 있는 모바일 인공지능 전용 반도체, HNPU는 다음과 같이 6가지 핵심 기술이 도입됐다.
○ 확률적 동적 고정 소수점 활용 저비트 학습 방식 (SDFXP: Stochastic Dynamic Fixed-point Representation)
- 동적 고정 소수점에 확률적 표현을 결합하고 확률적 반올림을 도입하여 인공지능 학습에 필요한 비트 정밀도를 최소화 할 수 있는 방법
○ 레이어별 자동 정밀도 검색 알고리즘 및 하드웨어 (LAPS: Layer-wise Adaptive Precision Scaling)
- 학습의 난이도를 자동으로 파악하고 심층신경망의 레이어별로 최적의 비트수를 자동으로 찾아주는 알고리즘 및 이를 가속하는 하드웨어
○ 입력 비트 슬라이스 희소성 활용* (ISS: Input Slice Skipping or Bit-slice Level Sparsity Exploitation)
- 데이터를 이진수로 표현했을 때 중간중간 나타나는 ‘0’ 비트를 활용하여, 데이터 처리량을 높이는 방식
○ 내재적 순수 난수 생성기 (iTRNG: Intrinsic True Random Number Generator)
인공지능 연산을 활용한 순수 난수 생성기를 설계, 데이터의 암호화 및 확률적 반올림을 구현
○ 다중 학습 단계 할당을 통한 고속 학습 알고리즘 및 하드웨어 (MLTA: Multi Learning Task Allocation & Backward Unlocking)
기존 역전파 (Back-propagation) 알고리즘에서 탈피해, 직접 오류 전사를 통한 저지연 학습 구현
○ 실시간 인공지능 학습 기반 자동 오류 검출 기능 저하 보정 시스템 개발 (Real-time DNN Training based Automatic Performance Monitor and Performance Recovery System)
평상시 물체 검출 결과를 주기적으로 모니터링하면서, 갑작스러운 확률 변화를 자동으로 인식, 정확도 저하를 보정하기 위해 실시간 학습을 적용
* 희소성 활용 (Sparsity Exploitation) : 심층 신경망 모델의 연산은 수많은 곱셈누적(MAC: Multiply-And-Accumulate)연산의 연속이다. 연산자에 0이 존재할 시, 굳이 연산을 해보지 않아도 결과는 0임을 알기에 이를 뛰어넘는 방식으로 연산 속도를 높이는 방식.
이러한 기술을 사용해 HNPU는 저전력 물체검출을 구현하여, 다른 모바일 물체검출 시스템과 비교해 75% 높은 속도, 44% 낮은 에너지 소모를 달성하면서도, 실시간 학습으로 고정확도 물체검출을 개발해 주목을 받았다.
연구팀은 HNPU의 활용 예시로 카메라 렌즈가 깨지거나, 기계 오류, 조명, 밝기 변화로 인공지능의 추론 능력이 떨어졌을 때, 실시간 학습을 통해 다시 정확도를 높이는 고정확도 물체검출 시스템을 개발했다. 이는 이후 자율 주행, 로봇 등 다양한 곳에 활용될 것으로 기대된다.
특히 연구팀의 HNPU 연구는 2022 국제인공지능회로및시스템학술대회(AICAS 2022)에서 발표돼, 최우수 논문상과 최우수 데모상을 모두 석권하여 그 우수성을 널리 알렸다.
연구를 주도한 KAIST 전기및전자공학부 유회준 교수는 “현재 인공지능은 사전에 학습한 지식만으로 주어진 문제를 해결하고 있으며, 이는 변화하는 환경과 상황에 맞춰 계속 학습하는 인간의 지능과 뚜렷한 차이를 보인다”라며 “이번 연구는 실시간 학습 인공지능 반도체를 통해 인공지능의 지능 수준을 사람 수준으로 한층 더 끌어올리는 연구”라고 본 연구의 의의를 밝혔다.
고정확도 실시간 학습 가능한 모바일 인공지능 반도체 칩 세계 최초 개발
우리 대학 전기및전자공학부 유회준 교수 연구팀이 인공지능의 실시간 학습을 모바일 기기에서 구현, 고정확도 인공지능(AI: Artificial Intelligent) 반도체*를 세계 최초로 개발했다고 23일 밝혔다.
* 인공지능 반도체 : 인식·추론·학습·판단 등 인공지능 처리 기능을 탑재하고, 초지능·초저전력·초신뢰 기반의 최적화된 기술로 구현한 반도체
연구팀이 개발한 인공지능 반도체는 저비트 학습과 저지연 학습 방식을 적용해, 모바일 기기에서도 학습할 수 있다. 특히 이번 반도체 칩은 인공지능의 예상치 못한 성능 저하를 막을 수 있는 실시간 학습 기술을 성공적으로 구현했다.
전기및전자공학부 한동현 박사과정이 제1 저자로 참여한 이번 연구는 지난 6월 12일부터 15일까지 인천 연수구 송도 컨벤시아에서 개최된 국제 인공지능 회로 및 시스템 학술대회(AICAS)에서 발표됐으며 응용 예시를 현장에서 시연했고, 최우수 논문상과 최우수 데모상을 모두 석권해 그 우수성을 널리 알렸다. (논문명 : A 0.95 mJ/frame DNN Training Processor for Robust Object Detection with Real-World Environmental Adaptation (저자: 한동현, 임동석, 박광태, 김영우, 송석찬, 이주형, 유회준))
인공지능 (AI) 반도체 기술을 망라하는 국제 학술 대회 ‘AICAS 2022’는 인공지능 반도체 분야 세계 최고 권위를 가진 IEEE(미국 전기 전자 기술자 협회)학회로 평가받으며, 삼성, SK를 필두로, 한국전자통신연구원(ETRI), 엔비디아(NVIDIA), 케이던스(Cadence) 등 국내외 저명한 기업과 기관 등이 참석해 인공지능 반도체 회로와 시스템 전 분야, 인공지능 반도체와 관련된 연구성과를 공유하는 행사다.
기존 인공지능은 사전에 학습된 지능만으로 추론을 진행했기 때문에 학습하지 않은 새로운 환경 혹은 물체에 대해서는 물체 검출이 어려웠다. 하지만 유회준 교수 연구팀이 개발한 실시간 학습은 추론만 수행하던 기존 모바일 인공지능 반도체에 학습 기능을 부여함으로써, 인공지능의 지능 수준을 크게 끌어올렸다.
유 교수팀의 새로운 인공지능 반도체는 사전에 학습한 지식과 애플리케이션 수행 중에 학습한 지식을 함께 활용해 고정확도 물체검출 성능을 보였다. 특히 유회준 교수 연구팀은 렌즈가 깨지거나, 기계 오류로 인한 인공지능의 예상치 못한 정확도 감소도 자동으로 인지하고 이를 실시간 학습을 통해 보정, 기존 인공지능의 문제점을 해결했다.
유 교수팀은 실시간 학습 기능에 더해, 모바일 기기에서 저전력으로 학습이 가능할 수 있도록, 저비트 인공지능 학습 방법, 직접 오류 전사 기반 저지연 학습 방식을 제안, 이를 최적화할 수 있는 반도체(HNPU) 와 응용 시스템을 모두 개발했다.
저전력, 실시간 학습을 수행할 수 있는 모바일 인공지능 전용 반도체, HNPU는 다음과 같이 6가지 핵심 기술이 도입됐다.
○ 확률적 동적 고정 소수점 활용 저비트 학습 방식 (SDFXP: Stochastic Dynamic Fixed-point Representation)
- 동적 고정 소수점에 확률적 표현을 결합하고 확률적 반올림을 도입하여 인공지능 학습에 필요한 비트 정밀도를 최소화 할 수 있는 방법
○ 레이어별 자동 정밀도 검색 알고리즘 및 하드웨어 (LAPS: Layer-wise Adaptive Precision Scaling)
- 학습의 난이도를 자동으로 파악하고 심층신경망의 레이어별로 최적의 비트수를 자동으로 찾아주는 알고리즘 및 이를 가속하는 하드웨어
○ 입력 비트 슬라이스 희소성 활용* (ISS: Input Slice Skipping or Bit-slice Level Sparsity Exploitation)
- 데이터를 이진수로 표현했을 때 중간중간 나타나는 ‘0’ 비트를 활용하여, 데이터 처리량을 높이는 방식
○ 내재적 순수 난수 생성기 (iTRNG: Intrinsic True Random Number Generator)
인공지능 연산을 활용한 순수 난수 생성기를 설계, 데이터의 암호화 및 확률적 반올림을 구현
○ 다중 학습 단계 할당을 통한 고속 학습 알고리즘 및 하드웨어 (MLTA: Multi Learning Task Allocation & Backward Unlocking)
기존 역전파 (Back-propagation) 알고리즘에서 탈피해, 직접 오류 전사를 통한 저지연 학습 구현
○ 실시간 인공지능 학습 기반 자동 오류 검출 기능 저하 보정 시스템 개발 (Real-time DNN Training based Automatic Performance Monitor and Performance Recovery System)
평상시 물체 검출 결과를 주기적으로 모니터링하면서, 갑작스러운 확률 변화를 자동으로 인식, 정확도 저하를 보정하기 위해 실시간 학습을 적용
* 희소성 활용 (Sparsity Exploitation) : 심층 신경망 모델의 연산은 수많은 곱셈누적(MAC: Multiply-And-Accumulate)연산의 연속이다. 연산자에 0이 존재할 시, 굳이 연산을 해보지 않아도 결과는 0임을 알기에 이를 뛰어넘는 방식으로 연산 속도를 높이는 방식.
이러한 기술을 사용해 HNPU는 저전력 물체검출을 구현하여, 다른 모바일 물체검출 시스템과 비교해 75% 높은 속도, 44% 낮은 에너지 소모를 달성하면서도, 실시간 학습으로 고정확도 물체검출을 개발해 주목을 받았다.
연구팀은 HNPU의 활용 예시로 카메라 렌즈가 깨지거나, 기계 오류, 조명, 밝기 변화로 인공지능의 추론 능력이 떨어졌을 때, 실시간 학습을 통해 다시 정확도를 높이는 고정확도 물체검출 시스템을 개발했다. 이는 이후 자율 주행, 로봇 등 다양한 곳에 활용될 것으로 기대된다.
특히 연구팀의 HNPU 연구는 2022 국제인공지능회로및시스템학술대회(AICAS 2022)에서 발표돼, 최우수 논문상과 최우수 데모상을 모두 석권하여 그 우수성을 널리 알렸다.
연구를 주도한 KAIST 전기및전자공학부 유회준 교수는 “현재 인공지능은 사전에 학습한 지식만으로 주어진 문제를 해결하고 있으며, 이는 변화하는 환경과 상황에 맞춰 계속 학습하는 인간의 지능과 뚜렷한 차이를 보인다”라며 “이번 연구는 실시간 학습 인공지능 반도체를 통해 인공지능의 지능 수준을 사람 수준으로 한층 더 끌어올리는 연구”라고 본 연구의 의의를 밝혔다.
2022.06.23
조회수 4387
-
 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14
조회수 9023
-
 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23
조회수 5935
-
 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24
조회수 7008
-
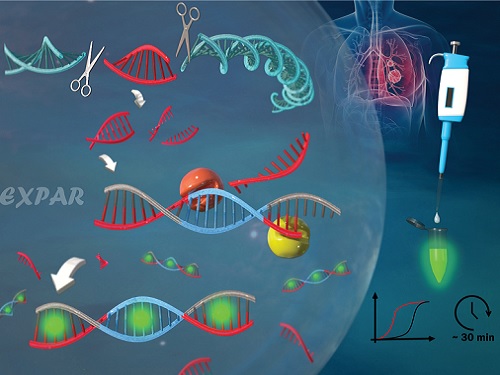 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11
조회수 26798
-
 고접착 패브릭 기반 웨어러블 에너지 하베스팅 기술 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 *핫프레싱 기술을 이용해 가격 경쟁력과 내구성이 높은 패브릭(천) 기반 웨어러블 압전 *에너지 하베스터 제조 방법을 개발하는 데 성공했다고 9일 밝혔다.
☞ 핫프레싱(hot pressing): 온도와 압력을 가해 두 물체를 단단히 점착시키는 공법
☞ 에너지 하베스팅(energy harvesting): 버려지는 에너지를 수집(수확)해 전기로 바꿔 쓰는 기술. 압전 에너지 하베스팅이란 압전체라는 물질을 이용, 생활 주변에서 버려지는 압력과 진동 같은 에너지를 사용 가능한 전기에너지로 변환해주는 것을 말한다.
홍 교수 연구팀 소속 김재규 박사과정 학생이 제1저자로 참여한 이번 연구는 지난 2019년 12월 23일 국내 특허 등록이 됐고, 국제 학술지 '나노 에너지(Nano Energy)' 이번 9월호에 게재됐다(5월 22일 온라인판에 게재). 이번 연구는 DGIST 에너지공학전공 이용민 교수팀과 우리 대학 신소재공학과 노광수·기계공학과 유승화 교수팀과의 협업을 통해 수행됐다. (논문명: Cost-effective and strongly integrated fabric-based wearable piezoelectric energy harvester)
오늘날 웨어러블 소자는 센서, 원동기, 디스플레이에서 에너지 하베스팅에 이르기까지 다양한 응용 분야에서 사용되고 있으며, 4차 산업혁명 도래 이후 소형에서 내장형으로 더욱 급속히 발전하고 있다. 이러한 흐름과 맞물려 기존 옷에 내장형으로 사용될 수 있고, 편안하고 내구성 좋은 패브릭(천)에 기반한 웨어러블 소자가 주목받고 있다.
이러한 장점에도 불구하고, 기존 패브릭 기반 웨어러블 소자는 복잡한 제조 방법과 설비 시설에 따른 공정 및 가격 측면에서 한계를 가져 아직 실용화 단계에 이르지 못하고 있다. 또한, 소자 내의 패브릭과 실제 구동 파트 사이의 결합력 및 효율 테스트의 부재는 소자의 내구성에도 의문을 갖게 한다. 이러한 문제를 보완하기 위해 간단하고 값싼 공정과 재료, 새로운 기계적 특성 분석 기술 등에 관한 연구가 활발히 진행되고 있다.
이번 연구에서는 복잡한 공정 및 설비 시설 대신 비교적 간단한 방법인 핫프레싱을 이용해 전도성 폴리에스터 패브릭과 압전 고분자 필름(Poly(vinylidene fluoride-co-trifluoroethylene), P(VDF-TrFE))이 결합된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 방법을 개발했다. 또한, 기존의 내구성 테스트 방법인 굽힘(bending) 테스트와 더불어 새롭게 도입한 `표면 및 계면 절단 분석시스템(SAICAS, Surface and Interfacial Cutting Analysis System)'을 이용해 패브릭과 고분자 필름 사이 계면 결착력을 측정함으로써 웨어러블 소자의 높은 기계적 내구성을 증명했다.
연구진이 개발한 제조 방법에서 제시하는 핫프레싱은 배터리나 연료전지 셀 제작에 주로 쓰이는 방법으로 2~3분 안에 완료될 정도로 빠르고 간단하며 동시에 높은 접착력을 얻을 수 있는 공정이다. 결정화 온도 근처 이하에서 고분자 필름을 패브릭에 접착시키면, 고분자 필름 표면이 *비정질화되면서 접촉면이 넓은 울퉁불퉁한 패브릭 표면에 빽빽이 접착되고, 날실과 씨실 사이로 새어 나와 못과 같은 형태로 되어 높은 계면 결합력을 가질 수 있게 된다. 이러한 핫프레싱을 이용해 개발된 웨어러블 소자는 기존 의류에 접착할 수 있는 응용 가능성을 가지고 있어 공정 단가를 낮출 수 있을 것으로 기대된다.
☞ 비정질(amorphous): 고체 물질로, 균일한 조성은 가지고 있으나, 원자 배열이 액체와 같이 흐트러져 있는 물질. 유리, 고무, 수지 따위가 있으며 반도체, 자성체, 고강도 재료 따위로 쓴다.
한편, SAICAS를 이용한 계면 결착력 분석은 마이크로 스케일에서 칼날을 이용해 정량적 및 정성적으로 힘을 측정하는 방법으로, 기존 계면 결착력 측정 방법(박리 테스트, 테이프 테스트, 마이크로신축성 테스트)보다 훨씬 정확한 분석 기법으로, 본 연구에서 처음으로 웨어러블 소자에 도입됐다. SAICAS를 이용한 계면 결착력 분석은 향후 고분자를 이용한 웨어러블 소자 내구성 테스트의 새로운 방법으로 쓰일 수 있을 것으로 기대된다.
홍승범 교수는 "본 연구에서 개발된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 기술은 패브릭 기반 소자의 실용화 가능성을 한 단계 높였고, 계면 결착력 분석을 통해 고내구성 웨어러블 소자의 디자인 방향을 제시했다ˮ며 "이 기술은 패브릭과 고분자를 이용한 다른 소자의 제조 공정 및 분석에도 새로운 기틀을 마련할 수 있을 것으로 전망한다ˮ라고 말했다.
이번 연구는 KAIST HRHRP 사업, 과학기술정보통신부 재원 한국연구재단 지원 기초연구사업과 중견연구사업, 웨어러블 플랫폼소재 기술센터 지원 및 KAIST 글로벌 특이점 연구사업 지원으로 수행됐다.
고접착 패브릭 기반 웨어러블 에너지 하베스팅 기술 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 *핫프레싱 기술을 이용해 가격 경쟁력과 내구성이 높은 패브릭(천) 기반 웨어러블 압전 *에너지 하베스터 제조 방법을 개발하는 데 성공했다고 9일 밝혔다.
☞ 핫프레싱(hot pressing): 온도와 압력을 가해 두 물체를 단단히 점착시키는 공법
☞ 에너지 하베스팅(energy harvesting): 버려지는 에너지를 수집(수확)해 전기로 바꿔 쓰는 기술. 압전 에너지 하베스팅이란 압전체라는 물질을 이용, 생활 주변에서 버려지는 압력과 진동 같은 에너지를 사용 가능한 전기에너지로 변환해주는 것을 말한다.
홍 교수 연구팀 소속 김재규 박사과정 학생이 제1저자로 참여한 이번 연구는 지난 2019년 12월 23일 국내 특허 등록이 됐고, 국제 학술지 '나노 에너지(Nano Energy)' 이번 9월호에 게재됐다(5월 22일 온라인판에 게재). 이번 연구는 DGIST 에너지공학전공 이용민 교수팀과 우리 대학 신소재공학과 노광수·기계공학과 유승화 교수팀과의 협업을 통해 수행됐다. (논문명: Cost-effective and strongly integrated fabric-based wearable piezoelectric energy harvester)
오늘날 웨어러블 소자는 센서, 원동기, 디스플레이에서 에너지 하베스팅에 이르기까지 다양한 응용 분야에서 사용되고 있으며, 4차 산업혁명 도래 이후 소형에서 내장형으로 더욱 급속히 발전하고 있다. 이러한 흐름과 맞물려 기존 옷에 내장형으로 사용될 수 있고, 편안하고 내구성 좋은 패브릭(천)에 기반한 웨어러블 소자가 주목받고 있다.
이러한 장점에도 불구하고, 기존 패브릭 기반 웨어러블 소자는 복잡한 제조 방법과 설비 시설에 따른 공정 및 가격 측면에서 한계를 가져 아직 실용화 단계에 이르지 못하고 있다. 또한, 소자 내의 패브릭과 실제 구동 파트 사이의 결합력 및 효율 테스트의 부재는 소자의 내구성에도 의문을 갖게 한다. 이러한 문제를 보완하기 위해 간단하고 값싼 공정과 재료, 새로운 기계적 특성 분석 기술 등에 관한 연구가 활발히 진행되고 있다.
이번 연구에서는 복잡한 공정 및 설비 시설 대신 비교적 간단한 방법인 핫프레싱을 이용해 전도성 폴리에스터 패브릭과 압전 고분자 필름(Poly(vinylidene fluoride-co-trifluoroethylene), P(VDF-TrFE))이 결합된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 방법을 개발했다. 또한, 기존의 내구성 테스트 방법인 굽힘(bending) 테스트와 더불어 새롭게 도입한 `표면 및 계면 절단 분석시스템(SAICAS, Surface and Interfacial Cutting Analysis System)'을 이용해 패브릭과 고분자 필름 사이 계면 결착력을 측정함으로써 웨어러블 소자의 높은 기계적 내구성을 증명했다.
연구진이 개발한 제조 방법에서 제시하는 핫프레싱은 배터리나 연료전지 셀 제작에 주로 쓰이는 방법으로 2~3분 안에 완료될 정도로 빠르고 간단하며 동시에 높은 접착력을 얻을 수 있는 공정이다. 결정화 온도 근처 이하에서 고분자 필름을 패브릭에 접착시키면, 고분자 필름 표면이 *비정질화되면서 접촉면이 넓은 울퉁불퉁한 패브릭 표면에 빽빽이 접착되고, 날실과 씨실 사이로 새어 나와 못과 같은 형태로 되어 높은 계면 결합력을 가질 수 있게 된다. 이러한 핫프레싱을 이용해 개발된 웨어러블 소자는 기존 의류에 접착할 수 있는 응용 가능성을 가지고 있어 공정 단가를 낮출 수 있을 것으로 기대된다.
☞ 비정질(amorphous): 고체 물질로, 균일한 조성은 가지고 있으나, 원자 배열이 액체와 같이 흐트러져 있는 물질. 유리, 고무, 수지 따위가 있으며 반도체, 자성체, 고강도 재료 따위로 쓴다.
한편, SAICAS를 이용한 계면 결착력 분석은 마이크로 스케일에서 칼날을 이용해 정량적 및 정성적으로 힘을 측정하는 방법으로, 기존 계면 결착력 측정 방법(박리 테스트, 테이프 테스트, 마이크로신축성 테스트)보다 훨씬 정확한 분석 기법으로, 본 연구에서 처음으로 웨어러블 소자에 도입됐다. SAICAS를 이용한 계면 결착력 분석은 향후 고분자를 이용한 웨어러블 소자 내구성 테스트의 새로운 방법으로 쓰일 수 있을 것으로 기대된다.
홍승범 교수는 "본 연구에서 개발된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 기술은 패브릭 기반 소자의 실용화 가능성을 한 단계 높였고, 계면 결착력 분석을 통해 고내구성 웨어러블 소자의 디자인 방향을 제시했다ˮ며 "이 기술은 패브릭과 고분자를 이용한 다른 소자의 제조 공정 및 분석에도 새로운 기틀을 마련할 수 있을 것으로 전망한다ˮ라고 말했다.
이번 연구는 KAIST HRHRP 사업, 과학기술정보통신부 재원 한국연구재단 지원 기초연구사업과 중견연구사업, 웨어러블 플랫폼소재 기술센터 지원 및 KAIST 글로벌 특이점 연구사업 지원으로 수행됐다.
2020.09.09
조회수 24484
-
 화학과 박윤수 박사, 화학 분야 신진연구자 상 연달아 수상
〈 박윤수 박사, 장석복 교수 〉
우리 대학 화학과 박윤수 박사가 화학 분야 우수 신진연구자로 연달아 선정되는 성과를 달성했다. 화학 분야 세계 최대 학술단체인 미국화학회(ACS)와 세계 최대 과학출판사인 엘스비어(Elsevier)는 젊은 연구자 상 최종 수상자로 박윤수 박사를 선정했다고 각각 밝혔다.
박 박사는 미국화학회가 지난 5월 15일 발표한 ‘2019 카스 퓨처 리더스(CAS Future Leaders) 최종 명단에 이름을 올렸다. 올해로 10회를 맞이한 카스 퓨처 리더스는 화학 및 관련 연구 분야에서 두각을 드러내고 있는 박사와 박사후연구원에게 주어지는 상이다. 차세대 리더로써 잠재력을 갖춘 연구자를 선정해 네트워킹 등을 지원한다. 올해는 35개국 171명의 지원자 중 29명의 연구자가 최종 선발됐으며 한국인은 박 박사가 유일하다.
엘스비어는 ‘2019 리액시스 PhD 프라이즈(2019 Reaxys PhD Prize)’ 수상자로 박 박사가 선정됐다고 7월 30일 밝혔다. 2010년 출범한 리액시스 프라이즈는 최고 수준(best of the best)의 연구 역량을 갖춘 화학 분야 연구자에게만 수여되는 상으로, 올해는 360여 명의 후보자의 연구성과 및 성장 가능성을 종합적으로 평가해 45명의 수상자를 뽑았다.
최종 수상자들은 ‘리액시스 프라이즈 클럽(Reaxys Prize Club)’의 평생 회원이 돼 화학 분야의 국제적인 석학들과 함께 연구를 공유하며, 공동연구의 기회가 주어진다.
박윤수 박사는 화학과 재학시절부터 장석복 교수 지도하에 새로운 유기화학 반응개발을 중점적으로 연구 해왔다. 또하느 백무현 교수 공동 지도하에 양자 화학적 계산을 이용한 새로운 촉매 설계에 성공하기도 했다.
대표적인 성과로 2018년 국제학술지 ‘사이언스(Science)’와 ‘네이처 카탈리시스(Nature Catalysis)’에 연달아 보고한 연구가 있다. 이 연구를 통해 석유, 천연가스 등 자연에 풍부한 탄화수소로부터 유용한 의약품 및 화학소재 원료 물질인 락탐을 합성하는 데 성공했다. 이 외에도 박사과정으로 재학한 5년 동안 ‘미국화학회지(JACS)’를 포함해 저명한 국제학술지에 11편의 논문을 주저자로 게재했다.
박 박사는 “장석복, 백무현 교수님의 훌륭한 지도와 더불어 중장기적인 관점에서 연구를 지원하는 KAIST, IBS의 정책 덕분에 연구에만 온전히 집중할 수 있었던 것 같다”라며 “향후 유용성에도 불구하고 비싼 가격으로 인해 사용이 어려웠던 촉매의 가격을 낮추는 연구를 진행할 계획”이라고 말했다.
화학과 박윤수 박사, 화학 분야 신진연구자 상 연달아 수상
〈 박윤수 박사, 장석복 교수 〉
우리 대학 화학과 박윤수 박사가 화학 분야 우수 신진연구자로 연달아 선정되는 성과를 달성했다. 화학 분야 세계 최대 학술단체인 미국화학회(ACS)와 세계 최대 과학출판사인 엘스비어(Elsevier)는 젊은 연구자 상 최종 수상자로 박윤수 박사를 선정했다고 각각 밝혔다.
박 박사는 미국화학회가 지난 5월 15일 발표한 ‘2019 카스 퓨처 리더스(CAS Future Leaders) 최종 명단에 이름을 올렸다. 올해로 10회를 맞이한 카스 퓨처 리더스는 화학 및 관련 연구 분야에서 두각을 드러내고 있는 박사와 박사후연구원에게 주어지는 상이다. 차세대 리더로써 잠재력을 갖춘 연구자를 선정해 네트워킹 등을 지원한다. 올해는 35개국 171명의 지원자 중 29명의 연구자가 최종 선발됐으며 한국인은 박 박사가 유일하다.
엘스비어는 ‘2019 리액시스 PhD 프라이즈(2019 Reaxys PhD Prize)’ 수상자로 박 박사가 선정됐다고 7월 30일 밝혔다. 2010년 출범한 리액시스 프라이즈는 최고 수준(best of the best)의 연구 역량을 갖춘 화학 분야 연구자에게만 수여되는 상으로, 올해는 360여 명의 후보자의 연구성과 및 성장 가능성을 종합적으로 평가해 45명의 수상자를 뽑았다.
최종 수상자들은 ‘리액시스 프라이즈 클럽(Reaxys Prize Club)’의 평생 회원이 돼 화학 분야의 국제적인 석학들과 함께 연구를 공유하며, 공동연구의 기회가 주어진다.
박윤수 박사는 화학과 재학시절부터 장석복 교수 지도하에 새로운 유기화학 반응개발을 중점적으로 연구 해왔다. 또하느 백무현 교수 공동 지도하에 양자 화학적 계산을 이용한 새로운 촉매 설계에 성공하기도 했다.
대표적인 성과로 2018년 국제학술지 ‘사이언스(Science)’와 ‘네이처 카탈리시스(Nature Catalysis)’에 연달아 보고한 연구가 있다. 이 연구를 통해 석유, 천연가스 등 자연에 풍부한 탄화수소로부터 유용한 의약품 및 화학소재 원료 물질인 락탐을 합성하는 데 성공했다. 이 외에도 박사과정으로 재학한 5년 동안 ‘미국화학회지(JACS)’를 포함해 저명한 국제학술지에 11편의 논문을 주저자로 게재했다.
박 박사는 “장석복, 백무현 교수님의 훌륭한 지도와 더불어 중장기적인 관점에서 연구를 지원하는 KAIST, IBS의 정책 덕분에 연구에만 온전히 집중할 수 있었던 것 같다”라며 “향후 유용성에도 불구하고 비싼 가격으로 인해 사용이 어려웠던 촉매의 가격을 낮추는 연구를 진행할 계획”이라고 말했다.
2019.08.02
조회수 11229
-
 이지현 교수, CAADRIA 학회 사사다 상 수상
〈 이지현 교수 〉
우리 대학 문화기술대학원 이지현 교수가 15일 뉴질랜드 웰링턴에서 열린 컴퓨터 기반 건축 디자인 분야 국제학회 ‘CAADRIA 2019(the 24th Annual Conference of the Association for Computer-Aided Architectural Design Research in Asia)’에서 사사다 상(Sasada Prize)을 받았다.
건축 디자인 관련 세계 최고 학회 중 하나인 CAADRIA가 2007년 츠요시 사사다(Tsuyoshi Sasada, 1941-2005) 교수를 기리기 위해 제정한 사사다 상(Sasada Award)은 컴퓨터 보조 설계 차세대 연구자들을 지원하기 위한 CAADRIA의 미션 중 하나이다. 해당 분야 커뮤니티에 지속적인 공헌을 하고 탁월한 연구 성과를 낸 연구자에게 수여된다.
수상자인 이지현 교수는 최민규, 김미래 석사과정, 이태하 박사과정과 함께 연구한 ‘사례기반추론을 통한 부동산 지가 예측 시스템 (Land Price Prediction System Using Case-based Reasoning)’ 연구를 기반으로 그동안 CAAD (Computer-Aided Architectural Design) 분야에 기여한 점을 인정받아 2019년 수상자로 선정됐다.
이지현 교수는 해당 연구를 통해 서울특별시와 울산광역시를 제외한 6대 광역시로부터 40여 개 변수를 행정동 단위로 수집한 후 사례기반 추론 방법을 적용해 행정동 내의 평균 평당 아파트 가격을 예측하는 모델을 제시했다. 연구팀이 도출한 모델의 후속연구가 수행되면 기존의 전문가 판단을 대체할 수 있을 것이라는 가능성을 보여줬다.
이지현 교수는 수상 관련 연구 내용인 추천과 예측을 할 수 있는 인공지능의 한 분야인 사례기반추론(Case Based Reasoning)관련 2002년 졸업논문부터 근 20년간 꾸준하게 연구를 진행해 왔으며, CBR 관련 국내외 논문 40여 편을 발표한 바 있다.
이지현 교수는 “CAAD 관련 연구자에게 자랑스러운 상을 받게 돼 개인적으로는 매우 큰 영광이라 생각하지만 지난 수상자들을 볼 때 과분하다는 생각도 든다”라며 “6월 KAIST에서 열리는 ‘CAAD Futures 2019’가 성공적으로 이뤄질 수 있도록 준비함과 동시에 앞으로도 꾸준하게 CAAD 및 컴퓨테이셔널 디자인 연구를 선보여 국내외에서 KAIST의 위상을 높이는데 기여하겠다”라고 말했다.
이지현 교수, CAADRIA 학회 사사다 상 수상
〈 이지현 교수 〉
우리 대학 문화기술대학원 이지현 교수가 15일 뉴질랜드 웰링턴에서 열린 컴퓨터 기반 건축 디자인 분야 국제학회 ‘CAADRIA 2019(the 24th Annual Conference of the Association for Computer-Aided Architectural Design Research in Asia)’에서 사사다 상(Sasada Prize)을 받았다.
건축 디자인 관련 세계 최고 학회 중 하나인 CAADRIA가 2007년 츠요시 사사다(Tsuyoshi Sasada, 1941-2005) 교수를 기리기 위해 제정한 사사다 상(Sasada Award)은 컴퓨터 보조 설계 차세대 연구자들을 지원하기 위한 CAADRIA의 미션 중 하나이다. 해당 분야 커뮤니티에 지속적인 공헌을 하고 탁월한 연구 성과를 낸 연구자에게 수여된다.
수상자인 이지현 교수는 최민규, 김미래 석사과정, 이태하 박사과정과 함께 연구한 ‘사례기반추론을 통한 부동산 지가 예측 시스템 (Land Price Prediction System Using Case-based Reasoning)’ 연구를 기반으로 그동안 CAAD (Computer-Aided Architectural Design) 분야에 기여한 점을 인정받아 2019년 수상자로 선정됐다.
이지현 교수는 해당 연구를 통해 서울특별시와 울산광역시를 제외한 6대 광역시로부터 40여 개 변수를 행정동 단위로 수집한 후 사례기반 추론 방법을 적용해 행정동 내의 평균 평당 아파트 가격을 예측하는 모델을 제시했다. 연구팀이 도출한 모델의 후속연구가 수행되면 기존의 전문가 판단을 대체할 수 있을 것이라는 가능성을 보여줬다.
이지현 교수는 수상 관련 연구 내용인 추천과 예측을 할 수 있는 인공지능의 한 분야인 사례기반추론(Case Based Reasoning)관련 2002년 졸업논문부터 근 20년간 꾸준하게 연구를 진행해 왔으며, CBR 관련 국내외 논문 40여 편을 발표한 바 있다.
이지현 교수는 “CAAD 관련 연구자에게 자랑스러운 상을 받게 돼 개인적으로는 매우 큰 영광이라 생각하지만 지난 수상자들을 볼 때 과분하다는 생각도 든다”라며 “6월 KAIST에서 열리는 ‘CAAD Futures 2019’가 성공적으로 이뤄질 수 있도록 준비함과 동시에 앞으로도 꾸준하게 CAAD 및 컴퓨테이셔널 디자인 연구를 선보여 국내외에서 KAIST의 위상을 높이는데 기여하겠다”라고 말했다.
2019.04.19
조회수 10264
-
 강성모 총장, 존 쵸마 교육상 수상
강성모 총장이 26일(화) 오후(현지시간) 포르투갈 리스본 벨럼컨벤션센터에서 열린 ′회로 및 시스템학회 학술대회(IEEE-ISCAS 2015)′에서 존 쵸마 교육상을 수상했다.
존 쵸마(John Choma)교육상은 회로 및 시스템 분야의 교육발전에 기여한 자에게 수여하는 상으로 ′전기전자공학자협회 소속 회로 및 시스템 학회(IEEE-CAS)′가 회원들 중에서 그 수상자를 선발한다.
강 총장은 지난 40여 년 동안 대학에 근무하면서 회로 및 시스템 분야 박사 60여명을 배출하고 450여 편의 논문을 발표해 교육 전문가로서의 리더십을 인정받았다.
IEEE-CAS가 수여하는 봉사상, 학술상, 학회 최고상을 수상한 바 있는 강 총장은 이번 수상으로 네 번째 수상의 영예를 안았다.
한편, 강 총장은 이날 심포지엄의 특별 세션에 참석해 ‘멤리스터 기반의 시냅시스와 뇌 모방 컴퓨팅 기술을 위한 신경세포’를 주제로 논문도 발표했다. 끝.
강성모 총장, 존 쵸마 교육상 수상
강성모 총장이 26일(화) 오후(현지시간) 포르투갈 리스본 벨럼컨벤션센터에서 열린 ′회로 및 시스템학회 학술대회(IEEE-ISCAS 2015)′에서 존 쵸마 교육상을 수상했다.
존 쵸마(John Choma)교육상은 회로 및 시스템 분야의 교육발전에 기여한 자에게 수여하는 상으로 ′전기전자공학자협회 소속 회로 및 시스템 학회(IEEE-CAS)′가 회원들 중에서 그 수상자를 선발한다.
강 총장은 지난 40여 년 동안 대학에 근무하면서 회로 및 시스템 분야 박사 60여명을 배출하고 450여 편의 논문을 발표해 교육 전문가로서의 리더십을 인정받았다.
IEEE-CAS가 수여하는 봉사상, 학술상, 학회 최고상을 수상한 바 있는 강 총장은 이번 수상으로 네 번째 수상의 영예를 안았다.
한편, 강 총장은 이날 심포지엄의 특별 세션에 참석해 ‘멤리스터 기반의 시냅시스와 뇌 모방 컴퓨팅 기술을 위한 신경세포’를 주제로 논문도 발표했다. 끝.
2015.05.27
조회수 7219
 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 1549
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 1549 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 2793
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 2793 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 5619
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 5619 고정확도 실시간 학습 가능한 모바일 인공지능 반도체 칩 세계 최초 개발
우리 대학 전기및전자공학부 유회준 교수 연구팀이 인공지능의 실시간 학습을 모바일 기기에서 구현, 고정확도 인공지능(AI: Artificial Intelligent) 반도체*를 세계 최초로 개발했다고 23일 밝혔다.
* 인공지능 반도체 : 인식·추론·학습·판단 등 인공지능 처리 기능을 탑재하고, 초지능·초저전력·초신뢰 기반의 최적화된 기술로 구현한 반도체
연구팀이 개발한 인공지능 반도체는 저비트 학습과 저지연 학습 방식을 적용해, 모바일 기기에서도 학습할 수 있다. 특히 이번 반도체 칩은 인공지능의 예상치 못한 성능 저하를 막을 수 있는 실시간 학습 기술을 성공적으로 구현했다.
전기및전자공학부 한동현 박사과정이 제1 저자로 참여한 이번 연구는 지난 6월 12일부터 15일까지 인천 연수구 송도 컨벤시아에서 개최된 국제 인공지능 회로 및 시스템 학술대회(AICAS)에서 발표됐으며 응용 예시를 현장에서 시연했고, 최우수 논문상과 최우수 데모상을 모두 석권해 그 우수성을 널리 알렸다. (논문명 : A 0.95 mJ/frame DNN Training Processor for Robust Object Detection with Real-World Environmental Adaptation (저자: 한동현, 임동석, 박광태, 김영우, 송석찬, 이주형, 유회준))
인공지능 (AI) 반도체 기술을 망라하는 국제 학술 대회 ‘AICAS 2022’는 인공지능 반도체 분야 세계 최고 권위를 가진 IEEE(미국 전기 전자 기술자 협회)학회로 평가받으며, 삼성, SK를 필두로, 한국전자통신연구원(ETRI), 엔비디아(NVIDIA), 케이던스(Cadence) 등 국내외 저명한 기업과 기관 등이 참석해 인공지능 반도체 회로와 시스템 전 분야, 인공지능 반도체와 관련된 연구성과를 공유하는 행사다.
기존 인공지능은 사전에 학습된 지능만으로 추론을 진행했기 때문에 학습하지 않은 새로운 환경 혹은 물체에 대해서는 물체 검출이 어려웠다. 하지만 유회준 교수 연구팀이 개발한 실시간 학습은 추론만 수행하던 기존 모바일 인공지능 반도체에 학습 기능을 부여함으로써, 인공지능의 지능 수준을 크게 끌어올렸다.
유 교수팀의 새로운 인공지능 반도체는 사전에 학습한 지식과 애플리케이션 수행 중에 학습한 지식을 함께 활용해 고정확도 물체검출 성능을 보였다. 특히 유회준 교수 연구팀은 렌즈가 깨지거나, 기계 오류로 인한 인공지능의 예상치 못한 정확도 감소도 자동으로 인지하고 이를 실시간 학습을 통해 보정, 기존 인공지능의 문제점을 해결했다.
유 교수팀은 실시간 학습 기능에 더해, 모바일 기기에서 저전력으로 학습이 가능할 수 있도록, 저비트 인공지능 학습 방법, 직접 오류 전사 기반 저지연 학습 방식을 제안, 이를 최적화할 수 있는 반도체(HNPU) 와 응용 시스템을 모두 개발했다.
저전력, 실시간 학습을 수행할 수 있는 모바일 인공지능 전용 반도체, HNPU는 다음과 같이 6가지 핵심 기술이 도입됐다.
○ 확률적 동적 고정 소수점 활용 저비트 학습 방식 (SDFXP: Stochastic Dynamic Fixed-point Representation)
- 동적 고정 소수점에 확률적 표현을 결합하고 확률적 반올림을 도입하여 인공지능 학습에 필요한 비트 정밀도를 최소화 할 수 있는 방법
○ 레이어별 자동 정밀도 검색 알고리즘 및 하드웨어 (LAPS: Layer-wise Adaptive Precision Scaling)
- 학습의 난이도를 자동으로 파악하고 심층신경망의 레이어별로 최적의 비트수를 자동으로 찾아주는 알고리즘 및 이를 가속하는 하드웨어
○ 입력 비트 슬라이스 희소성 활용* (ISS: Input Slice Skipping or Bit-slice Level Sparsity Exploitation)
- 데이터를 이진수로 표현했을 때 중간중간 나타나는 ‘0’ 비트를 활용하여, 데이터 처리량을 높이는 방식
○ 내재적 순수 난수 생성기 (iTRNG: Intrinsic True Random Number Generator)
인공지능 연산을 활용한 순수 난수 생성기를 설계, 데이터의 암호화 및 확률적 반올림을 구현
○ 다중 학습 단계 할당을 통한 고속 학습 알고리즘 및 하드웨어 (MLTA: Multi Learning Task Allocation & Backward Unlocking)
기존 역전파 (Back-propagation) 알고리즘에서 탈피해, 직접 오류 전사를 통한 저지연 학습 구현
○ 실시간 인공지능 학습 기반 자동 오류 검출 기능 저하 보정 시스템 개발 (Real-time DNN Training based Automatic Performance Monitor and Performance Recovery System)
평상시 물체 검출 결과를 주기적으로 모니터링하면서, 갑작스러운 확률 변화를 자동으로 인식, 정확도 저하를 보정하기 위해 실시간 학습을 적용
* 희소성 활용 (Sparsity Exploitation) : 심층 신경망 모델의 연산은 수많은 곱셈누적(MAC: Multiply-And-Accumulate)연산의 연속이다. 연산자에 0이 존재할 시, 굳이 연산을 해보지 않아도 결과는 0임을 알기에 이를 뛰어넘는 방식으로 연산 속도를 높이는 방식.
이러한 기술을 사용해 HNPU는 저전력 물체검출을 구현하여, 다른 모바일 물체검출 시스템과 비교해 75% 높은 속도, 44% 낮은 에너지 소모를 달성하면서도, 실시간 학습으로 고정확도 물체검출을 개발해 주목을 받았다.
연구팀은 HNPU의 활용 예시로 카메라 렌즈가 깨지거나, 기계 오류, 조명, 밝기 변화로 인공지능의 추론 능력이 떨어졌을 때, 실시간 학습을 통해 다시 정확도를 높이는 고정확도 물체검출 시스템을 개발했다. 이는 이후 자율 주행, 로봇 등 다양한 곳에 활용될 것으로 기대된다.
특히 연구팀의 HNPU 연구는 2022 국제인공지능회로및시스템학술대회(AICAS 2022)에서 발표돼, 최우수 논문상과 최우수 데모상을 모두 석권하여 그 우수성을 널리 알렸다.
연구를 주도한 KAIST 전기및전자공학부 유회준 교수는 “현재 인공지능은 사전에 학습한 지식만으로 주어진 문제를 해결하고 있으며, 이는 변화하는 환경과 상황에 맞춰 계속 학습하는 인간의 지능과 뚜렷한 차이를 보인다”라며 “이번 연구는 실시간 학습 인공지능 반도체를 통해 인공지능의 지능 수준을 사람 수준으로 한층 더 끌어올리는 연구”라고 본 연구의 의의를 밝혔다.
2022.06.23 조회수 4387
고정확도 실시간 학습 가능한 모바일 인공지능 반도체 칩 세계 최초 개발
우리 대학 전기및전자공학부 유회준 교수 연구팀이 인공지능의 실시간 학습을 모바일 기기에서 구현, 고정확도 인공지능(AI: Artificial Intelligent) 반도체*를 세계 최초로 개발했다고 23일 밝혔다.
* 인공지능 반도체 : 인식·추론·학습·판단 등 인공지능 처리 기능을 탑재하고, 초지능·초저전력·초신뢰 기반의 최적화된 기술로 구현한 반도체
연구팀이 개발한 인공지능 반도체는 저비트 학습과 저지연 학습 방식을 적용해, 모바일 기기에서도 학습할 수 있다. 특히 이번 반도체 칩은 인공지능의 예상치 못한 성능 저하를 막을 수 있는 실시간 학습 기술을 성공적으로 구현했다.
전기및전자공학부 한동현 박사과정이 제1 저자로 참여한 이번 연구는 지난 6월 12일부터 15일까지 인천 연수구 송도 컨벤시아에서 개최된 국제 인공지능 회로 및 시스템 학술대회(AICAS)에서 발표됐으며 응용 예시를 현장에서 시연했고, 최우수 논문상과 최우수 데모상을 모두 석권해 그 우수성을 널리 알렸다. (논문명 : A 0.95 mJ/frame DNN Training Processor for Robust Object Detection with Real-World Environmental Adaptation (저자: 한동현, 임동석, 박광태, 김영우, 송석찬, 이주형, 유회준))
인공지능 (AI) 반도체 기술을 망라하는 국제 학술 대회 ‘AICAS 2022’는 인공지능 반도체 분야 세계 최고 권위를 가진 IEEE(미국 전기 전자 기술자 협회)학회로 평가받으며, 삼성, SK를 필두로, 한국전자통신연구원(ETRI), 엔비디아(NVIDIA), 케이던스(Cadence) 등 국내외 저명한 기업과 기관 등이 참석해 인공지능 반도체 회로와 시스템 전 분야, 인공지능 반도체와 관련된 연구성과를 공유하는 행사다.
기존 인공지능은 사전에 학습된 지능만으로 추론을 진행했기 때문에 학습하지 않은 새로운 환경 혹은 물체에 대해서는 물체 검출이 어려웠다. 하지만 유회준 교수 연구팀이 개발한 실시간 학습은 추론만 수행하던 기존 모바일 인공지능 반도체에 학습 기능을 부여함으로써, 인공지능의 지능 수준을 크게 끌어올렸다.
유 교수팀의 새로운 인공지능 반도체는 사전에 학습한 지식과 애플리케이션 수행 중에 학습한 지식을 함께 활용해 고정확도 물체검출 성능을 보였다. 특히 유회준 교수 연구팀은 렌즈가 깨지거나, 기계 오류로 인한 인공지능의 예상치 못한 정확도 감소도 자동으로 인지하고 이를 실시간 학습을 통해 보정, 기존 인공지능의 문제점을 해결했다.
유 교수팀은 실시간 학습 기능에 더해, 모바일 기기에서 저전력으로 학습이 가능할 수 있도록, 저비트 인공지능 학습 방법, 직접 오류 전사 기반 저지연 학습 방식을 제안, 이를 최적화할 수 있는 반도체(HNPU) 와 응용 시스템을 모두 개발했다.
저전력, 실시간 학습을 수행할 수 있는 모바일 인공지능 전용 반도체, HNPU는 다음과 같이 6가지 핵심 기술이 도입됐다.
○ 확률적 동적 고정 소수점 활용 저비트 학습 방식 (SDFXP: Stochastic Dynamic Fixed-point Representation)
- 동적 고정 소수점에 확률적 표현을 결합하고 확률적 반올림을 도입하여 인공지능 학습에 필요한 비트 정밀도를 최소화 할 수 있는 방법
○ 레이어별 자동 정밀도 검색 알고리즘 및 하드웨어 (LAPS: Layer-wise Adaptive Precision Scaling)
- 학습의 난이도를 자동으로 파악하고 심층신경망의 레이어별로 최적의 비트수를 자동으로 찾아주는 알고리즘 및 이를 가속하는 하드웨어
○ 입력 비트 슬라이스 희소성 활용* (ISS: Input Slice Skipping or Bit-slice Level Sparsity Exploitation)
- 데이터를 이진수로 표현했을 때 중간중간 나타나는 ‘0’ 비트를 활용하여, 데이터 처리량을 높이는 방식
○ 내재적 순수 난수 생성기 (iTRNG: Intrinsic True Random Number Generator)
인공지능 연산을 활용한 순수 난수 생성기를 설계, 데이터의 암호화 및 확률적 반올림을 구현
○ 다중 학습 단계 할당을 통한 고속 학습 알고리즘 및 하드웨어 (MLTA: Multi Learning Task Allocation & Backward Unlocking)
기존 역전파 (Back-propagation) 알고리즘에서 탈피해, 직접 오류 전사를 통한 저지연 학습 구현
○ 실시간 인공지능 학습 기반 자동 오류 검출 기능 저하 보정 시스템 개발 (Real-time DNN Training based Automatic Performance Monitor and Performance Recovery System)
평상시 물체 검출 결과를 주기적으로 모니터링하면서, 갑작스러운 확률 변화를 자동으로 인식, 정확도 저하를 보정하기 위해 실시간 학습을 적용
* 희소성 활용 (Sparsity Exploitation) : 심층 신경망 모델의 연산은 수많은 곱셈누적(MAC: Multiply-And-Accumulate)연산의 연속이다. 연산자에 0이 존재할 시, 굳이 연산을 해보지 않아도 결과는 0임을 알기에 이를 뛰어넘는 방식으로 연산 속도를 높이는 방식.
이러한 기술을 사용해 HNPU는 저전력 물체검출을 구현하여, 다른 모바일 물체검출 시스템과 비교해 75% 높은 속도, 44% 낮은 에너지 소모를 달성하면서도, 실시간 학습으로 고정확도 물체검출을 개발해 주목을 받았다.
연구팀은 HNPU의 활용 예시로 카메라 렌즈가 깨지거나, 기계 오류, 조명, 밝기 변화로 인공지능의 추론 능력이 떨어졌을 때, 실시간 학습을 통해 다시 정확도를 높이는 고정확도 물체검출 시스템을 개발했다. 이는 이후 자율 주행, 로봇 등 다양한 곳에 활용될 것으로 기대된다.
특히 연구팀의 HNPU 연구는 2022 국제인공지능회로및시스템학술대회(AICAS 2022)에서 발표돼, 최우수 논문상과 최우수 데모상을 모두 석권하여 그 우수성을 널리 알렸다.
연구를 주도한 KAIST 전기및전자공학부 유회준 교수는 “현재 인공지능은 사전에 학습한 지식만으로 주어진 문제를 해결하고 있으며, 이는 변화하는 환경과 상황에 맞춰 계속 학습하는 인간의 지능과 뚜렷한 차이를 보인다”라며 “이번 연구는 실시간 학습 인공지능 반도체를 통해 인공지능의 지능 수준을 사람 수준으로 한층 더 끌어올리는 연구”라고 본 연구의 의의를 밝혔다.
2022.06.23 조회수 4387 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 9023
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 9023 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 5935
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 5935 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 7008
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 7008 유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 26798
유전자 가위를 이용한 새로운 유전자 돌연변이 검출 기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 유전자 가위로 불리는 *크리스퍼(CRISPR-Cas9) 시스템에 의해서 구동되는 *EXPAR 반응을 이용해 유전자 돌연변이를 검출하는 신기술을 개발했다고 11일 밝혔다.
☞ 크리스퍼 (CRISPR-Cas9): 유전자 편집 기술로 DNA를 가위로 자르듯이 특정 부위를 자를 수 있으며, 가이드 RNA(guideRNA)와 Cas9 단백질로 구성된다. 안내자 역할을 하는 guideRNA가 특정 유전자의 위치를 찾아가는 역할을 하고, Cas9 단백질이 유전자를 잘라내는 가위 역할을 한다.
☞ EXPAR: 엑스파(Exponential amplification reaction, EXPAR) 기술은 약 30분의 짧은 반응 시간 내 최대 1억(108)배의 표적 핵산 증폭 효율을 구현함으로써, 높은 활용 가능성을 보유한 기술이다. 구체적으로, EXPAR 기술은 절단 효소 인식 염기서열(템플릿의 중심)과 표적 핵산 상보 염기서열(템플릿의 양 말단)이 수식된 템플릿과 표적 핵산의 혼성화 반응 후, 절단 효소와 DNA 중합 효소의 작용으로 인해 이중가닥 DNA 산물이 지수함수적으로 증폭되는 기술이다.
우리 대학 생명화학공학과 송자연, 김수현 박사가 공동 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제학술지 `나노스케일 (Nanoscale)'에 2021년도 15호 표지(Back cover) 논문으로 지난달 14일 선정됐다. (논문명: A novel method to detect mutation in DNA by utilizing exponential amplification reaction triggered by the CRISPR-Cas9 system)
일반적으로 유전자 돌연변이를 검출하기 위해 중합 효소 연쇄 반응(PCR)을 이용한다. 하지만, 현재까지 개발된 유전자 돌연변이 검출기술들은 낮은 특이도, 낮은 검출 성능, 복잡한 검출 방법, 긴 검출 시간 등의 단점들을 지니고 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해서, 크리스퍼 (CRISPR-Cas9) 시스템을 활용해 검출 특이도를 높이고 EXPAR 등온 증폭 반응을 통해 검출 민감도를 크게 향상시켜서 표적 유전자 돌연변이를 고감도로(검출 한계: 437 aM (아토몰라, Attomolar)) 30분 이내에 검출하는 데 성공했다. 이는 기존 기술 대비 증폭효율 약 10만 배 증가, 검출 시간 약 50% 감소에 해당하는 수치다.
연구팀은 2개의 Cas9/sgRNA 복합체로 구성된 크리스퍼(CRISPR-Cas9) 시스템으로 유전자 돌연변이의 양 끝단을 절단했다. 절단된 짧은 이중 나선 유전자 돌연변이가 EXPAR 반응을 구동시키고 EXPAR 반응 생성물을 통해서 형광 신호가 발생하도록 설계함으로써 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다.
연구팀은 이 기술을 통해서, 염색체 DNA 내 HER2와 EGFR 유전자 돌연변이를 성공적으로 검출할 수 있었다. 이러한 유전자 돌연변이는 유방암 및 폐암의 발생에 관여할 뿐만 아니라 특정 치료 약제에 대한 반응을 예측하기 위해서 대표적으로 활용되는 중요한 바이오 마커다.
박현규 교수는 "이번 기술은 CRISPR-Cas9 시스템에 크리스퍼 (CRISPR-Cas9) 시스템에 의해서 구동되는 EXPAR 반응을 이용하여 암 등 다양한 질병에 관여되는 유전자 돌연변이를 고감도로 검출함으로써, 다양한 질병을 조기 진단하고 환자 맞춤형 치료를 구현하는 데 크게 활용될 수 있다ˮ라고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 지원을 받아 중견연구자지원사업과 글로벌 프런티어지원사업의 일환으로 수행됐다.
2021.05.11 조회수 26798 고접착 패브릭 기반 웨어러블 에너지 하베스팅 기술 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 *핫프레싱 기술을 이용해 가격 경쟁력과 내구성이 높은 패브릭(천) 기반 웨어러블 압전 *에너지 하베스터 제조 방법을 개발하는 데 성공했다고 9일 밝혔다.
☞ 핫프레싱(hot pressing): 온도와 압력을 가해 두 물체를 단단히 점착시키는 공법
☞ 에너지 하베스팅(energy harvesting): 버려지는 에너지를 수집(수확)해 전기로 바꿔 쓰는 기술. 압전 에너지 하베스팅이란 압전체라는 물질을 이용, 생활 주변에서 버려지는 압력과 진동 같은 에너지를 사용 가능한 전기에너지로 변환해주는 것을 말한다.
홍 교수 연구팀 소속 김재규 박사과정 학생이 제1저자로 참여한 이번 연구는 지난 2019년 12월 23일 국내 특허 등록이 됐고, 국제 학술지 '나노 에너지(Nano Energy)' 이번 9월호에 게재됐다(5월 22일 온라인판에 게재). 이번 연구는 DGIST 에너지공학전공 이용민 교수팀과 우리 대학 신소재공학과 노광수·기계공학과 유승화 교수팀과의 협업을 통해 수행됐다. (논문명: Cost-effective and strongly integrated fabric-based wearable piezoelectric energy harvester)
오늘날 웨어러블 소자는 센서, 원동기, 디스플레이에서 에너지 하베스팅에 이르기까지 다양한 응용 분야에서 사용되고 있으며, 4차 산업혁명 도래 이후 소형에서 내장형으로 더욱 급속히 발전하고 있다. 이러한 흐름과 맞물려 기존 옷에 내장형으로 사용될 수 있고, 편안하고 내구성 좋은 패브릭(천)에 기반한 웨어러블 소자가 주목받고 있다.
이러한 장점에도 불구하고, 기존 패브릭 기반 웨어러블 소자는 복잡한 제조 방법과 설비 시설에 따른 공정 및 가격 측면에서 한계를 가져 아직 실용화 단계에 이르지 못하고 있다. 또한, 소자 내의 패브릭과 실제 구동 파트 사이의 결합력 및 효율 테스트의 부재는 소자의 내구성에도 의문을 갖게 한다. 이러한 문제를 보완하기 위해 간단하고 값싼 공정과 재료, 새로운 기계적 특성 분석 기술 등에 관한 연구가 활발히 진행되고 있다.
이번 연구에서는 복잡한 공정 및 설비 시설 대신 비교적 간단한 방법인 핫프레싱을 이용해 전도성 폴리에스터 패브릭과 압전 고분자 필름(Poly(vinylidene fluoride-co-trifluoroethylene), P(VDF-TrFE))이 결합된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 방법을 개발했다. 또한, 기존의 내구성 테스트 방법인 굽힘(bending) 테스트와 더불어 새롭게 도입한 `표면 및 계면 절단 분석시스템(SAICAS, Surface and Interfacial Cutting Analysis System)'을 이용해 패브릭과 고분자 필름 사이 계면 결착력을 측정함으로써 웨어러블 소자의 높은 기계적 내구성을 증명했다.
연구진이 개발한 제조 방법에서 제시하는 핫프레싱은 배터리나 연료전지 셀 제작에 주로 쓰이는 방법으로 2~3분 안에 완료될 정도로 빠르고 간단하며 동시에 높은 접착력을 얻을 수 있는 공정이다. 결정화 온도 근처 이하에서 고분자 필름을 패브릭에 접착시키면, 고분자 필름 표면이 *비정질화되면서 접촉면이 넓은 울퉁불퉁한 패브릭 표면에 빽빽이 접착되고, 날실과 씨실 사이로 새어 나와 못과 같은 형태로 되어 높은 계면 결합력을 가질 수 있게 된다. 이러한 핫프레싱을 이용해 개발된 웨어러블 소자는 기존 의류에 접착할 수 있는 응용 가능성을 가지고 있어 공정 단가를 낮출 수 있을 것으로 기대된다.
☞ 비정질(amorphous): 고체 물질로, 균일한 조성은 가지고 있으나, 원자 배열이 액체와 같이 흐트러져 있는 물질. 유리, 고무, 수지 따위가 있으며 반도체, 자성체, 고강도 재료 따위로 쓴다.
한편, SAICAS를 이용한 계면 결착력 분석은 마이크로 스케일에서 칼날을 이용해 정량적 및 정성적으로 힘을 측정하는 방법으로, 기존 계면 결착력 측정 방법(박리 테스트, 테이프 테스트, 마이크로신축성 테스트)보다 훨씬 정확한 분석 기법으로, 본 연구에서 처음으로 웨어러블 소자에 도입됐다. SAICAS를 이용한 계면 결착력 분석은 향후 고분자를 이용한 웨어러블 소자 내구성 테스트의 새로운 방법으로 쓰일 수 있을 것으로 기대된다.
홍승범 교수는 "본 연구에서 개발된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 기술은 패브릭 기반 소자의 실용화 가능성을 한 단계 높였고, 계면 결착력 분석을 통해 고내구성 웨어러블 소자의 디자인 방향을 제시했다ˮ며 "이 기술은 패브릭과 고분자를 이용한 다른 소자의 제조 공정 및 분석에도 새로운 기틀을 마련할 수 있을 것으로 전망한다ˮ라고 말했다.
이번 연구는 KAIST HRHRP 사업, 과학기술정보통신부 재원 한국연구재단 지원 기초연구사업과 중견연구사업, 웨어러블 플랫폼소재 기술센터 지원 및 KAIST 글로벌 특이점 연구사업 지원으로 수행됐다.
2020.09.09 조회수 24484
고접착 패브릭 기반 웨어러블 에너지 하베스팅 기술 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 *핫프레싱 기술을 이용해 가격 경쟁력과 내구성이 높은 패브릭(천) 기반 웨어러블 압전 *에너지 하베스터 제조 방법을 개발하는 데 성공했다고 9일 밝혔다.
☞ 핫프레싱(hot pressing): 온도와 압력을 가해 두 물체를 단단히 점착시키는 공법
☞ 에너지 하베스팅(energy harvesting): 버려지는 에너지를 수집(수확)해 전기로 바꿔 쓰는 기술. 압전 에너지 하베스팅이란 압전체라는 물질을 이용, 생활 주변에서 버려지는 압력과 진동 같은 에너지를 사용 가능한 전기에너지로 변환해주는 것을 말한다.
홍 교수 연구팀 소속 김재규 박사과정 학생이 제1저자로 참여한 이번 연구는 지난 2019년 12월 23일 국내 특허 등록이 됐고, 국제 학술지 '나노 에너지(Nano Energy)' 이번 9월호에 게재됐다(5월 22일 온라인판에 게재). 이번 연구는 DGIST 에너지공학전공 이용민 교수팀과 우리 대학 신소재공학과 노광수·기계공학과 유승화 교수팀과의 협업을 통해 수행됐다. (논문명: Cost-effective and strongly integrated fabric-based wearable piezoelectric energy harvester)
오늘날 웨어러블 소자는 센서, 원동기, 디스플레이에서 에너지 하베스팅에 이르기까지 다양한 응용 분야에서 사용되고 있으며, 4차 산업혁명 도래 이후 소형에서 내장형으로 더욱 급속히 발전하고 있다. 이러한 흐름과 맞물려 기존 옷에 내장형으로 사용될 수 있고, 편안하고 내구성 좋은 패브릭(천)에 기반한 웨어러블 소자가 주목받고 있다.
이러한 장점에도 불구하고, 기존 패브릭 기반 웨어러블 소자는 복잡한 제조 방법과 설비 시설에 따른 공정 및 가격 측면에서 한계를 가져 아직 실용화 단계에 이르지 못하고 있다. 또한, 소자 내의 패브릭과 실제 구동 파트 사이의 결합력 및 효율 테스트의 부재는 소자의 내구성에도 의문을 갖게 한다. 이러한 문제를 보완하기 위해 간단하고 값싼 공정과 재료, 새로운 기계적 특성 분석 기술 등에 관한 연구가 활발히 진행되고 있다.
이번 연구에서는 복잡한 공정 및 설비 시설 대신 비교적 간단한 방법인 핫프레싱을 이용해 전도성 폴리에스터 패브릭과 압전 고분자 필름(Poly(vinylidene fluoride-co-trifluoroethylene), P(VDF-TrFE))이 결합된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 방법을 개발했다. 또한, 기존의 내구성 테스트 방법인 굽힘(bending) 테스트와 더불어 새롭게 도입한 `표면 및 계면 절단 분석시스템(SAICAS, Surface and Interfacial Cutting Analysis System)'을 이용해 패브릭과 고분자 필름 사이 계면 결착력을 측정함으로써 웨어러블 소자의 높은 기계적 내구성을 증명했다.
연구진이 개발한 제조 방법에서 제시하는 핫프레싱은 배터리나 연료전지 셀 제작에 주로 쓰이는 방법으로 2~3분 안에 완료될 정도로 빠르고 간단하며 동시에 높은 접착력을 얻을 수 있는 공정이다. 결정화 온도 근처 이하에서 고분자 필름을 패브릭에 접착시키면, 고분자 필름 표면이 *비정질화되면서 접촉면이 넓은 울퉁불퉁한 패브릭 표면에 빽빽이 접착되고, 날실과 씨실 사이로 새어 나와 못과 같은 형태로 되어 높은 계면 결합력을 가질 수 있게 된다. 이러한 핫프레싱을 이용해 개발된 웨어러블 소자는 기존 의류에 접착할 수 있는 응용 가능성을 가지고 있어 공정 단가를 낮출 수 있을 것으로 기대된다.
☞ 비정질(amorphous): 고체 물질로, 균일한 조성은 가지고 있으나, 원자 배열이 액체와 같이 흐트러져 있는 물질. 유리, 고무, 수지 따위가 있으며 반도체, 자성체, 고강도 재료 따위로 쓴다.
한편, SAICAS를 이용한 계면 결착력 분석은 마이크로 스케일에서 칼날을 이용해 정량적 및 정성적으로 힘을 측정하는 방법으로, 기존 계면 결착력 측정 방법(박리 테스트, 테이프 테스트, 마이크로신축성 테스트)보다 훨씬 정확한 분석 기법으로, 본 연구에서 처음으로 웨어러블 소자에 도입됐다. SAICAS를 이용한 계면 결착력 분석은 향후 고분자를 이용한 웨어러블 소자 내구성 테스트의 새로운 방법으로 쓰일 수 있을 것으로 기대된다.
홍승범 교수는 "본 연구에서 개발된 패브릭 기반 웨어러블 압전 에너지 하베스터 제조 기술은 패브릭 기반 소자의 실용화 가능성을 한 단계 높였고, 계면 결착력 분석을 통해 고내구성 웨어러블 소자의 디자인 방향을 제시했다ˮ며 "이 기술은 패브릭과 고분자를 이용한 다른 소자의 제조 공정 및 분석에도 새로운 기틀을 마련할 수 있을 것으로 전망한다ˮ라고 말했다.
이번 연구는 KAIST HRHRP 사업, 과학기술정보통신부 재원 한국연구재단 지원 기초연구사업과 중견연구사업, 웨어러블 플랫폼소재 기술센터 지원 및 KAIST 글로벌 특이점 연구사업 지원으로 수행됐다.
2020.09.09 조회수 24484 화학과 박윤수 박사, 화학 분야 신진연구자 상 연달아 수상
〈 박윤수 박사, 장석복 교수 〉
우리 대학 화학과 박윤수 박사가 화학 분야 우수 신진연구자로 연달아 선정되는 성과를 달성했다. 화학 분야 세계 최대 학술단체인 미국화학회(ACS)와 세계 최대 과학출판사인 엘스비어(Elsevier)는 젊은 연구자 상 최종 수상자로 박윤수 박사를 선정했다고 각각 밝혔다.
박 박사는 미국화학회가 지난 5월 15일 발표한 ‘2019 카스 퓨처 리더스(CAS Future Leaders) 최종 명단에 이름을 올렸다. 올해로 10회를 맞이한 카스 퓨처 리더스는 화학 및 관련 연구 분야에서 두각을 드러내고 있는 박사와 박사후연구원에게 주어지는 상이다. 차세대 리더로써 잠재력을 갖춘 연구자를 선정해 네트워킹 등을 지원한다. 올해는 35개국 171명의 지원자 중 29명의 연구자가 최종 선발됐으며 한국인은 박 박사가 유일하다.
엘스비어는 ‘2019 리액시스 PhD 프라이즈(2019 Reaxys PhD Prize)’ 수상자로 박 박사가 선정됐다고 7월 30일 밝혔다. 2010년 출범한 리액시스 프라이즈는 최고 수준(best of the best)의 연구 역량을 갖춘 화학 분야 연구자에게만 수여되는 상으로, 올해는 360여 명의 후보자의 연구성과 및 성장 가능성을 종합적으로 평가해 45명의 수상자를 뽑았다.
최종 수상자들은 ‘리액시스 프라이즈 클럽(Reaxys Prize Club)’의 평생 회원이 돼 화학 분야의 국제적인 석학들과 함께 연구를 공유하며, 공동연구의 기회가 주어진다.
박윤수 박사는 화학과 재학시절부터 장석복 교수 지도하에 새로운 유기화학 반응개발을 중점적으로 연구 해왔다. 또하느 백무현 교수 공동 지도하에 양자 화학적 계산을 이용한 새로운 촉매 설계에 성공하기도 했다.
대표적인 성과로 2018년 국제학술지 ‘사이언스(Science)’와 ‘네이처 카탈리시스(Nature Catalysis)’에 연달아 보고한 연구가 있다. 이 연구를 통해 석유, 천연가스 등 자연에 풍부한 탄화수소로부터 유용한 의약품 및 화학소재 원료 물질인 락탐을 합성하는 데 성공했다. 이 외에도 박사과정으로 재학한 5년 동안 ‘미국화학회지(JACS)’를 포함해 저명한 국제학술지에 11편의 논문을 주저자로 게재했다.
박 박사는 “장석복, 백무현 교수님의 훌륭한 지도와 더불어 중장기적인 관점에서 연구를 지원하는 KAIST, IBS의 정책 덕분에 연구에만 온전히 집중할 수 있었던 것 같다”라며 “향후 유용성에도 불구하고 비싼 가격으로 인해 사용이 어려웠던 촉매의 가격을 낮추는 연구를 진행할 계획”이라고 말했다.
2019.08.02 조회수 11229
화학과 박윤수 박사, 화학 분야 신진연구자 상 연달아 수상
〈 박윤수 박사, 장석복 교수 〉
우리 대학 화학과 박윤수 박사가 화학 분야 우수 신진연구자로 연달아 선정되는 성과를 달성했다. 화학 분야 세계 최대 학술단체인 미국화학회(ACS)와 세계 최대 과학출판사인 엘스비어(Elsevier)는 젊은 연구자 상 최종 수상자로 박윤수 박사를 선정했다고 각각 밝혔다.
박 박사는 미국화학회가 지난 5월 15일 발표한 ‘2019 카스 퓨처 리더스(CAS Future Leaders) 최종 명단에 이름을 올렸다. 올해로 10회를 맞이한 카스 퓨처 리더스는 화학 및 관련 연구 분야에서 두각을 드러내고 있는 박사와 박사후연구원에게 주어지는 상이다. 차세대 리더로써 잠재력을 갖춘 연구자를 선정해 네트워킹 등을 지원한다. 올해는 35개국 171명의 지원자 중 29명의 연구자가 최종 선발됐으며 한국인은 박 박사가 유일하다.
엘스비어는 ‘2019 리액시스 PhD 프라이즈(2019 Reaxys PhD Prize)’ 수상자로 박 박사가 선정됐다고 7월 30일 밝혔다. 2010년 출범한 리액시스 프라이즈는 최고 수준(best of the best)의 연구 역량을 갖춘 화학 분야 연구자에게만 수여되는 상으로, 올해는 360여 명의 후보자의 연구성과 및 성장 가능성을 종합적으로 평가해 45명의 수상자를 뽑았다.
최종 수상자들은 ‘리액시스 프라이즈 클럽(Reaxys Prize Club)’의 평생 회원이 돼 화학 분야의 국제적인 석학들과 함께 연구를 공유하며, 공동연구의 기회가 주어진다.
박윤수 박사는 화학과 재학시절부터 장석복 교수 지도하에 새로운 유기화학 반응개발을 중점적으로 연구 해왔다. 또하느 백무현 교수 공동 지도하에 양자 화학적 계산을 이용한 새로운 촉매 설계에 성공하기도 했다.
대표적인 성과로 2018년 국제학술지 ‘사이언스(Science)’와 ‘네이처 카탈리시스(Nature Catalysis)’에 연달아 보고한 연구가 있다. 이 연구를 통해 석유, 천연가스 등 자연에 풍부한 탄화수소로부터 유용한 의약품 및 화학소재 원료 물질인 락탐을 합성하는 데 성공했다. 이 외에도 박사과정으로 재학한 5년 동안 ‘미국화학회지(JACS)’를 포함해 저명한 국제학술지에 11편의 논문을 주저자로 게재했다.
박 박사는 “장석복, 백무현 교수님의 훌륭한 지도와 더불어 중장기적인 관점에서 연구를 지원하는 KAIST, IBS의 정책 덕분에 연구에만 온전히 집중할 수 있었던 것 같다”라며 “향후 유용성에도 불구하고 비싼 가격으로 인해 사용이 어려웠던 촉매의 가격을 낮추는 연구를 진행할 계획”이라고 말했다.
2019.08.02 조회수 11229 이지현 교수, CAADRIA 학회 사사다 상 수상
〈 이지현 교수 〉
우리 대학 문화기술대학원 이지현 교수가 15일 뉴질랜드 웰링턴에서 열린 컴퓨터 기반 건축 디자인 분야 국제학회 ‘CAADRIA 2019(the 24th Annual Conference of the Association for Computer-Aided Architectural Design Research in Asia)’에서 사사다 상(Sasada Prize)을 받았다.
건축 디자인 관련 세계 최고 학회 중 하나인 CAADRIA가 2007년 츠요시 사사다(Tsuyoshi Sasada, 1941-2005) 교수를 기리기 위해 제정한 사사다 상(Sasada Award)은 컴퓨터 보조 설계 차세대 연구자들을 지원하기 위한 CAADRIA의 미션 중 하나이다. 해당 분야 커뮤니티에 지속적인 공헌을 하고 탁월한 연구 성과를 낸 연구자에게 수여된다.
수상자인 이지현 교수는 최민규, 김미래 석사과정, 이태하 박사과정과 함께 연구한 ‘사례기반추론을 통한 부동산 지가 예측 시스템 (Land Price Prediction System Using Case-based Reasoning)’ 연구를 기반으로 그동안 CAAD (Computer-Aided Architectural Design) 분야에 기여한 점을 인정받아 2019년 수상자로 선정됐다.
이지현 교수는 해당 연구를 통해 서울특별시와 울산광역시를 제외한 6대 광역시로부터 40여 개 변수를 행정동 단위로 수집한 후 사례기반 추론 방법을 적용해 행정동 내의 평균 평당 아파트 가격을 예측하는 모델을 제시했다. 연구팀이 도출한 모델의 후속연구가 수행되면 기존의 전문가 판단을 대체할 수 있을 것이라는 가능성을 보여줬다.
이지현 교수는 수상 관련 연구 내용인 추천과 예측을 할 수 있는 인공지능의 한 분야인 사례기반추론(Case Based Reasoning)관련 2002년 졸업논문부터 근 20년간 꾸준하게 연구를 진행해 왔으며, CBR 관련 국내외 논문 40여 편을 발표한 바 있다.
이지현 교수는 “CAAD 관련 연구자에게 자랑스러운 상을 받게 돼 개인적으로는 매우 큰 영광이라 생각하지만 지난 수상자들을 볼 때 과분하다는 생각도 든다”라며 “6월 KAIST에서 열리는 ‘CAAD Futures 2019’가 성공적으로 이뤄질 수 있도록 준비함과 동시에 앞으로도 꾸준하게 CAAD 및 컴퓨테이셔널 디자인 연구를 선보여 국내외에서 KAIST의 위상을 높이는데 기여하겠다”라고 말했다.
2019.04.19 조회수 10264
이지현 교수, CAADRIA 학회 사사다 상 수상
〈 이지현 교수 〉
우리 대학 문화기술대학원 이지현 교수가 15일 뉴질랜드 웰링턴에서 열린 컴퓨터 기반 건축 디자인 분야 국제학회 ‘CAADRIA 2019(the 24th Annual Conference of the Association for Computer-Aided Architectural Design Research in Asia)’에서 사사다 상(Sasada Prize)을 받았다.
건축 디자인 관련 세계 최고 학회 중 하나인 CAADRIA가 2007년 츠요시 사사다(Tsuyoshi Sasada, 1941-2005) 교수를 기리기 위해 제정한 사사다 상(Sasada Award)은 컴퓨터 보조 설계 차세대 연구자들을 지원하기 위한 CAADRIA의 미션 중 하나이다. 해당 분야 커뮤니티에 지속적인 공헌을 하고 탁월한 연구 성과를 낸 연구자에게 수여된다.
수상자인 이지현 교수는 최민규, 김미래 석사과정, 이태하 박사과정과 함께 연구한 ‘사례기반추론을 통한 부동산 지가 예측 시스템 (Land Price Prediction System Using Case-based Reasoning)’ 연구를 기반으로 그동안 CAAD (Computer-Aided Architectural Design) 분야에 기여한 점을 인정받아 2019년 수상자로 선정됐다.
이지현 교수는 해당 연구를 통해 서울특별시와 울산광역시를 제외한 6대 광역시로부터 40여 개 변수를 행정동 단위로 수집한 후 사례기반 추론 방법을 적용해 행정동 내의 평균 평당 아파트 가격을 예측하는 모델을 제시했다. 연구팀이 도출한 모델의 후속연구가 수행되면 기존의 전문가 판단을 대체할 수 있을 것이라는 가능성을 보여줬다.
이지현 교수는 수상 관련 연구 내용인 추천과 예측을 할 수 있는 인공지능의 한 분야인 사례기반추론(Case Based Reasoning)관련 2002년 졸업논문부터 근 20년간 꾸준하게 연구를 진행해 왔으며, CBR 관련 국내외 논문 40여 편을 발표한 바 있다.
이지현 교수는 “CAAD 관련 연구자에게 자랑스러운 상을 받게 돼 개인적으로는 매우 큰 영광이라 생각하지만 지난 수상자들을 볼 때 과분하다는 생각도 든다”라며 “6월 KAIST에서 열리는 ‘CAAD Futures 2019’가 성공적으로 이뤄질 수 있도록 준비함과 동시에 앞으로도 꾸준하게 CAAD 및 컴퓨테이셔널 디자인 연구를 선보여 국내외에서 KAIST의 위상을 높이는데 기여하겠다”라고 말했다.
2019.04.19 조회수 10264 강성모 총장, 존 쵸마 교육상 수상
강성모 총장이 26일(화) 오후(현지시간) 포르투갈 리스본 벨럼컨벤션센터에서 열린 ′회로 및 시스템학회 학술대회(IEEE-ISCAS 2015)′에서 존 쵸마 교육상을 수상했다.
존 쵸마(John Choma)교육상은 회로 및 시스템 분야의 교육발전에 기여한 자에게 수여하는 상으로 ′전기전자공학자협회 소속 회로 및 시스템 학회(IEEE-CAS)′가 회원들 중에서 그 수상자를 선발한다.
강 총장은 지난 40여 년 동안 대학에 근무하면서 회로 및 시스템 분야 박사 60여명을 배출하고 450여 편의 논문을 발표해 교육 전문가로서의 리더십을 인정받았다.
IEEE-CAS가 수여하는 봉사상, 학술상, 학회 최고상을 수상한 바 있는 강 총장은 이번 수상으로 네 번째 수상의 영예를 안았다.
한편, 강 총장은 이날 심포지엄의 특별 세션에 참석해 ‘멤리스터 기반의 시냅시스와 뇌 모방 컴퓨팅 기술을 위한 신경세포’를 주제로 논문도 발표했다. 끝.
2015.05.27 조회수 7219
강성모 총장, 존 쵸마 교육상 수상
강성모 총장이 26일(화) 오후(현지시간) 포르투갈 리스본 벨럼컨벤션센터에서 열린 ′회로 및 시스템학회 학술대회(IEEE-ISCAS 2015)′에서 존 쵸마 교육상을 수상했다.
존 쵸마(John Choma)교육상은 회로 및 시스템 분야의 교육발전에 기여한 자에게 수여하는 상으로 ′전기전자공학자협회 소속 회로 및 시스템 학회(IEEE-CAS)′가 회원들 중에서 그 수상자를 선발한다.
강 총장은 지난 40여 년 동안 대학에 근무하면서 회로 및 시스템 분야 박사 60여명을 배출하고 450여 편의 논문을 발표해 교육 전문가로서의 리더십을 인정받았다.
IEEE-CAS가 수여하는 봉사상, 학술상, 학회 최고상을 수상한 바 있는 강 총장은 이번 수상으로 네 번째 수상의 영예를 안았다.
한편, 강 총장은 이날 심포지엄의 특별 세션에 참석해 ‘멤리스터 기반의 시냅시스와 뇌 모방 컴퓨팅 기술을 위한 신경세포’를 주제로 논문도 발표했다. 끝.
2015.05.27 조회수 7219