%EB%A9%B4%EC%97%AD%ED%95%AD%EC%95%94
-
 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 2091
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 2091 -
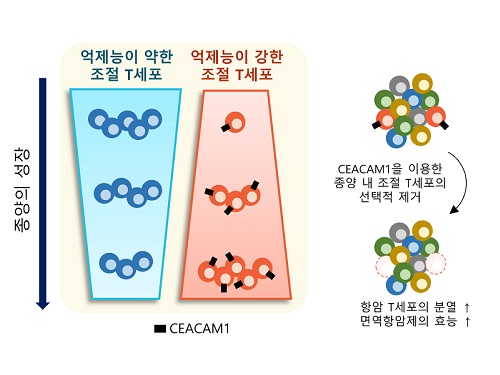 표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3164
표적단백질 시캠1 발굴로 새로운 암 면역치료법 제시
우리 몸에는 면역반응의 과도한 유도를 조절하고 자가면역질환의 발생을 억제하는 역할을 하는 조절 T세포가 있는데, 종양 내에 존재하여 면역세포의 암세포 제거 능력을 저해하는 조절 T세포만을 골라서 제거할 수 있는 암 면역치료법이 개발됐다.
우리 대학 의과학대학원 박수형 교수 연구팀이 우리 대학 의과학대학원 신의철 교수, 삼성서울병원 서성일, 강민용 교수팀과 공동연구를 통해 종양 내 조절 T세포의 선택적 제거를 통한 신규 면역항암 전략을 제시했다고 6일 밝혔다.
이번 연구는 우리 몸에 존재하는 조절 T세포에는 영향을 주지 않으면서 종양 내에 존재하는 조절 T세포를 선택적으로 제거하는 것을 가능케 하는 새로운 표적 단백질인 시캠1(이후 CEACAM1)을 발굴하고, 이를 타겟으로 종양 내 조절 T세포를 선택적으로 제거했을 때, 최근 암 환자에게 널리 쓰이는 기존 면역항암제의 효능을 월등히 증가시킬 수 있음을 증명하였다.
암 환자의 종양 내 조절 T세포를 선택적으로 제거하는 치료의 개발은 많은 암 연구자들의 관심사다. 종양 내 조절 T세포를 선택적으로 제거하기 위해서는 해당 세포에만 특이적으로 높게 발현하는 이른바 표적 단백질을 발굴해야 한다.
KAIST-삼성서울병원 공동연구진은 이번 연구에서 신장암 환자로부터 얻은 조직과 혈액을 분석해서 CEACAM1이 혈액에 존재하는 조절 T세포에는 발현되지 않지만, 종양 내 조절 T세포에서만 선택적으로 발현된다는 것을 발견했다. 연구진은 또한 단일세포 전사체 데이터를 분석해 그러한 양상이 신장암에 국한되지 않고 다양한 암종에서 나타남을 확인했다.
연구진은 신장암 환자의 종양 내 면역세포에서 CEACAM1을 발현하는 종양 내 조절 T세포를 제거했을 때 면역항암 작용을 하는 면역세포의 종양 제거 능력이 월등히 증가되는 현상을 관찰했다. 더불어, CEACAM1을 발현하는 면역세포를 제거함으로써 대표적인 면역항암제인 면역관문억제제(Immune Checkpoint Inhibitor)의 면역항암 기능이 월등히 증가됨을 확인했다.
연구진은 이 결과를 토대로 CEACAM1을 발현하는 종양 내 조절 T세포가 항종양 면역반응을 억제하는 주된 세포임을 밝혔고, 이 세포의 세부적인 특성을 파악하고 선택적으로 제거하거나 이를 표적으로 하는 치료 전략이 매우 효과적인 항암치료 및 면역치료제 개발에도 활용이 될 것으로 전망한다고 설명했다.
이번 연구의 공동 제1 저자인 KAIST 전승혁 박사와 삼성서울병원 강민용 교수는 "이번 연구 결과는 새로운 표적 단백질을 발굴함과 동시에 종양 내 조절 T세포의 생물학적 특징에 대한 이해를 높였다는 측면에서 중요한 연구이며, 이번 연구의 결과가 궁극적으로 면역항암제에 대한 저항성을 극복하는 해결책이 될 것으로 기대한다ˮ고 설명했다.
삼성서울병원 서성일 교수는 “이번 연구는 임상 샘플을 사용해 종양 내 조절 T세포 제거 치료의 단서를 발견했다는 점에서 의의가 있다”며 “CEACAM1의 발현이 종양의 성장과도 밀접한 연관이 있어 바이오마커로써 응용될 가능성도 있다”고 말했다.
박수형 교수는 “종양 내 조절 T세포를 제어하는 치료는 많은 연구자가 관심을 가지는 분야이지만 아직 이를 이용한 치료법은 개발되지 않은 실정”이라며 “이번 연구에서 발굴한 CEACAM1이 종양 내 조절 T세포의 제거 치료제 개발에 실마리를 제공할 수 있을 것ˮ이라고 덧붙였다.
과학기술정보통신부 중견연구자지원사업과 기초연구실지원사업을 받아 수행한 이번 연구 결과는 미국암학회 (American Association for Cancer Research)에서 발행하는 종양 분야 저명 학술지인 Clinical Cancer Research에 최근 게재됐다 (논문명: CEACAM1 marks highly suppressive intratumoral regulatory T cells for targeted depletion therapy).
2023.03.06 조회수 3164 -
 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 5902
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 5902 -
 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 25056
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 25056 -
 인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
2021.01.29 조회수 71233
인공지능 이용 면역항암 세포 3차원 분석기술 개발
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀이 면역항암 세포의 활동을 정밀하게 측정하고 분석할 수 있는 새로운 3차원 인공지능 분석기술을 개발했다고 28일 밝혔다.
체내에서 면역세포를 추출한 후, 외부에서 면역 능력을 강화시키고 다시 환자에게 주입해 암을 치료하는 방식을 `입양전달 면역세포 치료(adoptive immune cell therapy)'라고 부른다. 이 치료방식은 면역세포 치료법 중 가장 많은 주목을 받는 기술이다. `키메릭 항원 수용체' 또는 `CAR(Chimeric Antigen Receptor)'라고도 불리는 데 유전자 재조합기술을 이용해 T세포와 같은 면역세포를 변형해 암세포와의 반응을 유도해 사멸시키는 치료 방법이다.
특히 CAR-T세포 치료는 높은 치료 효과를 보여 차세대 암 치료제로 급부상하고 있다. 2017년 난치성 B세포 급성 림프구성 백혈병 치료제 판매 승인을 시작으로 현재 3종의 CAR-T 치료제가 판매 승인을 받았으며, 전 세계적으로 약 1,000건 이상의 임상 시험이 진행 중이다. 그러나 아직 우리나라에서는 진행 중인 임상 시험이 전무한 실정이다.
CAR-T 기술을 이용한 암 치료 방법들이 속속 개발되고 있지만, CAR-T세포에 대한 세포‧분자 생물학적 메커니즘은 아직 많은 부분이 알려지지 않았다. 특히, CAR-T세포가 표적 암세포를 인지해 결합한 후 `면역 시냅스 (immunological synapse, 이하 IS)'를 형성해 물질을 전달하고 암세포의 사멸을 유도하는데, 두 세포 간의 거리와 같은 IS의 형태 정보는 T세포 활성화 유도와 관련이 높다고 알려져 있지만 구체적인 내용을 파악하기 어렵기 때문에 이에 대한 연구가 활발히 진행 중이다.
우리 대학 물리학과 박용근, 생명과학과 김찬혁 교수 공동연구팀은 CAR-T세포의 IS를 정밀하고 체계적으로 연구할 수 있는 새로운 기술을 개발했다. 3D 홀로그래피 현미경 기술을 이용해, 염색이나 전처리 없이 살아있는 상태의 CAR-T세포와 표적 암세포 간의 상호작용을 고속으로 측정하고 기존에는 관찰하기 어려운 CAR-T와 암세포 간의 IS를 고해상도로 실시간 측정했다. 또한 이렇게 측정한 3D 세포 영상을 인공지능 신경망(Convolutional Neural Network, CNN)을 이용해 분석하고, 3차원 공간에서 정확하게 IS 정보를 정량적으로 추출할 수 있는 기술을 자체 개발했다.
공동연구팀은 또 이 기술을 활용해 빠른 CAR-T 면역 관문 형성 메커니즘을 추적할 수 있었을 뿐만 아니라, IS의 형태학적 특성이 CAR-T의 항암 효능과 연관이 있음을 확인했다. 연구팀은 3차원 IS 정보가 새로운 표적 항암 치료제의 초기 연구에 필요한 정량적 지표를 제공할 것이라고 기대하고 있다.
이번 연구에는 우리 대학 기술을 바탕으로 창업한 2개 기업이 공동으로 참여했다. 3차원 홀로그래픽 현미경을 상업화한 토모큐브 社의 현미경 장비를 이용해 면역세포를 측정하는 한편 토모큐브 社의 인공지능 연구팀이 알고리즘 개발에 참여했다. 이밖에 국내 최초 CAR-T 기반 치료제 기업인 ㈜큐로셀도 연구에 함께 참여해 이 같은 성과를 거두는 데 성공했다.
물리학과 이무성 박사과정 학생, 생명과학과 이영호 박사, 물리학과 송진엽 학부생 (現 메사추세츠 공과대학(MIT) 물리학과 박사과정)이 공동 제1 저자로 참여한 이번 연구는 국제적으로 권위를 인정받는 생물학술지인 `이라이프(eLife)' 12월 17일 字 온라인판을 통해 공개됐으며 지난 21일 字에 공식 게재됐다.
(논문명 : Deep-learning based three-dimensional label-free tracking and analysis of immunological synapses of CAR-T cells)
한편 이번 연구는 한국연구재단 리더연구사업, 바이오·의료기술개발사업, 중견연구자지원사업, KAIST Up program의 지원을 받아 수행됐다.
2021.01.29 조회수 71233