연구

< (왼쪽부터) 생명과학과 김윤기 교수, 조원기 교수, 황현정 박사, 박태림 박사과정, 김형인 박사과정 >
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
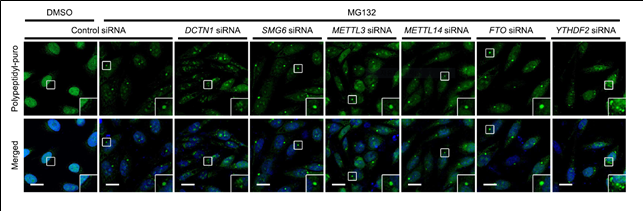
< 그림 1. 비정상 단백질 집합소(애그리좀) 형성에 관여하는 YTHDF2 단백질. 면역형광법을 이용하여 YTHDF2 단백질이 없을 때 애그리좀이 잘 형성되지 않는 것을 보여줬다. 이는 YTHDF2 단백질이 애그리좀 형성에 관여하는 인자임을 보여준다. >
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
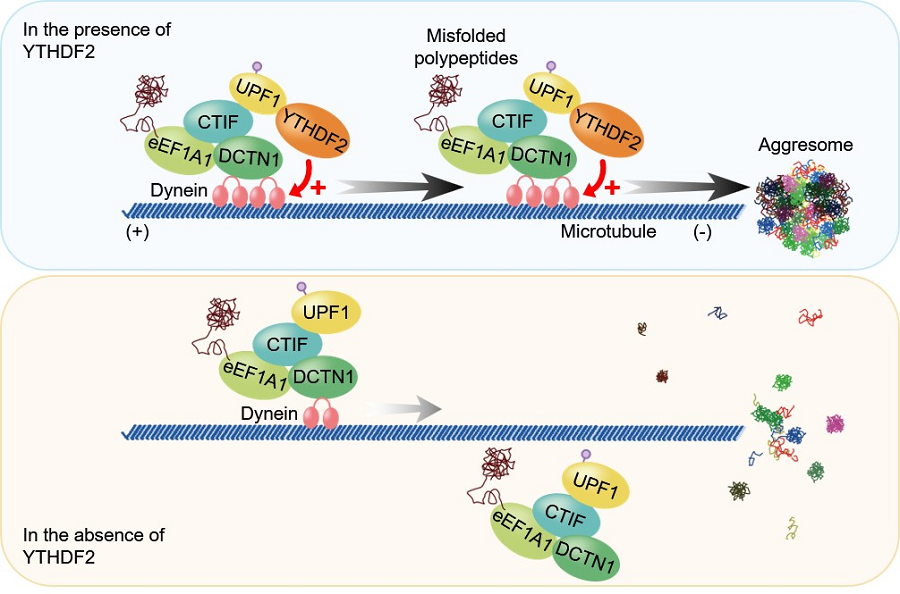
< 그림 2. YTHDF2 단백질을 통한 비정상 단백질 제거 메커니즘. 비정상 단백질이 세포 내에 축적될 경우, CTIF-eEF1A1-디낵틴1-UPF1 복합체가 잘못된 단백질을 인식한다. YTHDF2 단백질은 UPF1과의 상호작용을 통해 복합체에 합류하며, 복합체와 디네인 사이의 상호작용을 조절한다. YTHDF2 단백질이 존재할 때, 복합체와 디네인 사이의 상호작용이 증가하며 비정상 단백질의 수송이 촉진되어 정상적으로 애그리좀이 형성된다. 형성된 애그리좀은 최종적으로 리소좀에 의해 세포 내에서 제거된다. >
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
- No Data